Trắc nghiệm Tổng hợp bài tập tính khử của C, CO, H2 - Hóa 11Đề bài
Câu 1 :
Trộn 20 gam bột CuO và một lượng C rồi đem nung nóng, sau một thời gian phản ứng thấy có 3,36 lít khí thoát ra khỏi bình. Khối lượng chất rắn thu được là
Câu 2 :
Cho luồng khí CO dư đi qua 9,1 gam hỗn hợp CuO và Al2O3, nung nóng đến khi phản ứng hoàn toàn thu được 8,3 gam chất rắn. Khối lượng CuO có trong hỗn hợp ban đầu là
Câu 3 :
Cho khí CO dư qua 18 gam oxit kim loại M thu được 14 gam kim loại. Công thức của oxit là
Câu 4 :
Khử hoàn toàn 17,6 gam hỗn hợp gồm Fe, FeO, Fe2O3 cần 4,48 lít H2 (đktc). khối lượng sắt thu được là
Câu 5 :
Khử hoàn toàn 32 gam hỗn hợp CuO và Fe2O3 bằng khí H2, thấy tạo ra 9 gam nước. Tính khối lượng hỗn hợp kim loại thu được?
Câu 6 :
Cho V lít (đktc) khí H2 đi qua bột CuO đun nóng, thu được 32 gam Cu. Nếu cho V lít H2 đi qua bột Fe3O4 đun nóng thì lượng Fe thu được là:
Câu 7 :
Để khử hoàn toàn hỗn hợp FeO và ZnO thành kim loại cần 2,24 lít H2 ở đktc. Nếu đem hỗn hợp kim loại thu được hoà tan hoàn toàn vào axit HCl thì thể tích khí H2 (đktc) thu được là
Câu 8 :
Cho khí CO dư đi qua 15 gam hỗn hợp X gồm CuO, NiO, Fe2O3, ZnO thu được 11,8 gam chất rắn Y gồm các kim loại. Thể tích dung dịch Z gồm H2SO4 1,0M và HCl 0,5M cần dùng để hoà tan hết 15,0 gam hỗn hợp X là
Câu 9 :
Đốt cháy không hoàn toàn một lượng sắt đã dùng hết 2,24 lít O2 ở đktc, thu được hỗn hợp A gồm các oxit sắt và sắt dư. Khử hoàn toàn A bằng khí CO dư, khí đi ra sau phản ứng được dẫn vào bình đựng nước vôi trong dư. Khối lượng kết tủa thu được là
Câu 10 :
Thổi một luồng khí CO dư đi qua ống đựng hỗn hợp 2 oxit Fe3O4 và CuO nung nóng đến khi phản ứng xảy ra hoàn toàn thu được 2,32 gam hỗn hợp kim loại. Khí thoát ra được đưa vào bình đựng dung dịch Ca(OH)2 dư thấy có 5 gam kết tủa trắng. Khối lượng hỗn hợp 2 oxit kim loại ban đầu là:
Câu 11 :
Thổi CO dư qua m gam hỗn hợp CuO, Fe2O3, ZnO, PbO nóng đỏ thu được 2,32 gam kim loại. Khí thoát ra cho vào bình nước vôi trong được 5 gam kết tủa, đun tiếp dung dịch lại thấy có thêm 10 gam kết tủa. Giá trị của m là:
Câu 12 :
Cho 4,48 lít khí CO (ở đktc) từ từ đi qua ống sứ nung nóng đựng 8 gam một oxit sắt đến khi phản ứng xảy ra hoàn toàn. Khí thu được sau phản ứng có tỉ khối so với hiđro bằng 20. Công thức của oxit sắt và phần trăm thể tích của khí CO2 trong hỗn hợp khí sau phản ứng là:
Câu 13 :
Dẫn khí CO đi qua 12 gam CuO nung nóng thu được chất rắn X và khí CO2. Hấp thụ hoàn toàn khí CO2 sinh ra bằng 200 ml dung dịch Ba(OH)2 0,9M thì thu được 23,64 gam kết tủa. Cho chất rắn X vào dung dịch AgNO3 dư thu được m gam kết tủa. Tính m:
Câu 14 :
Hỗn hợp A gồm 0,56 gam Fe và 16 gam Fe2O3 và x (mol) Al rồi nung ở nhiệt độ cao không có không khí (giả sử chỉ xảy ra sự khử Fe2O3 thành Fe), sau khi kết thúc phản ứng được hỗn hợp D. Nếu cho D tan trong H2SO4 loãng được V lít khí nhưng nếu cho D tác dụng với NaOH dư thì thu được 0,25V lít khí. Giá trị của x là
Câu 15 :
Cho khí CO dư đi qua hỗn hợp gồm CuO, Al2O3, MgO(nung nóng). Sau khi phản ứng xảy ra hoàn toàn chất rắn thu được gồm
Câu 16 :
Thổi từ từ V lít CO (đktc) đi qua ống sứ đựng 51,6 gam hỗn hợp X gồm CuO, Al2O3 và Fe3O4 (tỉ lệ mol lần lượt là 1:2:1). Các phản ứng xảy ra hoàn toàn, kết thúc phản ứng thu được hỗn hợp khí Y có tỉ khối so với H2 bằng 19. Cho toàn bộ lượng khí Y hấp thụ vào dung dịch Ca(OH)2 thu được 30 gam kết tủa và dung dịch Z. Cho dung dịch Z phản ứng với lượng dư dung dịch Ba(OH)2 dư thấy tạo thành m gam kết tủa. Giá trị của V và m lần lượt là:
Câu 17 :
Khí CO không khử được chất nào sau đây ở nhiệt độ cao:
Câu 18 :
Khử hoàn toàn 14g hỗn hợp X gồm CuO và một oxit sắt bằng CO thu được 10,32g hỗn hợp Y gồm 2 kim loại. Thể tích CO (đktc) đã dùng cho quá trình trên là:
Câu 19 :
Cho từ từ khí CO đi qua ống đựng 3,2 gam CuO nung nóng. Khí thoát ra khỏi ống được hấp thụ hoàn toàn vào nước vôi trong dư tạo thành 1 gam kết tủa. Chất rắn còn lại trong ống sứ cho vào cốc đựng 500 ml dung dịch HNO3 0,16M thu được V1 lít khí NO và còn một phần kim loại chưa tan. Thêm tiếp vào cốc 760 ml dung dịch HCl 2/3 M, sau khi phản ứng xong thu thêm V2 lít khí NO. Biết NO là sản phẩm khử duy nhất của N+5, các phản ứng xảy ra hoàn toàn. V2 gần nhất với giá trị nào sau đây
Câu 20 :
Cho khí CO qua ống sứ chứa 10 gam hỗn hợp chất rắn X gồm CuO; Fe2O3; FeO; Fe3O4 và MgO nung nóng. Sau một thời gian thu được hỗn hợp khí Y và 8 gam rắn Z. Cho Y qua dung dịch nước vôi trong dư thu được m gam kết tủa. Giá trị m là
Câu 21 :
Cho hơi nước đi qua than nóng đỏ, thu được hỗn hợp khí X gồm CO, CO2 và H2. Cho toàn bộ X qua bình đựng dung dịch nước vôi dư thu được 10 gam kết tủa. Khí không bị hấp thụ thoát ra được dẫn qua ống đựng CuO (dư) nung nóng thu được hỗn hợp chất rắn Y. Hòa tan toàn bộ Y bằng dung dịch HNO3 (loãng, dư) thu được 8,96 lít khí NO (sản phẩm khử duy nhất). Biết các phản ứng xảy ra hoàn toàn. Phần trăm thể tích khí CO trong X là
Câu 22 :
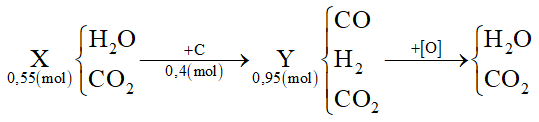
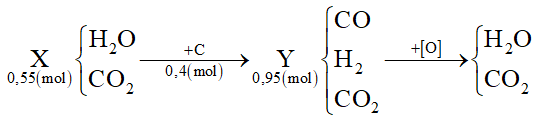
Dẫn 0,55 mol hỗn hợp X (gồm hơi nước và khí CO2) qua cacbon nung đỏ thu được 0,95 mol hỗn hợp Y gồm CO, H2 và CO2. Cho Y hấp thụ vào dung dịch chứa 0,1 mol Ba(OH)2 sau khi phản ứng xảy ra hoàn toàn, thu được m gam kết tủa. Giá trị của m là
Câu 23 :
Khử hoàn tàn 4,8 gam Fe2O3 bằng CO dư ở nhiệt độ cao. Khối lượng Fe thu được sau phản ứng là
Câu 24 :
Hỗn hợp X gồm FeO, Fe2O3 và Fe3O4.Cho khí CO qua m gam X nung nóng, sau một thời gian thu được hỗn hợp chất rắn Y và hỗn hợp khí Z. Cho toàn bộ Z vào dung dịch Ca(OH)2 dư, đến khi phản ứng hoàn toàn, thu được 4 gam kết tủa. Mặt khác, hòa tan hoàn toàn Y trong dung dịch H2SO4 đặc nóng dư thu được 1,008 lít khí SO2 (đktc, sản phẩm khử duy nhất) và dung dịch chứa 18 gam muối. Giá trị của m là:
Câu 25 :
Dẫn 0,55 mol hỗn hợp X (gồm hơi nước và khí CO2) qua cacbon nung đỏ, thu được 0,95 mol hỗn hợp Y gồm CO, H2 và CO2. Cho Y hấp thụ vào dung dịch chứa 0,1 mol Ba(OH)2, sau khi phản ứng xảy ra hoàn toàn, thu được m gam kết tủa. Giá trị của m là
Câu 26 :
Dẫn a mol hỗn hợp X (gồm hơi nước và khí CO2) qua cacbon nung đỏ, thu được 1,8a mol hỗn hợp khí Y gồm CO, H2 và CO2. Cho Y đi qua ống đựng hỗn hợp gồm CuO và Fe2O3 (dư, nung nóng), sau khi các phản ứng xảy ra hoàn toàn, khối lượng chất rắn giảm 1,28 gam. Giá trị của a là
Câu 27 :
Dẫn luồng khí CO dư qua hỗn hợp CuO, Al2O3, CaO, MgO có số mol bằng nhau (nung nóng ở nhiệt độ cao) thu được chất rắn A. Hòa tan A vào nước dư còn lại chất rắn X. X gồm:
Câu 28 :
Cho một luồng khí CO đi qua ống đựng 10g Fe2O3 nung nóng.Sau một thời gian thu được m gam hổn hợp X gồm 3 oxit sắt. Cho X tác dụng hết với dd HNO3 0,5M (vừa đủ) thu được dd Y và 1,12 lít NO (đktc) duy nhất. Thể tích CO đã dùng (đktc) và giá trị của m là
Lời giải và đáp án
Câu 1 :
Trộn 20 gam bột CuO và một lượng C rồi đem nung nóng, sau một thời gian phản ứng thấy có 3,36 lít khí thoát ra khỏi bình. Khối lượng chất rắn thu được là
Đáp án : A Phương pháp giải :
CuO + C $\xrightarrow{{{t}^{o}}}$ Cu + CO +) nCO = nCuO phản ứng = nCu tạo thành => mchất rắn sau phản ứng = mCu + mCuO dư Lời giải chi tiết :
CuO + C $\xrightarrow{{{t}^{o}}}$ Cu + CO nCO = 3,36 / 22,4 = 0,15 mol => nCuO phản ứng = 0,15 mol => mCuO dư = 20 – 0,15.80 = 8 gam nCu tạo thành = nCuO phản ứng = 0,15 mol => mCu = 0,15.64 = 9,6 gam => mchất rắn sau phản ứng = 8 + 9,6 = 17,6 gam Chú ý
quên tính khối lượng CuO dư => chọn nhầm C
Câu 2 :
Cho luồng khí CO dư đi qua 9,1 gam hỗn hợp CuO và Al2O3, nung nóng đến khi phản ứng hoàn toàn thu được 8,3 gam chất rắn. Khối lượng CuO có trong hỗn hợp ban đầu là
Đáp án : B Phương pháp giải :
CO + CuO $\xrightarrow{{{t}^{o}}}$ Cu + CO2 +) mCuO – mCu = mO phản ứng Lời giải chi tiết :
Al2O3 không bị khử bởi CO CO + CuO $\xrightarrow{{{t}^{o}}}$ Cu + CO2 x mol → x mol => mCuO – mCu = 9,1 – 8,3 = 0,8 => 80x – 64x = 0,8 => x = 0,05 mol => mCuO = 80.0,05 = 4 gam
Câu 3 :
Cho khí CO dư qua 18 gam oxit kim loại M thu được 14 gam kim loại. Công thức của oxit là
Đáp án : C Phương pháp giải :
+) Bảo toàn khối lượng: moxit = mO + mkim loại +) Tính Moxit => CTPT oxit Lời giải chi tiết :
Bảo toàn khối lượng: moxit = mO + mkim loại => mO = 18 – 14 = 4 gam => nO trong oxit = 4 / 16 = 0,25 mol Moxit = 18 : 0,25 = 72 g/mol (FeO)
Câu 4 :
Khử hoàn toàn 17,6 gam hỗn hợp gồm Fe, FeO, Fe2O3 cần 4,48 lít H2 (đktc). khối lượng sắt thu được là
Đáp án : B Phương pháp giải :
+) nO (trong oxit) = nH2 +) mFe = moxit - mO Lời giải chi tiết :
nO (trong oxit) = nH2 = 0,2 mol => mO = 16.0,2 = 3,2 gam mFe = 17,6 - 3,2 = 14,4 gam
Câu 5 :
Khử hoàn toàn 32 gam hỗn hợp CuO và Fe2O3 bằng khí H2, thấy tạo ra 9 gam nước. Tính khối lượng hỗn hợp kim loại thu được?
Đáp án : A Phương pháp giải :
+) nO của oxit = nH2O +) mkim loại = moxit – mO Lời giải chi tiết :
nO của oxit = nH2O = 0,5 => mO = 16.0,5 = 8 gam mkim loại = 32 - 8 = 24 gam
Câu 6 :
Cho V lít (đktc) khí H2 đi qua bột CuO đun nóng, thu được 32 gam Cu. Nếu cho V lít H2 đi qua bột Fe3O4 đun nóng thì lượng Fe thu được là:
Đáp án : A Phương pháp giải :
H2 + CuO $\xrightarrow{{{t}^{o}}}$ Cu + H2O +) nH2 = nO (trong oxit) = nCuO = nCu +) nFe3O4 = ¼.nO (trong Fe3O4) ; nFe = 3.nFe3O4 Lời giải chi tiết :
H2 + CuO $\xrightarrow{{{t}^{o}}}$ Cu + H2O nH2 = nO (trong oxit) = nCuO = nCu = 0,5 mol Bảo toàn O: nFe3O4 = ¼.nO (trong Fe3O4) = ¼.nH2 phản ứng = 1/4 . 0,5 = 0,125 mol Bảo toàn Fe: nFe = 3.nFe3O4 = 3.0,125 = 0,375 mol => mFe = 21 gam Chú ý
+ quên nhân 3 ở biểu thức bảo toàn Fe => chọn nhầm B + lấy số mol Fe = số mol Cu => chọn nhầm C
Câu 7 :
Để khử hoàn toàn hỗn hợp FeO và ZnO thành kim loại cần 2,24 lít H2 ở đktc. Nếu đem hỗn hợp kim loại thu được hoà tan hoàn toàn vào axit HCl thì thể tích khí H2 (đktc) thu được là
Đáp án : B Phương pháp giải :
+) nhh oxit = nH2 = nhh kim loại +) Khi hoà tan hỗn hợp kim loại cùng hóa trị II vào axit thì : nH2 = nhh kim loại Lời giải chi tiết :
nhh oxit = nH2 = nhh kim loại = 0,1 mol Khi hoà tan hỗn hợp kim loại cùng hóa trị II vào axit thì : nH2 = nhh kim loại = 0,1 VH2 = 22,4.0,1 = 2,24 lít
Câu 8 :
Cho khí CO dư đi qua 15 gam hỗn hợp X gồm CuO, NiO, Fe2O3, ZnO thu được 11,8 gam chất rắn Y gồm các kim loại. Thể tích dung dịch Z gồm H2SO4 1,0M và HCl 0,5M cần dùng để hoà tan hết 15,0 gam hỗn hợp X là
Đáp án : A Phương pháp giải :
Bảo toàn khối lượng: mO (trong X) = moxit – mkim loại Bảo toàn nguyên tố H và O : ∑nH+ = 2.nH2O = 2.nO trong X Lời giải chi tiết :
Bảo toàn khối lượng: mO (trong X) = moxit – mkim loại => nO trong X = (15 – 11,8) : 16 = 0,2 mol Bảo toàn nguyên tố H và O : ∑nH+ = 2.nH2O = 2.nO trong X => 2V + 0,5V = 0,2.2 => V = 0,16 lít
Câu 9 :
Đốt cháy không hoàn toàn một lượng sắt đã dùng hết 2,24 lít O2 ở đktc, thu được hỗn hợp A gồm các oxit sắt và sắt dư. Khử hoàn toàn A bằng khí CO dư, khí đi ra sau phản ứng được dẫn vào bình đựng nước vôi trong dư. Khối lượng kết tủa thu được là
Đáp án : B Phương pháp giải :
nO đã dùng = nCO = nCO2 = nCaCO3 Lời giải chi tiết :
Bảo toàn nguyên tố O: nO đã phản ứng = nO trong oxit = nCO = nCO2 = 0,1.2 = 0,2 mol => nCaCO3 = nCO2 = 0,2 mol => mCaCO3 = 100.0,2 = 20 gam
Câu 10 :
Thổi một luồng khí CO dư đi qua ống đựng hỗn hợp 2 oxit Fe3O4 và CuO nung nóng đến khi phản ứng xảy ra hoàn toàn thu được 2,32 gam hỗn hợp kim loại. Khí thoát ra được đưa vào bình đựng dung dịch Ca(OH)2 dư thấy có 5 gam kết tủa trắng. Khối lượng hỗn hợp 2 oxit kim loại ban đầu là:
Đáp án : C Phương pháp giải :
+) nO(trong oxit) = nCO = nCO2 = nCaCO3 +) moxit = mKL + moxi trong oxit Lời giải chi tiết :
Ta có : nO(trong oxit) = nCO = nCO2 = nCaCO3 = 0,05 mol moxit = mKL + moxi trong oxit = 2,32 + 0,05.16 = 3,12 gam
Câu 11 :
Thổi CO dư qua m gam hỗn hợp CuO, Fe2O3, ZnO, PbO nóng đỏ thu được 2,32 gam kim loại. Khí thoát ra cho vào bình nước vôi trong được 5 gam kết tủa, đun tiếp dung dịch lại thấy có thêm 10 gam kết tủa. Giá trị của m là:
Đáp án : A Phương pháp giải :
Ca(OH)2 + CO2 → CaCO3 ↓ + H2O (1) Ca(OH)2 + 2CO2 → Ca(HCO3)2 (2) Ca(HCO3)2 $\xrightarrow{{{t}^{o}}}$ CaCO3 ↓ + CO2 + H2O (3) +) nCaCO3 (3) = nCa(HCO3)2 +) nCO2 = nCaCO3 (1) + 2nCa(HCO3)2 +) m = mO trong oxit + mkim loại Lời giải chi tiết :
Ca(OH)2 + CO2 → CaCO3 ↓ + H2O (1) Ca(OH)2 + 2CO2 → Ca(HCO3)2 (2) Ca(HCO3)2 $\xrightarrow{{{t}^{o}}}$ CaCO3 ↓ + CO2 + H2O (3) nCaCO3 (1) = 0,05 mol nCaCO3 (3) = 0,1 mol => nCa(HCO3)2 = 0,1 mol nCO2 = nCaCO3 (1) + 2nCa(HCO3)2 = 0,05 + 0,1.2 = 0,25 mol m = mO trong oxit + mkim loại = 0,25.16 + 2,32 = 6,32 gam Chú ý
+ tính nhầm nCO2 = nCaCO3 (1) + nCaCO3 (3) => chọn nhầm D
Câu 12 :
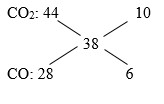
Cho 4,48 lít khí CO (ở đktc) từ từ đi qua ống sứ nung nóng đựng 8 gam một oxit sắt đến khi phản ứng xảy ra hoàn toàn. Khí thu được sau phản ứng có tỉ khối so với hiđro bằng 20. Công thức của oxit sắt và phần trăm thể tích của khí CO2 trong hỗn hợp khí sau phản ứng là:
Đáp án : D Phương pháp giải :
+) Mkhí sau phản ứng = 40 => khí sau phản ứng gồm CO2 (x mol) và CO dư (y mol) +) Bảo toàn C: nCO ban đầu = nCO2 + nCO dư => PT(1) \(\bar M = \frac{{44x + 28y}}{{x + y}} = 40\) => PT(2) +) nO trong oxit = nCO2 +) mFe = moxit – mO trong oxit Lời giải chi tiết :
nCO ban đầu = 0,2 mol Mkhí sau phản ứng = 40 => khí sau phản ứng gồm CO2 (x mol) và CO dư (y mol) Bảo toàn C: nCO ban đầu = nCO2 + nCO dư => x + y = 0,2 (1) \(\bar M = \frac{{44x + 28y}}{{x + y}} = 40\,\,\,(2)\) Từ (1) và (2) => nCO2 = 0,15 mol và nCO dư = 0,05 mol => %CO2 = 75% Ta có: nO trong oxit = nCO2 = 0,15 mol mFe = moxit – mO trong oxit => nFe = (8 – 0,15.16) : 56 = 0,1 mol Gọi công thức của oxit là FexOy => x : y = 0,1 : 0,15 = 2 : 3
Câu 13 :
Dẫn khí CO đi qua 12 gam CuO nung nóng thu được chất rắn X và khí CO2. Hấp thụ hoàn toàn khí CO2 sinh ra bằng 200 ml dung dịch Ba(OH)2 0,9M thì thu được 23,64 gam kết tủa. Cho chất rắn X vào dung dịch AgNO3 dư thu được m gam kết tủa. Tính m:
Đáp án : B Phương pháp giải :
nkết tủa < nBa(OH)2 => có 2 trường hợp Trường hợp 1: CO2 hết, Ba(OH)2 dư +) nCO2 = nkết tủa +) nCu = nO tách ra = nCO2 +) mchất rắn = mAg + mCuO dư Trường hợp 2: Kết tủa bị hòa tan 1 phần So sánh nCO2 = 2nBa(OH)2 – n kết tủa với nO trong oxit Lời giải chi tiết :
nCuO = 0,15mol; nBa(OH)2 = 0,18 mol nkết tủa = 0,12 mol < nBa(OH)2 => có 2 trường hợp Trường hợp 1: CO2 hết, Ba(OH)2 dư nCO2 = nkết tủa = 0,12 mol => nCu = nO tách ra = nCO2 = 0,12 mol => mchất rắn = mAg + mCuO dư = 0,24.108 + 0,03.80 = 28,32 gam Trường hợp 2: Kết tủa bị hòa tan 1 phần nCO2 = 2nBa(OH)2 – n kết tủa = 2 . 0,18 – 0,15 = 0,21 > nO trong oxit (loại)
Câu 14 :
Hỗn hợp A gồm 0,56 gam Fe và 16 gam Fe2O3 và x (mol) Al rồi nung ở nhiệt độ cao không có không khí (giả sử chỉ xảy ra sự khử Fe2O3 thành Fe), sau khi kết thúc phản ứng được hỗn hợp D. Nếu cho D tan trong H2SO4 loãng được V lít khí nhưng nếu cho D tác dụng với NaOH dư thì thu được 0,25V lít khí. Giá trị của x là
Đáp án : B Phương pháp giải :
+) D + NaOH tạo khí H2 => Al dư, Fe2O3 phản ứng hết +) nAl pứ = 2.nFe2O3 => nAl dư +) Bảo toàn Fe: nFe sau phản ứng = nFe ban đầu + 2.nFe2O3 +) nH2 = nFe +) nH2 (3) = 1,5.nAl dư => ∑nH2 = PT(*) 2Al + 2NaOH + 6H2O → 2NaAl(OH)4 + 3H2 +) nH2 (0,25V) = PT(**) Lời giải chi tiết :
nFe = 0,01 mol, nFe2O3 = 0,1 mol, nAl = x mol 2Al + Fe2O3 $\xrightarrow{{{t}^{o}}}$ Al2O3 + 2Fe Vì D + NaOH tạo khí H2 => Al dư, Fe2O3 phản ứng hết nAl pứ = 2.nFe2O3 = 0,2 mol => nAl dư = x – 0,2 mol Bảo toàn Fe: nFe sau phản ứng = nFe ban đầu + 2.nFe2O3 = 0,01 + 0,2 = 0,21 mol => hỗn hợp D chứa Fe (0,21 mol) và Al dư (x – 0,2) mol - D + H2SO4: Fe + H2SO4 (l) → FeSO4 + H2 nH2 = nFe = 0,21 mol 2Al + 3H2SO4 → Al2(SO4)3 + 3H2 nH2 (3) = 1,5.nAl dư = 1,5.(x – 0,2) mol => ∑nH2 (V) = 0,21 + 1,5.(x – 0,2) (*) - D + NaOH: 2Al + 2NaOH + 6H2O → 2NaAl(OH)4 + 3H2 nH2 (0,25V) = 1,5.nAl dư = 1,5.(x – 0,2) (**) Từ (*) và (**) => V – 0,25V = 0,21.22,4 => V = 6,272 lít => 0,21 + 1,5.(x – 0,2) = 0,28 => x = 0,247
Câu 15 :
Cho khí CO dư đi qua hỗn hợp gồm CuO, Al2O3, MgO(nung nóng). Sau khi phản ứng xảy ra hoàn toàn chất rắn thu được gồm
Đáp án : B Phương pháp giải :
Viết PTHH biết CO chỉ khử được những oxit kim loại từ Zn trở đi Lời giải chi tiết :
Cho khí CO dư đi qua hỗn hợp gồm CuO, Al2O3, MgO(nung nóng)→ chất rắn thu được gồm Cu, Al2O3, MgO Vì CuO + CO \(\xrightarrow{{{t^o}}}\) Cu + CO2
Câu 16 :
Thổi từ từ V lít CO (đktc) đi qua ống sứ đựng 51,6 gam hỗn hợp X gồm CuO, Al2O3 và Fe3O4 (tỉ lệ mol lần lượt là 1:2:1). Các phản ứng xảy ra hoàn toàn, kết thúc phản ứng thu được hỗn hợp khí Y có tỉ khối so với H2 bằng 19. Cho toàn bộ lượng khí Y hấp thụ vào dung dịch Ca(OH)2 thu được 30 gam kết tủa và dung dịch Z. Cho dung dịch Z phản ứng với lượng dư dung dịch Ba(OH)2 dư thấy tạo thành m gam kết tủa. Giá trị của V và m lần lượt là:
Đáp án : A Phương pháp giải :
Đặt nCuO = nFe3O4 = x (mol) ; nAl2O3 = 2x (mol) Từ khối lượng của hh X => x = ? nCO2 = nO(oxit bị lấy đi) = nCuO + 4nFe3O4 = ? Dùng quy tắc đường chéo tính được số mol của CO và CO2 trong hh khí Y BTNT "C": nCO ban đầu = nCO2 + nCO dư = ? => VCO(đktc) = ? Vì dd Z thu được sau phản ứng có phản ứng với Ba(OH)2 tạo kết tủa nên CO2 phản ứng với Ca(OH)2 tạo 2 muối CaCO3 và Ca(HCO3)2 BTNT "C": nCO2 = nCaCO3 + 2nCa(HCO3)2 => nCa(HCO3)2 = ? (mol) Ca(HCO3)2 + Ba(OH)2 dư → CaCO3↓ + BaCO3↓ + 2H2O => m↓ = mCaCO3 + mBaCO3 = ? Lời giải chi tiết :
Đặt nCuO = nFe3O4 = x (mol) ; nAl2O3 = 2x (mol) => 80x + 102.2x + 232.x = 51,6 => x = 0,1 (mol) => nCuO = nFe3O4 = 0,1 (mol) ; nAl2O3 = 0,2 (mol) \(V(l)CO + \left\{ \matrix{ nCO2 = nO(oxit bị lấy đi) = nCuO + 4nFe3O4 = 0,1 + 4.0,1 = 0,5 (mol) Hỗn hợp Y là 2 khí CO2 và CO dư có M= 19.2 = 38
Ta có: \({{{n_{C{O_2}}}} \over {{n_{CO}}}} = {{10} \over 6} = {5 \over 3} \Rightarrow {{0,5} \over {{n_{CO}}}} = {5 \over 3} \Rightarrow {n_{CO}} = 0,3\,(mol)\) BTNT "C": nCO ban đầu = nCO2 + nCO dư = 0,5 + 0,3 = 0,8 (mol) => VCO(đktc) = 0,8.22,4= 17,92 (l) Hấp thụ hỗn hợp CO2 và CO vào dd Ca(OH)2 chỉ có CO2 tham gia phản ứng Vì dd Z thu được sau phản ứng có phản ứng với Ba(OH)2 tạo kết tủa nên CO2 phản ứng với Ca(OH)2 tạo 2 muối CaCO3 và Ca(HCO3)2 BTNT "C": nCO2 = nCaCO3 + 2nCa(HCO3)2 => 0,5 = 0,3 + 2nCa(HCO3)2 => nCa(HCO3)2 = 0,1 (mol) Ca(HCO3)2 + Ba(OH)2 dư → CaCO3↓ + BaCO3↓ + 2H2O 0,1 → 0,1 0,1 (mol) => m↓ = mCaCO3 + mBaCO3 = 0,1.100 + 0,1.197 = 29,7 (g)
Câu 17 :
Khí CO không khử được chất nào sau đây ở nhiệt độ cao:
Đáp án : A Phương pháp giải :
CO chỉ khử được những oxit của KL đứng sau Al trong dãy hoạt động hóa học: K, Na, Ba, Ca, Mg, Al, Zn, Fe, Ni, Sn, Pb, H, Cu, Hg, Ag, Pt, Au Lời giải chi tiết :
- CO chỉ khử được những oxit của KL đứng sau Al trong dãy hoạt động hóa học. - CaO là oxit của kim loại đứng trước Al. => CO không khử được CaO.
Câu 18 :
Khử hoàn toàn 14g hỗn hợp X gồm CuO và một oxit sắt bằng CO thu được 10,32g hỗn hợp Y gồm 2 kim loại. Thể tích CO (đktc) đã dùng cho quá trình trên là:
Đáp án : C Phương pháp giải :
Oxit + CO → KL + CO2 Đặt nCO = nCO2 = x mol BTKL: m oxit + mCO = mKL + mCO2 => x = ? => VCO Lời giải chi tiết :
Oxit + CO → KL + CO2 Đặt nCO = nCO2 = x mol BTKL: m oxit + mCO = mKL + mCO2 => 14 + 28x = 10,32 + 44x => x = 0,23 mol => VCO = 0,23.22,4 = 5,152 lít
Câu 19 :
Cho từ từ khí CO đi qua ống đựng 3,2 gam CuO nung nóng. Khí thoát ra khỏi ống được hấp thụ hoàn toàn vào nước vôi trong dư tạo thành 1 gam kết tủa. Chất rắn còn lại trong ống sứ cho vào cốc đựng 500 ml dung dịch HNO3 0,16M thu được V1 lít khí NO và còn một phần kim loại chưa tan. Thêm tiếp vào cốc 760 ml dung dịch HCl 2/3 M, sau khi phản ứng xong thu thêm V2 lít khí NO. Biết NO là sản phẩm khử duy nhất của N+5, các phản ứng xảy ra hoàn toàn. V2 gần nhất với giá trị nào sau đây
Đáp án : A Phương pháp giải :
nCuO bđ = 3,2:80 = 0,04 mol - Pư 1: Tính số mol CuO dư 0,03 mol và Cu sinh ra 0,01 mol - Pư 2: Từ số mol HNO3 => số mol Cu dư - Pư 3: Tính V của NO khi thêm HCl Lời giải chi tiết :
*Phản ứng CuO +CO: nCuO bđ = 3,2:80 = 0,04 mol nCO2 = nCaCO3 = 1:100 = 0,01 mol CuO + CO \(\xrightarrow{{{t}^{o}}}\) Cu + CO2 0,01 ← 0,01 ← 0,01 mol => CuO dư 0,03 mol Chất rắn sau phản ứng gồm: Cu (0,01 mol) và CuO dư (0,03 mol) *Phản ứng chất rắn + HNO3: CuO + 2HNO3 → Cu(NO3)2 + H2O 0,03→ 0,06 => Số mol HNO3 dư 0,02 mol 3Cu + 8HNO3 → 3Cu(NO3)2 + 2NO + 4H2O 0,0075 ←0,02 Phần kim loại chưa tan là Cu (0,0025 mol) *Phản ứng hòa tan kim loại chưa tan: 3Cu + 8H+ + NO3- → 3Cu2+ + 2NO + 4H2O 0,0025 → 1/600 mol => V2 = 1/600.22,4 = 0,037 lít
Câu 20 :
Cho khí CO qua ống sứ chứa 10 gam hỗn hợp chất rắn X gồm CuO; Fe2O3; FeO; Fe3O4 và MgO nung nóng. Sau một thời gian thu được hỗn hợp khí Y và 8 gam rắn Z. Cho Y qua dung dịch nước vôi trong dư thu được m gam kết tủa. Giá trị m là
Đáp án : B Phương pháp giải :
m rắn giảm = mO pư => nO CO + [O] → CO2 => nCaCO3 = nCO2 = nO pư => mCaCO3 Lời giải chi tiết :
m rắn giảm = mO pư = 2 gam => nO = 0,125 mol CO + [O] → CO2 0,125 → 0,125 (mol) => nCaCO3 = nCO2 = 0,125 mol => mCaCO3 = 12,5 gam
Câu 21 :
Cho hơi nước đi qua than nóng đỏ, thu được hỗn hợp khí X gồm CO, CO2 và H2. Cho toàn bộ X qua bình đựng dung dịch nước vôi dư thu được 10 gam kết tủa. Khí không bị hấp thụ thoát ra được dẫn qua ống đựng CuO (dư) nung nóng thu được hỗn hợp chất rắn Y. Hòa tan toàn bộ Y bằng dung dịch HNO3 (loãng, dư) thu được 8,96 lít khí NO (sản phẩm khử duy nhất). Biết các phản ứng xảy ra hoàn toàn. Phần trăm thể tích khí CO trong X là
Đáp án : B Phương pháp giải :
Cách 1: Tính theo PTHH Cho hơi nước đi qua than nóng đỏ: C + H2O → CO + H2 C + 2H2O → CO2 + 2H2 Hỗn hợp X chứa: CO; CO2 và H2 CO2 + Ca(OH)2 dư → CaCO3 ↓ + H2O CO + CuO dư → Cu + CO2 (đun nóng) H2 + CuO dư → Cu + H2O (đun nóng) 3Cu + 8HNO3 → 3Cu(NO3)2 + 2NO + 4H2O Cách 2: Sử dụng bảo toàn electron nCO2 = nCaCO3 Hỗn hợp X chứa: CO (x mol); H2 (y mol) và CO2 (0,1 mol) - Bảo toàn e cho phản ứng của C với H2O → 2nH2 = 2nCO + 4nCO2 → (1) - Trong pư khử CuO bằng CO, H2: nCu = nCO + nH2 = x + y (mol) - Bảo toàn e cho pư của Cu với HNO3 → 2nCu = 3nNO → (2) Lời giải chi tiết :
Cách 1: Tính theo PTHH Cho hơi nước đi qua than nóng đỏ: C + H2O → CO + H2 a → a C + 2H2O → CO2 + 2H2 b → 2b Hỗn hợp X chứa: CO (a mol); CO2 (b mol) và H2 (a + 2b mol) CO2 + Ca(OH)2 dư → CaCO3 ↓ + H2O b → b = 0,1 mol CO + CuO dư → Cu + CO2 (đun nóng) a → a H2 + CuO dư → Cu + H2O (đun nóng) (a+2b) → (a+2b) 3Cu + 8HNO3 → 3Cu(NO3)2 + 2NO + 4H2O (2a+2b) → 2/3.(2a+2b) Vậy ta có: \(\left\{ \begin{array}{l}b = 0,1\\{n_{NO}} = \frac{2}{3}\left( {2{\rm{a}} + 2b} \right) = 0,4\end{array} \right. \to \left\{ \begin{array}{l}a = 0,2\\b = 0,1\end{array} \right.\) Hỗn hợp X chứa: CO (0,2 mol); CO2 (0,1 mol) và H2 (0,4 mol) ⟹ %VCO = 28,57% Cách 2: Sử dụng bảo toàn electron nCO2 = nCaCO3 = 0,1 mol Hỗn hợp X chứa: CO (x mol); H2 (y mol) và CO2 (0,1 mol) - Bảo toàn e cho phản ứng của C với H2O → 2nH2 = 2nCO + 4nCO2 → 2y = 2x + 0,4 (1) - Trong pư khử CuO bằng CO, H2: nCu = nCO + nH2 = x + y (mol) - Bảo toàn e cho pư của Cu với HNO3 → 2nCu = 3nNO → 2(x + y) = 3.0,4 (2) Giải hệ trên được x = 0,2 và y = 0,4 Hỗn hợp X chứa: CO (0,2 mol); H2 (0,4 mol); CO2 (0,1 mol) ⟹ %VCO = 28,57%
Câu 22 :
Dẫn 0,55 mol hỗn hợp X (gồm hơi nước và khí CO2) qua cacbon nung đỏ thu được 0,95 mol hỗn hợp Y gồm CO, H2 và CO2. Cho Y hấp thụ vào dung dịch chứa 0,1 mol Ba(OH)2 sau khi phản ứng xảy ra hoàn toàn, thu được m gam kết tủa. Giá trị của m là
Đáp án : A Phương pháp giải :
Tính được nC = nY - nX Oxi hóa hoàn toàn hỗn hợp Y thì:
Áp dụng bảo toàn e cho toàn bộ quá trình sẽ tính được số mol O (cần dùng để oxi hóa hết Y) Mà nO = ∑nCO(Y), H2(Y) ⟹ số mol CO2 trong Y Sau đó giải tương tự như bài toán hấp thụ CO2 vào dung dịch kiềm Lời giải chi tiết :
Ta thấy nC = nY - nX = 0,95 - 0,55 = 0,4 mol Oxi hóa hoàn toàn hỗn hợp Y thì:
Áp dụng bảo toàn e cho toàn bộ quá trình thì: 4nC = 2nO → nO = 0,8 mol Mà nO = ∑nCO(Y), H2(Y) = 0,8 mol ⟹ nCO2(Y) = 0,95 - 0,8 = 0,15 mol Khi cho Y phản ứng với Ba(OH)2 tức là 0,15 mol CO2 phản ứng với 0,1 mol Ba(OH)2: Tỉ lệ: 1 < nOH-/nCO2 = 0,2/0,15 = 1,33 < 2 → tạo CO32- (a) và HCO3- (b) Giải hệ: \(\left\{ \begin{array}{l}{n_{C{O_2}}} = a + b = 0,15\\{n_{O{H^ - }}} = 2{\rm{a}} + b = 0,2\end{array} \right. \to \left\{ \begin{array}{l}a = 0,05\\b = 0,1\end{array} \right.\) Ba2+ + CO32- → BaCO3 0,05 ← 0,05 → 0,05 → m ↓ = 0,05.197 = 9,85 gam
Câu 23 :
Khử hoàn tàn 4,8 gam Fe2O3 bằng CO dư ở nhiệt độ cao. Khối lượng Fe thu được sau phản ứng là
Đáp án : A Phương pháp giải :
Bảo toàn nguyên tố Fe Lời giải chi tiết :
nFe2O3 = 0,03 mol Bảo toàn Fe ta có: nFe = 2nFe2O3 = 0,06 mol → m = 0,06.56 = 3,36 gam
Câu 24 :
Hỗn hợp X gồm FeO, Fe2O3 và Fe3O4.Cho khí CO qua m gam X nung nóng, sau một thời gian thu được hỗn hợp chất rắn Y và hỗn hợp khí Z. Cho toàn bộ Z vào dung dịch Ca(OH)2 dư, đến khi phản ứng hoàn toàn, thu được 4 gam kết tủa. Mặt khác, hòa tan hoàn toàn Y trong dung dịch H2SO4 đặc nóng dư thu được 1,008 lít khí SO2 (đktc, sản phẩm khử duy nhất) và dung dịch chứa 18 gam muối. Giá trị của m là:
Đáp án : A Phương pháp giải :
Quy hỗn hợp X chứa hai chất: FeO và Fe2O3 Cho X + khí CO → Chất rắn Y + khí Z chứa CO, CO2 CO2 + Ca(OH)2 → CaCO3 + H2O Áp dụng định luật bảo toàn electron cho phản ứng với CO và phản ứng với H2SO4 đặc để tìm số mol FeO. Dùng bảo toàn nguyên tố Fe để tìm số mol Fe2O3. Từ đó xác định được giá trị của m. Lời giải chi tiết :
Quy hỗn hợp X chứa hai chất: FeO x mol và Fe2O3 y mol Cho X + khí CO → Chất rắn Y + khí Z chứa CO, CO2 CO2 + Ca(OH)2 dư → CaCO3 + H2O Ta có: nCO2 = nCaCO3 = 0,04 mol Cho Y + H2SO4 đặc nóng dư thu được nSO2 = 0,045 mol - QT cho e: FeO → Fe+3 + 1e x → x mol C +2 → C+4 + 2e 0,04 0,08 mol - QT nhận e: S +6 + 2e → SO2 0,09 ← 0,045 mol Theo định luật bảo toàn electron: ne cho = ne nhận → x + 0,08 = 0,09 → x = 0,01 mol Muối thu được sau phản ứng là Fe2(SO4)3 → nFe2(SO4)3 = 18/400 = 0,045 mol Bảo toàn nguyên tố Fe ta có: nFeO + 2nFe2O3 = 2nFe2(SO4)3 => x + 2y = 0,045.2 → y = 0,04 mol → m = mFeO + mFe2O3 = 72x + 160y = 72.0,01 + 160.0,04 = 7,12 gam
Câu 25 :
Dẫn 0,55 mol hỗn hợp X (gồm hơi nước và khí CO2) qua cacbon nung đỏ, thu được 0,95 mol hỗn hợp Y gồm CO, H2 và CO2. Cho Y hấp thụ vào dung dịch chứa 0,1 mol Ba(OH)2, sau khi phản ứng xảy ra hoàn toàn, thu được m gam kết tủa. Giá trị của m là
Đáp án : D Phương pháp giải :
Từ PTHH => n C phản ứng = nY -nX Áp dụng định luật bảo toàn e => n CO2 Từ n CO2,n Ba(OH)2 => Thành phần muối thu được sau phản ứng => Tính được thành phần muối BaCO3 => m Lời giải chi tiết :
Ta có PTHH: C + H2O → CO + H2 (1) C + 2H2O → CO2 + 2H2(2) Từ (1) và (2) => n C phản ứng = nY - nX = 0,4 (mol) Áp dụng định luật bảo toàn electron => 4 * nC = 2* nH2 + 2 * nCO => nH2 + nCO = 0,8 (mol) Mà nY = 0,95 mol => nCO2 (trong Y) = 0,95 - 0,8 = 0,15 (mol) Ta có n Ba(OH)2 = 0,1 => T = nOH/nCO2 = 0,2 : 0,15 = 1,3333 => Sau phản ứng sinh ra 2 muối là Ba(HCO3)2 và BaCO3 Gọi số mol Ba(HCO3)2 và BaCO3 là x, y (mol) Áp dụng định luật bảo toàn Ba => x + y = 0,1 (I) Áp dụng định luật bảo toàn C => 2x + y = 0,15 (II) => x = 0,05; y = 0,05 => n BaCO3 = 0,05 (mol) => m BaCO3 = 9,85 gam
Câu 26 :
Dẫn a mol hỗn hợp X (gồm hơi nước và khí CO2) qua cacbon nung đỏ, thu được 1,8a mol hỗn hợp khí Y gồm CO, H2 và CO2. Cho Y đi qua ống đựng hỗn hợp gồm CuO và Fe2O3 (dư, nung nóng), sau khi các phản ứng xảy ra hoàn toàn, khối lượng chất rắn giảm 1,28 gam. Giá trị của a là
Đáp án : B Lời giải chi tiết :
\(a(mol)X\left\{ \begin{array}{l}{H_2}O\\C{O_2}\end{array} \right. + C \to 1,8a(mol)Y\left\{ \begin{array}{l}CO\\{H_2}\\C{O_2}\end{array} \right. + {\rm{\{ }}CuO,F{e_2}{O_3}{\rm{\} du}} \to {{\rm{m}}_{{\rm{ran}}\,giam}} = 1,28(g)\) Nhận thấy, C là nguyên nhân làm cho số mol hỗn hợp khí tăng lên => nC = 1,8a - a = 0,8a mol Sau khi cho Y tác dụng với Fe2O3, CuO dư tạo thành H2O, CO2 nên ta có thể coi hỗn hợp Y gồm {H2O, CO2, C} như vậy ta thấy chỉ có C có phản ứng: C + 2O → CO2 => nO(pư) = 2nC = 2.0,8a = 1,6a mol m chất rắn giảm = mO pư => nO pư = 1,6a = 1,28/16 => a = 0,05
Câu 27 :
Dẫn luồng khí CO dư qua hỗn hợp CuO, Al2O3, CaO, MgO có số mol bằng nhau (nung nóng ở nhiệt độ cao) thu được chất rắn A. Hòa tan A vào nước dư còn lại chất rắn X. X gồm:
Đáp án : D Phương pháp giải :
CO chỉ khử được các oxi kim loại từ Al trở về sau trong dãy điện hóa Các oxit bazo của kim loại kiềm, kiềm thổ (trừ Be, Mg) tan được trong nước Lời giải chi tiết :
\(CO\,du + \left\{ \matrix{ CO + Cu \(\buildrel {{t^0}} \over\longrightarrow \)Cu + H2O CaO + H2O → Ca(OH)2 Ca(OH)2 + Al2O3 → Ca(AlO2)2 + H2O Vì các chất ban đầu có cùng số mol nên Al2O3 phản ứng hết với dd Ca(OH)2. Do vậy chất rắn sau phản ứng chỉ có Cu và MgO Chú ý
Al2O3 không tan được trong nước nhưng tan được trong dd bazo
Câu 28 :
Cho một luồng khí CO đi qua ống đựng 10g Fe2O3 nung nóng.Sau một thời gian thu được m gam hổn hợp X gồm 3 oxit sắt. Cho X tác dụng hết với dd HNO3 0,5M (vừa đủ) thu được dd Y và 1,12 lít NO (đktc) duy nhất. Thể tích CO đã dùng (đktc) và giá trị của m là
Đáp án : A Phương pháp giải :
Phương pháp: Trong cả quá trình chỉ có C và N thay đổi số oxi hóa ĐL bảo toàn e: ne cho = ne nhận => VCO mchất rắn = m = moxit - mO Lời giải chi tiết :
Trong cả quá trình chỉ có C và N thay đổi số oxi hóa x 2x 0,15 0,05 ĐL bảo toàn e: ne cho = ne nhận => 2x=0,15 => x=0,075 => VCO = 0,075.22,4=1,68 lít mchất rắn = m = moxit - mO = 10- 0,075.16 = 8,8 gam
|














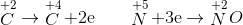





Danh sách bình luận