Trắc nghiệm Bài 35. Benzen và ankyl benzen - Hóa 11Đề bài
Câu 1 :
Trong phân tử benzen, các nguyên tử C đều ở trạng thái lai hoá :
Câu 2 :
Trong phân tử benzen có:
Câu 3 :
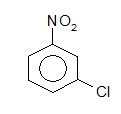
Cho các công thức : 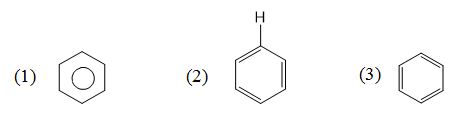 Công thức cấu tạo nào là của benzen ?
Câu 4 :
Ankylbenzen là hiđrocacbon có chứa
Câu 5 :
Dãy đồng đẳng của benzen (gồm benzen và ankylbenzen) có công thức chung là:
Câu 6 :
Trong các câu sau, câu nào sai ?
Câu 7 :
Câu nào đúng nhất trong các câu sau đây ?
Câu 8 :
Chất nào sau đây không thể chứa vòng benzen ?
Câu 9 :
Một bạn học sinh đã viết 5 công thức cấu tạo : 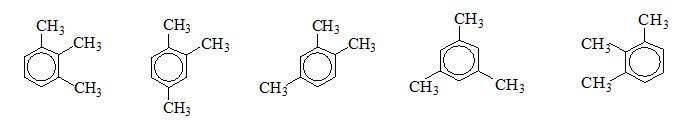 Bạn đó đã viết được bao nhiêu đồng phân
Câu 10 :
Cho các chất : (1) C6H5–CH3 (2) p-CH3–C6H4–C2H5 (3) C6H5–C2H3 (4) o-CH3–C6H4–CH3 Dãy gồm các chất là đồng đẳng của benzen là :
Câu 11 :
Ứng với công thức phân tử C8H10 có bao nhiêu cấu tạo chứa vòng benzen ?
Câu 12 :
Chất (CH3)2CH–C6H5 có tên gọi là :
Câu 13 :
Cho hiđrocacbon thơm : 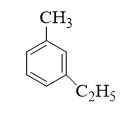 Tên gọi của hiđrocacbon trên là :
Câu 14 :
Gốc C6H5–CH2– và gốc C6H5– có tên gọi là :
Câu 15 :
Hoạt tính sinh học của benzen, toluen là :
Câu 16 :
Phản ứng nào sau đây không xảy ra ?
Câu 17 :
Khi trên vòng benzen có sẵn nhóm thế –X, thì nhóm thứ hai sẽ ưu tiên thế vào vị trí m - . Vậy –X là những nhóm thế nào ?
Câu 18 :
Cho sơ đồ: $Axetilen\,\,\,\xrightarrow{{C,\,{{600}^0}C}}\,\,X\,\,\,\xrightarrow{{HN{O_3}\,đặc/\,{H_2}S{O_4}\,đặc}}\,\,\,Y\,\,\xrightarrow{{C{l_2},\,Fe,\,{t^o}}}\,\,Z$ CTCT phù hợp của Z là:
Câu 19 :
Toluen + Cl2 (as) xảy ra phản ứng :
Câu 20 :
Sản phẩm chính khi oxi hóa các ankylbenzen bằng KMnO4 /H+ là :
Câu 21 :
Ứng dụng nào benzen không có :
Câu 22 :
Lượng clobenzen thu được khi cho 15,6 gam C6H6 tác dụng hết với Cl2 (xúc tác bột Fe) với hiệu suất phản ứng đạt 80% là :
Câu 23 :
Hỗn hợp gồm 1 mol C6H6 và 1,5 mol Cl2. Trong điều kiện có xúc tác bột Fe, to, hiệu suất 100%. Sau phản ứng thu được chất gì ? bao nhiêu mol ?
Câu 24 :
Một hợp chất hữu cơ X có vòng benzen có CTĐGN là C3H2Br và M = 236. Gọi tên hợp chất này biết rằng hợp chất này là sản phẩm chính trong phản ứng giữa C6H6 và Br2 (xúc tác Fe).
Câu 25 :
TNT (2,4,6- trinitrotoluen) được điều chế bằng phản ứng của toluen với hỗn hợp gồm HNO3 đặc và H2SO4 đặc, trong điều kiện đun nóng. Biết hiệu suất của toàn bộ quá trình tổng hợp là 80%. Lượng TNT (2,4,6- trinitrotoluen) tạo thành từ 230 gam toluen là
Câu 26 :
Để oxi hoá hết 10,6 gam o-xilen (1,2-đimetylbenzen) cần bao nhiêu lít dung dịch KMnO4 0,5M trong môi trường H2SO4 loãng. Giả sử dùng dư 20% so với lượng phản ứng.
Câu 27 :
Đốt cháy hoàn toàn một thể tích hơi hợp chất hữu cơ A cần 10 thể tích oxi (đo cùng điều kiện nhiệt độ và áp suất), sản phẩm thu được chỉ gồm CO2 và H2O với tỉ lệ khối lượng là 44 : 9. Biết MA < 150. A có công thức phân tử là :
Câu 28 :
Đốt cháy hết 9,18 gam 2 đồng đẳng của benzen A, B thu được 8,1 gam H2O và V lít CO2 (đktc). Giá trị của V là :
Câu 29 :
A, B, C là ba chất hữu cơ có %C, %H (theo khối lượng) lần lượt là 92,3% và 7,7%, tỉ lệ khối lượng mol tương ứng là 1: 2 : 3. Từ A có thể điều chế B hoặc C bằng một phản ứng. C không làm mất màu nước brom. Đốt 0,1 mol B rồi dẫn toàn bộ sản phẩm cháy qua bình đựng dung dịch nước vôi trong dư. Khối lượng dung dịch tăng hoặc giảm bao nhiêu gam ?
Câu 30 :
Đốt cháy hoàn toàn 0,1 mol hỗn hợp gồm X gồm C6H14 và CxHx (CxHx có vòng benzen) thu được 15,68 lít khí CO2 (đktc) và 9,9 gam nước. Nếu cho hỗn hợp trên vào dung dịch Br2 dư thì CxHx tác dụng hoàn toàn với m gam Br2 . Giá trị của m là
Câu 31 :
Tiến hành thí nghiệm theo các bước sau: Bước 1: Cho vào ống nghiệm khô khoảng 5 ml benzen và 2 ml brom nguyên chất, lắc nhẹ ống nghiệm. Bước 2: Để yên ống nghiệm trong 3 phút. Bước 3: Cho tiếp một ít bột sắt vào ống nghiệm trên rồi lắc nhẹ liên tục trong 3 phút. (Trong quá trình làm thí nghiệm, tránh ánh sáng chiếu trực tiếp vào chất lỏng trong ống nghiệm bằng cách bọc bên ngoài ống nghiệm một tờ giấy tối màu.) Cho các phát biểu sau: (1) Sau bước 1, có sự phân tách chất lỏng trong ống nghiệm thành hai lớp. (2) Ở bước 2, trong suốt quá trình màu của dung dịch trong ống nghiệm không thay đổi. (3) Ở bước 3, màu của dung dịch nhạt dần. (4) Ở bước 3, thêm bột sắt là để làm xúc tác cho phản ứng giữa benzen và brom xảy ra. (5) Sản phẩm hữu cơ chủ yếu thu được sau bước 3 là 1,2,3,4,5,6-hexabromxiclohexan). Số phát biểu đúng là
Lời giải và đáp án
Câu 1 :
Trong phân tử benzen, các nguyên tử C đều ở trạng thái lai hoá :
Đáp án : B Phương pháp giải :
Xem lại lí thuyết benzen và ankylbenzen Lời giải chi tiết :
Trong phân tử benzen, các nguyên tử C đều ở trạng thái lai hoá : sp2
Câu 2 :
Trong phân tử benzen có:
Đáp án : A Lời giải chi tiết :
Trong phân tử benzen có: 6 nguyên tử H và 6 nguyên tử C đều nằm trên 1 mặt phẳng
Câu 3 :
Cho các công thức :  Công thức cấu tạo nào là của benzen ?
Đáp án : D Lời giải chi tiết :
Các cấu tạo của benzen là (1) ; (2) và (3).
Câu 4 :
Ankylbenzen là hiđrocacbon có chứa
Đáp án : D Lời giải chi tiết :
Ankylbenzen là hiđrocacbon có chứa gốc ankyl và một vòng benzen.
Câu 5 :
Dãy đồng đẳng của benzen (gồm benzen và ankylbenzen) có công thức chung là:
Đáp án : D Lời giải chi tiết :
Dãy đồng đẳng của benzen (gồm benzen và ankylbenzen) có công thức chung là : CnH2n-6 (n ≥ 6).
Câu 6 :
Trong các câu sau, câu nào sai ?
Đáp án : B Lời giải chi tiết :
Câu sai là: Chất có CTPT C6H6 phải là benzen vì C6H6 có thể là mạch thẳng không no
Câu 7 :
Câu nào đúng nhất trong các câu sau đây ?
Đáp án : D Lời giải chi tiết :
A sai vì benzen có mạch vòng B sai vì benzen không no C sai vì benzen chỉ chứa C và H => là hiđrocacbon D đúng. Benzen là một hiđrocacbon thơm.
Câu 8 :
Chất nào sau đây không thể chứa vòng benzen ?
Đáp án : B Lời giải chi tiết :
Chất không thể chứa vòng benzen là C6H8 vì độ bất bão hòa k = (2.6 + 2 – 8) / 2 = 3 < 4
Câu 9 :
Một bạn học sinh đã viết 5 công thức cấu tạo :  Bạn đó đã viết được bao nhiêu đồng phân
Đáp án : C Lời giải chi tiết :
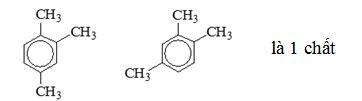 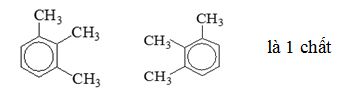 => có tất cả 3 chất
Câu 10 :
Cho các chất : (1) C6H5–CH3 (2) p-CH3–C6H4–C2H5 (3) C6H5–C2H3 (4) o-CH3–C6H4–CH3 Dãy gồm các chất là đồng đẳng của benzen là :
Đáp án : D Lời giải chi tiết :
Dãy gồm các chất là đồng đẳng của benzen là : D. (1) ; (2) và (4). (3) không phải vì nhánh –C2H3 không no
Câu 11 :
Ứng với công thức phân tử C8H10 có bao nhiêu cấu tạo chứa vòng benzen ?
Đáp án : C Lời giải chi tiết :
Độ bất bão hòa k = (2.8 + 2 – 10) / 2 = 4 => C8H10 chứa 1 vòng và mạch nhánh no CTCT của C8H10 là
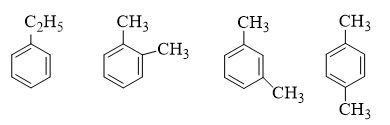
Câu 12 :
Chất (CH3)2CH–C6H5 có tên gọi là :
Đáp án : C Lời giải chi tiết :
(CH3)2CH–C6H5 có tên gọi là : iso-propylbenzen.
Câu 13 :
Cho hiđrocacbon thơm :  Tên gọi của hiđrocacbon trên là :
Đáp án : D Lời giải chi tiết :
Chất có tên thường là: m-etyltoluen. Tên hệ thống: + nếu chọn –CH3 làm gốc: 3-etyl-1-metylbenzen. + nếu chọn –C2H5 làm gốc: 1-etyl-3-metylbenzen.
Câu 14 :
Gốc C6H5–CH2– và gốc C6H5– có tên gọi là :
Đáp án : D Lời giải chi tiết :
Gốc C6H5–CH2– và gốc C6H5– có tên gọi là : benzyl và phenyl.
Câu 15 :
Hoạt tính sinh học của benzen, toluen là :
Đáp án : A Phương pháp giải :
Xem lại lí thuyết benzen và ankylbenzen Lời giải chi tiết :
Hoạt tính sinh học của benzen, toluen là : Gây hại cho sức khỏe.
Câu 16 :
Phản ứng nào sau đây không xảy ra ?
Đáp án : C Lời giải chi tiết :
Benzen chỉ phản ứng với Br2 khan và xúc tác Fe; không phản ứng với Br2 trong dung dịch.
Câu 17 :
Khi trên vòng benzen có sẵn nhóm thế –X, thì nhóm thứ hai sẽ ưu tiên thế vào vị trí m - . Vậy –X là những nhóm thế nào ?
Đáp án : D Lời giải chi tiết :
- Nếu ở vòng benzen đã có sẵn nhóm –NO2 (hoặc các nhóm –COOH, –SO3H, –CHO …) phản ứng thế vào vòng sẽ khó hơn và ưu tiên xảy ra ở vị trí meta.
Câu 18 :
Cho sơ đồ: $Axetilen\,\,\,\xrightarrow{{C,\,{{600}^0}C}}\,\,X\,\,\,\xrightarrow{{HN{O_3}\,đặc/\,{H_2}S{O_4}\,đặc}}\,\,\,Y\,\,\xrightarrow{{C{l_2},\,Fe,\,{t^o}}}\,\,Z$ CTCT phù hợp của Z là:
Đáp án : C Phương pháp giải :
Nếu ở vòng benzen đã có sẵn nhóm –NO2 (hoặc các nhóm –COOH, –SO3H, –CHO …) phản ứng thế vào vòng sẽ khó hơn và ưu tiên xảy ra ở vị trí meta. Lời giải chi tiết :
Do NO2 hút e mạnh lên sẽ định hướng thế vào vị trí meta => Z là m-Cl-C6H4-NO2
Câu 19 :
Toluen + Cl2 (as) xảy ra phản ứng :
Đáp án : C Lời giải chi tiết :
Toluen + Cl2 (as) xảy ra phản ứng thế ở nhánh, khó khăn hơn CH4 do tác động của vòng benzen
Câu 20 :
Sản phẩm chính khi oxi hóa các ankylbenzen bằng KMnO4 /H+ là :
Đáp án : A Lời giải chi tiết :
Sản phẩm chính khi oxi hóa các ankylbenzen bằng KMnO4 /H+ là : C6H5COOH.
Câu 21 :
Ứng dụng nào benzen không có :
Đáp án : D Lời giải chi tiết :
Ứng dụng không phải của benzen là : dùng trực tiếp làm dược phẩm
Câu 22 :
Lượng clobenzen thu được khi cho 15,6 gam C6H6 tác dụng hết với Cl2 (xúc tác bột Fe) với hiệu suất phản ứng đạt 80% là :
Đáp án : C Phương pháp giải :
Tính theo PT: C6H6 + Cl2 $\xrightarrow{{{t^o},\,\,Fe}}$ C6H5Cl + HCl (1)
Lời giải chi tiết :
${n_{{C_6}{H_6}\,(pư)}} = \frac{{15,6}}{{78}}.80\% = 0,16\,\,mol.$ Phương trình phản ứng : C6H6 + Cl2 $\xrightarrow{{{t^o},\,\,Fe}}$ C6H5Cl + HCl (1) mol: 0,16 0,16 Vậy khối lượng clobenzen thu được là : 0,16.112,5= 18 gam.
Câu 23 :
Hỗn hợp gồm 1 mol C6H6 và 1,5 mol Cl2. Trong điều kiện có xúc tác bột Fe, to, hiệu suất 100%. Sau phản ứng thu được chất gì ? bao nhiêu mol ?
Đáp án : D Phương pháp giải :
Tỉ lệ mol $\dfrac{{{n_{C{l_2}}}}}{{{n_{{C_6}{H_6}}}}} = 1,5 \Rightarrow $ phản ứng tạo ra hỗn hợp hai sản phẩm là C6H5Cl và C6H4Cl2. Lời giải chi tiết :
Tỉ lệ mol $\dfrac{{{n_{C{l_2}}}}}{{{n_{{C_6}{H_6}}}}} = 1,5 \Rightarrow $ phản ứng tạo ra hỗn hợp hai sản phẩm là C6H5Cl và C6H4Cl2. Phương trình phản ứng : C6H6 + Cl2 $\xrightarrow{{{t^o},\,\,Fe}}$ C6H5Cl + HCl (1) mol: x x x x C6H6 + 2Cl2 $\xrightarrow{{{t^o},\,\,Fe}}$ C6H4Cl2 + 2HCl (2) mol: y 2y y 2y Theo giả thiết ta có: $\left\{ \begin{gathered}x + y = 1 \hfill \\x + 2y = 1,5 \hfill \\ \end{gathered} \right. \Rightarrow \left\{ \begin{gathered}x = 0,5 \hfill \\y = 0,5 \hfill \\ \end{gathered} \right.$ Vậy sau phản ứng thu được 0,5 mol C6H5Cl ; 1,5 mol HCl ; 0,5 mol C6H4Cl2.
Câu 24 :
Một hợp chất hữu cơ X có vòng benzen có CTĐGN là C3H2Br và M = 236. Gọi tên hợp chất này biết rằng hợp chất này là sản phẩm chính trong phản ứng giữa C6H6 và Br2 (xúc tác Fe).
Đáp án : A Phương pháp giải :
Đặt CTPT của hợp chất X là (C3H2Br)n => n +) Áp dụng quy tắc thế => tìm sản phẩm Lời giải chi tiết :
Đặt CTPT của hợp chất X là (C3H2Br)n suy ra (12.3+2+80).n = 236 => n = 2. => công thức phân tử của X là C6H4Br2 Vì hợp chất X là sản phẩm chính trong phản ứng giữa C6H6 và Br2 (xúc tác Fe) nên theo quy tắc thế trên vòng benzen ta thấy X có thể là o- đibrombenzen hoặc p-đibrombenzen.
Câu 25 :
TNT (2,4,6- trinitrotoluen) được điều chế bằng phản ứng của toluen với hỗn hợp gồm HNO3 đặc và H2SO4 đặc, trong điều kiện đun nóng. Biết hiệu suất của toàn bộ quá trình tổng hợp là 80%. Lượng TNT (2,4,6- trinitrotoluen) tạo thành từ 230 gam toluen là
Đáp án : C Phương pháp giải :
C6H5CH3 + 3HNO3 $\xrightarrow{{{H_2}S{O_4}\,đặc\,\,{t^o}}}$ C6H2(NO2)3CH3 + 3H2O (1) gam: 92 → 227 gam: 230.80% → x Lời giải chi tiết :
Phương trình phản ứng: C6H5CH3 + 3HNO3 $\xrightarrow{{{H_2}S{O_4}\,đặc\,\,{t^o}}}$ C6H2(NO2)3CH3 + 3H2O (1) gam: 92 → 227 gam: 230.80% → x Theo phương trình và giả thiết ta thấy khối lượng TNT (2,4,6-trinitrotoluen) tạo thành từ 230 gam toluen với hiệu suất 80% là : x=$\frac{{230.80\% .227}}{{92}} = 454$ gam.
Câu 26 :
Để oxi hoá hết 10,6 gam o-xilen (1,2-đimetylbenzen) cần bao nhiêu lít dung dịch KMnO4 0,5M trong môi trường H2SO4 loãng. Giả sử dùng dư 20% so với lượng phản ứng.
Đáp án : D Phương pháp giải :
Bảo toàn e: $5.{n_{KMn{O_4}}} = 12.{n_{o - xilen}}$ Lời giải chi tiết :
Quá trình cho – nhận e: $M{n^{ + 7}} + 5e \to M{n^{ + 2}}$ $2{C^{ - 3}} \to 2{C^{ + 3}} + 12e$ Bảo toàn e: $5.{n_{KMn{O_4}}} = 12.{n_{o - xilen}} = > {\text{ }}{n_{KMn{O_4}}} = {\text{ }}0,288{\text{ }}mol$ Vậy ${V_{{\text{dd}}\,KMn{O_4}}} = \frac{{0,288}}{{0,5}} = 0,576\,\,l{\text{lít}}.$
Câu 27 :
Đốt cháy hoàn toàn một thể tích hơi hợp chất hữu cơ A cần 10 thể tích oxi (đo cùng điều kiện nhiệt độ và áp suất), sản phẩm thu được chỉ gồm CO2 và H2O với tỉ lệ khối lượng là 44 : 9. Biết MA < 150. A có công thức phân tử là :
Đáp án : C Phương pháp giải :
Từ giả thiết = 44 : 9 suy ra: ${n_{C{O_2}}}:\,\,{n_{{H_2}O}}$ = 1 : 0,5 $ = > {n_C}:\,\,{n_H}$ => CTTQ của A Từ PTHH: CxHxOy + $(\frac{{5x}}{4} - \frac{y}{2})$ O2 $\xrightarrow{{{t^o}}}$ xCO2 + $\frac{x}{2}$ H2O (1) => tính x và y Lời giải chi tiết :
Từ giả thiết = 44 : 9 suy ra: ${n_{C{O_2}}}:\,\,{n_{{H_2}O}}$ = 1 : 0,5 $ = > {n_C}:\,\,{n_H}$= 1 : 1. A có thể có hoặc không có oxi, đặt công thức phân tử của A là CxHxOy. Phương trình phản ứng : CxHxOy + $(\frac{{5x}}{4} - \frac{y}{2})$ O2 $\xrightarrow{{{t^o}}}$ xCO2 + $\frac{x}{2}$ H2O (1) mol: 1 → $(\frac{{5x}}{4} - \frac{y}{2})$ Theo (1) và giả thiết ta có: $(\frac{{5x}}{4} - \frac{y}{2})$=10 $ \Rightarrow \left\{ \begin{gathered}x = 8 \hfill \\y = 0 \hfill \\ \end{gathered} \right.$ Vậy công thức phân tử của A là C8H8.
Câu 28 :
Đốt cháy hết 9,18 gam 2 đồng đẳng của benzen A, B thu được 8,1 gam H2O và V lít CO2 (đktc). Giá trị của V là :
Đáp án : D Phương pháp giải :
$ + ){m_H} = 2.{n_{{H_2}O}}$ $ + ){m_C} = {m_{hi{\text{dr}}oc{\text{a}}cbon}} - {m_H}$ Lời giải chi tiết :
Đặt công thức phân tử trung bình của A và B là: ${C_{\overline n }}{H_{2\overline n - 6}}$ ${n_{{H_2}O}} = \frac{{8,1}}{{18}} = 0,45\,\,mol \Rightarrow {m_H} = 0,45.2\,\, = 0,9\,\,gam$ $\Rightarrow {m_C} = 9,18 - 0,9 = 8,28\,\,gam \Rightarrow {n_{C{O_2}}} = {n_C} = \frac{{8,28}}{{12}} = 0,69\,\,mol.$ Vậy thể tích CO2 thu được là : 0,69.22,4=15,456 lít.
Câu 29 :
A, B, C là ba chất hữu cơ có %C, %H (theo khối lượng) lần lượt là 92,3% và 7,7%, tỉ lệ khối lượng mol tương ứng là 1: 2 : 3. Từ A có thể điều chế B hoặc C bằng một phản ứng. C không làm mất màu nước brom. Đốt 0,1 mol B rồi dẫn toàn bộ sản phẩm cháy qua bình đựng dung dịch nước vôi trong dư. Khối lượng dung dịch tăng hoặc giảm bao nhiêu gam ?
Đáp án : C Phương pháp giải :
+) ${n_C}:{n_H} = \frac{{92,3}}{{12}}:\frac{{7,7}}{1}$ => công thức đơn giản nhất của A, B, C +) Từ A có thể điều chế B hoặc C bằng một phản ứng; C không làm mất màu nước brom => A, B, C +) mdd giảm = mkết tủa – (mCO2 + mH2O)
Lời giải chi tiết :
Theo giả thiết ta thấy A, B, C có cùng công thức đơn giản nhất. ${n_C}:{n_H} = \frac{{92,3}}{{12}}:\frac{{7,7}}{1} = 1:1$.Công thức đơn giản nhất của A, B, C là CH. Từ A có thể điều chế B hoặc C bằng một phản ứng; C không làm mất màu nước brom nên A là C2H2, B là C4H4; C là C6H6 (benzen). Sơ đồ đốt cháy B : C4H4 $\xrightarrow{{{O_2},\,{t^o}}}$ 4CO2 + 2H2O (1) mol: 0,1 → 0,4 → 0,2 Dẫn toàn bộ sản phẩm cháy vào bình đựng nước vôi trong dư thì xảy ra phản ứng : CO2 + Ca(OH)2 → CaCO3 + H2 O (2) mol: 0,4 → 0,4 mkết tủa = 0,4.100 = 40 gam => mdung dịch giảm = 40 – 21,2 =18,8 gam
Câu 30 :
Đốt cháy hoàn toàn 0,1 mol hỗn hợp gồm X gồm C6H14 và CxHx (CxHx có vòng benzen) thu được 15,68 lít khí CO2 (đktc) và 9,9 gam nước. Nếu cho hỗn hợp trên vào dung dịch Br2 dư thì CxHx tác dụng hoàn toàn với m gam Br2 . Giá trị của m là
Đáp án : C Phương pháp giải :
Bước 1: Tính số mol C6H14 và CxHx - Tính nCO2, nH2O - Gọi số mol C6H14 và CxHx lần lượt là a và b (mol). - Lập hệ phương trình tìm số mol: + Pt (1): dựa vào số mol hỗn hợp X. + Pt (2): BTNT C ⟹ nCO2 = 6a + xb + Pt (3): BTNT H ⟹ 2nH2O = 14a + xb Bước 2: Xác định CTPT và CTCT của X Tìm được x ⟹ CTPT ⟹ CTCT của X Bước 3: Tính m Lời giải chi tiết :
Bước 1: Tính số mol C6H14 và CxHx - nCO2 = 0,7 mol; nH2O = 0,55 mol. - Gọi số mol C6H14 và CxHx lần lượt là a và b (mol). + nX = a + b = 0,1 (1) + BTNT C ⟹ nCO2 = 6a + xb = 0,7 (2) + BTNT H ⟹ 2nH2O = 14a + xb ⟹ 14a + xb = 1,1 (3) Từ (1), (2) và (3) ⟹ a = 0,05 ; b = 0,05 và x = 8. Bước 2: Xác định CTPT và CTCT của X - CxHx là C8H8 và có CTCT là C6H5CH=CH2 (chứa vòng benzen). Bước 3: Tính m - PTHH: C6H5CH=CH2 + Br2 ⟶ C6H5CHBr-CH2Br. Theo PTHH ⟹ nBr2 = nC8H8 = 0,05 mol. - Vậy mBr2 = 0,05.160 = 8 gam.
Câu 31 :
Tiến hành thí nghiệm theo các bước sau: Bước 1: Cho vào ống nghiệm khô khoảng 5 ml benzen và 2 ml brom nguyên chất, lắc nhẹ ống nghiệm. Bước 2: Để yên ống nghiệm trong 3 phút. Bước 3: Cho tiếp một ít bột sắt vào ống nghiệm trên rồi lắc nhẹ liên tục trong 3 phút. (Trong quá trình làm thí nghiệm, tránh ánh sáng chiếu trực tiếp vào chất lỏng trong ống nghiệm bằng cách bọc bên ngoài ống nghiệm một tờ giấy tối màu.) Cho các phát biểu sau: (1) Sau bước 1, có sự phân tách chất lỏng trong ống nghiệm thành hai lớp. (2) Ở bước 2, trong suốt quá trình màu của dung dịch trong ống nghiệm không thay đổi. (3) Ở bước 3, màu của dung dịch nhạt dần. (4) Ở bước 3, thêm bột sắt là để làm xúc tác cho phản ứng giữa benzen và brom xảy ra. (5) Sản phẩm hữu cơ chủ yếu thu được sau bước 3 là 1,2,3,4,5,6-hexabromxiclohexan). Số phát biểu đúng là
Đáp án : C Phương pháp giải :
Dựa vào tính chất hóa học của benzen. Lời giải chi tiết :
(1) sai, vì Br2 và C6H6 đều không phân cực nên tan trong nhau tạo dung dịch đồng nhất. (2) đúng, vì khi chưa có mặt bột Fe thì phản ứng không xảy ra. (3) đúng, vì C6H6 + Br2 (nâu đỏ) \(\xrightarrow{{Fe}}\) C6H5Br (không màu) + HBr. (4) đúng. (5) sai, C6H6 + Br2 \(\xrightarrow{{Fe}}\) C6H5Br (brom benzen) + HBr. Vậy có 3 phát biểu đúng.
|














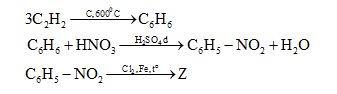





Danh sách bình luận