Trắc nghiệm Ôn tập chương 2 - Hóa 11Đề bài
Câu 1 :
Các tính chất không thuộc về tính chất của khí nitơ? a) Hóa lỏng ở nhiệt độ rất thấp (−1960C) b) Có khả năng đông nhanh c) Tan nhiều trong nước d) Nặng hơn Oxi e) Kém bền, dễ bị phân hủy thành nitơ nguyên tử
Câu 2 :
Cho phản ứng N2 + 3H2 $\overset {} \leftrightarrows $ 2NH3 (∆H = -92KJ) Muốn cho cân bằng của phản ứng nhiệt độ tổng hợp amoniac chuyển dịch sang phải cần phải đồng thời
Câu 3 :
Amoniac phản ứng được với tất cả các chất trong nhóm nào sau đây (các điều kiện coi như có đủ)
Câu 4 :
Trong dung dịch, amoniac là một bazơ yếu là do:
Câu 5 :
Có thể phân biệt muối amoni với các muối khác bằng cách cho nó tác dụng với dung dịch kiềm, vì khi đó:
Câu 6 :
Khí nitơ có thể được tạo thành từ phản ứng hóa học nào sau đây?
Câu 7 :
Một nhóm học sinh thực hiện thí nghiệm sau: Nhỏ từ từ dung dịch NH3 cho đến dư vào ống nghiệm đựng dung dịch CuSO4. Hiện tượng quan sát đầy đủ và đúng nhất là:
Câu 8 :
Đốt cháy hổn hợp gồm 6,72 lít khí oxi và 7 lít khí amoniac (đo ở cùng điều kiện nhiệt độ và áp suất). Sau phản ứng thu được nhóm các chất là:
Câu 9 :
Phải dùng bao nhiêu lít khí nitơ và bao nhiêu lít khí hiđro tiheo tỉ lệ 1:3 để điều chế 17 gam NH3? Biết rằng hiệu suất chuyển hóa thành amoniac là 25%. Các thể tích khí đo được ở đktc.
Câu 10 :
Trong những nhận xét dưới đây về muối amoni, nhận xét nào là đúng?
Câu 11 :
Trong một bình kín chứa 10 lít nitơ và 10 lít hiđro ở nhiệt độ 0oC và 10 atm. Sau khi phản ứng tổng hợp NH3, lại đưa bình về 0oC. Biết rằng có 60% hiđro tham gia phản ứng, áp suất trong bình sau phản ứng là:
Câu 12 :
Cho 0,448 lít khí NH3 (đktc) đi qua ống sứ đựng 16 gam CuO nung nóng, thu được chất rắn X (giả sử phản ứng xảy ra hoàn toàn). Phần trăm khối lượng của Cu trong X là
Câu 13 :
Có 4 dung dịch muối riêng biệt: CuCl2, ZnCl2, FeCl3, AlCl3. Nếu thêm dung dịch KOH dư, rồi thêm tiếp dung dịch NH3 dư vào 4 dung dịch trên thì số chất kết tủa thu được là
Câu 14 :
Phản ứng giữa kim loại magie với axit nitric đặc, giả thiết chỉ tạo ra đinitơ oxit. Tổng các hệ số trong phương trình hóa học bằng:
Câu 15 :
Axit nitric đặc, nóng phản ứng được với tất cả các chất trong nhóm nào sau đây?
Câu 16 :
Hòa tan 1,2 gam kim loại X vào dung dịch HNO3 dư thu được 0,224 lít khí nitơ ở đktc (giả thiết phản ứng chỉ tạo ra khí N2). Vậy X là:
Câu 17 :
Khi bị nhiệt phân, dãy muối nitrat nào sau đây đều cho sản phẩm là kim loại, khí nitơ đioxit và khí oxi?
Câu 18 :
Nung nóng hoàn toàn 27,3 gam hổn hợp NaNO3, Cu(NO3)2. Hỗn hợp khí thoát ra được dẫn vào nước dư thấy có 1,12 lít khí (ở đktc) không bị hấp thụ, khối lượng Cu(NO3)2 trong hỗn hợp ban đầu là
Câu 19 :
Để nhận biết ion NO3- người ta thường dùng Cu và dung dịch H2SO4 loãng nhờ
Câu 20 :
Cho 2 phản ứng Fe + 2HCl → FeCl2 + H2↑ (1) Fe + 4HNO3 →Fe(NO3)3 + NO↑ + 2H2O (2) Tìm phát biểu đúng
Câu 21 :
Cho hỗn hợp C và S vào dung dịch HNO3 đặc thu được hỗn hợp khí X và dung dịch Y. Thành phần của X là
Câu 22 :
Hoà tan hoàn 12,4 gam hỗn hợp X gồm Fe và Cu bằng dung dịch HNO3 1M vừa đủ, sau phản ứng thu được dung dịch A gồm 2 muối Fe(NO3)3 và Cu(NO3)2 đồng thời thu được hỗn hợp khí Y gồm: 0,1 mol NO và 0,15 mol NO2 (đktc). Phần trăm theo khối lượng Fe có trong hỗn hợp là:
Câu 23 :
Cho sơ đồ chuyển hoá: ${P_2}{O_5}\xrightarrow{{ + KOH dư}}X\xrightarrow{{ + {H_3}P{O_4}}}Y\xrightarrow{{ + KOH}}Z$ Các chất X, Y, Z lần lượt là :
Câu 24 :
Trong thành phần của thuốc chuột có hợp chất của photpho là Zn3P2. Khi bả chuột bằng loại thuốc này thì chuột thường chết gần nguồn nước bởi vì khi Zn3P2 vào dạ dày chuột thì sẽ hấp thu một lượng nước lớn và sinh ra đồng thời lượng lớn khí X và kết tủa Y khiến cho dạ dày chuột vỡ ra. Phát biểu nào sau đây không đúng?
Câu 25 :
Cho 200 ml dung dịch H3PO4 0,3M vào 500 ml dung dịch Ba(OH)2 0,16M. Sau khi phản ứng xảy ra hoàn toàn. Khối lượng muối có phân tử khối bé hơn là
Câu 26 :
Cho H3PO4 tác dụng hết với dung dịch chứa m gam NaOH, sau phản ứng thu được dung dịch X có chứa 1,22m gam chất tan. Các chất tan trong dung dịch X là
Câu 27 :
Đốt cháy hoàn toàn 6,2 gam photpho bằng oxi dư rồi cho sản phẩm tạo thành tác dụng vừa đủ với m gam dung dịch NaOH 32% thu được muối Na2HPO4. Giá trị của m là:
Câu 28 :
Cho m gam P2O5 vào 1 lít dung dịch hỗn hợp NaOH 0,2M và KOH 0,3M vừa đủ sau phản ứng hoàn toàn thu được dung dịch X. Cô cạn cẩn thận X thu được 35,4 gam hỗn hợp muối khan. Giá trị của m là
Câu 29 :
Đốt cháy hoàn toàn 6,2 gam photpho trong khí O2 dư, toàn bộ sản phẩm sinh ra cho vào 500 ml dung dịch hỗn hợp NaOH 0,4M và KOH 0,6M, kết thúc phản ứng thu được dung dịch X. Biết các phản ứng xảy ra hoàn toàn. Tổng khối lượng muối có trong dung dịch X là
Câu 30 :
Trong phòng thí nghiệm N2O được điều chế bằng cách
Câu 31 :
Cho các phát biểu sau: (a) Có thể phân biệt dung dịch NH3 với dung dịch HCl bằng quỳ tím. (b) Nhỏ dung dịch NH3 đến dư vào dung dịch AlCl3 thu được kết tủa. (c) CuO tác dụng với dung dịch HNO3 đặc, giải phóng khí NO2. (d) Nhiệt phân NaNO3 thu được hỗn hợp khí. Số phát biểu đúng là
Câu 32 :
Axit nitric và axit photphoric cùng phản ứng với nhóm các chất sau:
Câu 33 :
Cho các mẫu phân bón sau: KCl, Ca(H2PO4)2, NH4H2PO4 và NH4NO3. Dùng 1 hóa chất nào sau đây có thể phân biệt được các mẫu phân bón trên?
Câu 34 :
Cho các phát biểu sau: (a) Khoáng vật chính của photpho trong tự nhiên là pirit, apatit và photphoric. (b) Các số oxi hóa có thể có của photpho là -3; +3; +5; 0. (c) Tính chất hóa học điển hình của photpho là tính oxi hóa. (d) Trong phòng thí nghiệm, axit photphoric được điều chế bằng phản ứng giữa P2O5 và H2O. (e) Độ dinh dưỡng của phân lân được đánh giá bằng hàm lượng % của photpho có trong phân. Số phát biểu không đúng là:
Lời giải và đáp án
Câu 1 :
Các tính chất không thuộc về tính chất của khí nitơ? a) Hóa lỏng ở nhiệt độ rất thấp (−1960C) b) Có khả năng đông nhanh c) Tan nhiều trong nước d) Nặng hơn Oxi e) Kém bền, dễ bị phân hủy thành nitơ nguyên tử
Đáp án : C Lời giải chi tiết :
Các tính chất không phải của nitơ là: c) Tan nhiều trong nước d) Nặng hơn Oxi e) Kém bền, dễ bị phân hủy thành nitơ nguyên tử
Câu 2 :
Cho phản ứng N2 + 3H2 $\overset {} \leftrightarrows $ 2NH3 (∆H = -92KJ) Muốn cho cân bằng của phản ứng nhiệt độ tổng hợp amoniac chuyển dịch sang phải cần phải đồng thời
Đáp án : B Phương pháp giải :
Áp dụng nguyên lí chuyển dịch cân bằng: - Tăng áp suất cân bằng sẽ chuyển theo chiều giảm số phân tử khí và ngược lại - Phản ứng thu nhiệt cân bằng sẽ chuyển dịch theo chiều thuận nếu tăng nhiệt độ - Tăng nồng độ các chất cân bằng sẽ chuyển dịch theo chiều giảm nồng độ chất đó Lời giải chi tiết :
Ảnh hưởng của áp suất: -Khi tăng áp suất của hệ thì cân bằng chuyển dịch theo chiều giảm số mol khí mà ban đầu có 4 mol sau khi tạo NH3 thì số mol là 2 => Tăng áp suất phản ứng cân bằng sẽ chuyển dịch theo chiều sinh ra là NH3 chiều thuận -∆H<0: tỏa nhiệt Vậy để cân bằng chuyển dịch qua bên phải thì phải giảm nhiệt độ
Câu 3 :
Amoniac phản ứng được với tất cả các chất trong nhóm nào sau đây (các điều kiện coi như có đủ)
Đáp án : A Lời giải chi tiết :
NH3 có tính bazơ nên không phản ứng được với bazơ mạnh =>NaOH, KOH không phản ứng với NH3 loại B, C, D
Câu 4 :
Trong dung dịch, amoniac là một bazơ yếu là do:
Đáp án : D Lời giải chi tiết :
Trong dung dịch, amoniac là một bazơ yếu là do: Khi tan trong nước, chỉ một phần nhỏ các phân tử amoniac kết hợp với ion H+ của nước tạo ra các ion NH4+ và OH-
Câu 5 :
Có thể phân biệt muối amoni với các muối khác bằng cách cho nó tác dụng với dung dịch kiềm, vì khi đó:
Đáp án : B Lời giải chi tiết :
Ta có: NH4+ + OH- → NH3 \( \uparrow \)+H2O => Để phân biệt muối amoni với các muối khác là người ta cho muối amoni với dung dịch kiềm vì khi đó thoát ra một chất khí không màu, mùi khai, làm xanh giấy quỳ tím ẩm.
Câu 6 :
Khí nitơ có thể được tạo thành từ phản ứng hóa học nào sau đây?
Đáp án : D Lời giải chi tiết :
Ta có PTHH: A. 2NH3 + 5/2 O2 $\xrightarrow{{{t^o},\operatorname{Pt} }}$ 2NO + 3H2O B. NH4NO3$\xrightarrow{{{t^o}}}$N2O + 2H2O C. AgNO3$\xrightarrow{{{t^o}}}$Ag + NO2 + ½ O2 D. NH4NO2$\xrightarrow{{{t^o}}}$N2 + 2H2O
Câu 7 :
Một nhóm học sinh thực hiện thí nghiệm sau: Nhỏ từ từ dung dịch NH3 cho đến dư vào ống nghiệm đựng dung dịch CuSO4. Hiện tượng quan sát đầy đủ và đúng nhất là:
Đáp án : C Lời giải chi tiết :
Các phản ứng xảy ra CuSO4 + 2NH3 + H2O → Cu(OH)2 ↓xanh lam + (NH4)2SO4 Cu(OH)2 + NH3 + H2O → [Cu(NH3)4](OH)2 (dd màu xanh thẫm) => Lúc đầu có kết tủa màu xanh lam, sau đó kết tủa tan dần tạo thành dung dịch màu xanh thẫm
Câu 8 :
Đốt cháy hổn hợp gồm 6,72 lít khí oxi và 7 lít khí amoniac (đo ở cùng điều kiện nhiệt độ và áp suất). Sau phản ứng thu được nhóm các chất là:
Đáp án : B Phương pháp giải :
+) Xét tỉ lệ tìm ra chất dư, chất hết +) Tính theo chất hết Lời giải chi tiết :
Phản ứng: 4NH3 + 3O2 → 2N2 + 6H2O Xét tỉ lệ thể tích: $\dfrac{{{n_{N{H_3}}}}}{4} = \dfrac{7}{4} < \dfrac{{{n_{{O_2}}}}}{3} = \dfrac{{6,72}}{3}$ => dư oxi. Do đó, các chất thu được sau phản ứng là khí nitơ, nước được tạo thành và khí oxi dư.
Câu 9 :
Phải dùng bao nhiêu lít khí nitơ và bao nhiêu lít khí hiđro tiheo tỉ lệ 1:3 để điều chế 17 gam NH3? Biết rằng hiệu suất chuyển hóa thành amoniac là 25%. Các thể tích khí đo được ở đktc.
Đáp án : A Phương pháp giải :
+) Tính số mol NH3 thu được nếu H = 100% => số mol các khí cần tìm Lời giải chi tiết :
${m_{N{H_3}}}$ thu được nếu H = 100% $ = \dfrac{{17}}{{25\% }} = 68\,gam$ => ${n_{N{H_3}}}$= 4 mol N2 + 3H2 $\overset {} \leftrightarrows $ 2NH3 2 $ \leftarrow $ 6 $ \leftarrow $4 mol => ${n_{{H_2}}} = 6\,mol \Rightarrow {V_{{H_2}}} = 134,4$ lít => ${n_{{N_2}}} = 2{\text{ }}mol \Rightarrow {V_{{N_2}}}{\text{ = }}44,8$ lít
Câu 10 :
Trong những nhận xét dưới đây về muối amoni, nhận xét nào là đúng?
Đáp án : B Lời giải chi tiết :
A sai vì muối amoni là tinh thể ion, phân tử gồm cation amoni và anion gốc axit C sai vì khí làm quì hóa xanh D sai vì khi nhiệt phân muối amoni chưa chắc ra khi amoniac. VD: NH4NO2 $\xrightarrow{{{t^o}}}$ N2 + 2H2O
Câu 11 :
Trong một bình kín chứa 10 lít nitơ và 10 lít hiđro ở nhiệt độ 0oC và 10 atm. Sau khi phản ứng tổng hợp NH3, lại đưa bình về 0oC. Biết rằng có 60% hiđro tham gia phản ứng, áp suất trong bình sau phản ứng là:
Đáp án : B Phương pháp giải :
+) $\dfrac{{{n_H}_{_2}}}{{{n_N}_{_2}}} = \dfrac{3}{1}$ +) Hiđro phản ứng là 60% từ đó tính tổng thể tích khí phản ứng +) Sau phản ứng thể tích khí giảm bằng ½ thể tích khí phản ứng => Vgiảm => Vsau phản ứng +) áp dụng CT: $\dfrac{{{V_1}}}{{{V_2}}} = \dfrac{{{n_1}}}{{{n_2}}} = \dfrac{{{p_1}}}{{{p_2}}}$ Lời giải chi tiết :
N2+3H2 $\overset {} \leftrightarrows $ 2NH3 Theo PT tổng hợp NH3 thì $\dfrac{{{n_H}_{_2}}}{{{n_N}_{_2}}} = \dfrac{3}{1}$ Thể tích H2 phản ứng là 6 lít => VN2 = 2 lit Tổng thể tích khí phản ứng là 8 lit Sau phản ứng thể tích khí giảm bằng ½ thể tích khí phản ứng => Vgiảm = 4 lit => Vsau phản ứng = 10 + 10 − 4 = 16 lit $\dfrac{{{V_1}}}{{{V_2}}} = \dfrac{{{n_1}}}{{{n_2}}} = \dfrac{{{p_1}}}{{{p_2}}} \Rightarrow \dfrac{{20}}{{16}} = \dfrac{{10}}{{{p_2}}} \Rightarrow {p_2} = 8\,atm$
Câu 12 :
Cho 0,448 lít khí NH3 (đktc) đi qua ống sứ đựng 16 gam CuO nung nóng, thu được chất rắn X (giả sử phản ứng xảy ra hoàn toàn). Phần trăm khối lượng của Cu trong X là
Đáp án : D Phương pháp giải :
+) Xét chất hết, chất dư +) nCu = 1,5.nNH3 => mCu +) mX = mCu + mCuO dư Lời giải chi tiết :
nCuO = 0,2 mol ; nNH3 = 0,02 mol 3CuO + 2NH3 $\xrightarrow{{{\text{t}^\text{0}}}}$ 3Cu + N2 + 3H2O 0,03 $ \leftarrow $ 0,02 nCu = 0,03 mol => mCu = 1,92 gam mX = mCu + mCuO dư = 1,92 + (0,2 – 0,03).80 = 15,52 gam => %mCu trong X = $\dfrac{{1,92}}{{15,52}}.100\% = 12,37\% $
Câu 13 :
Có 4 dung dịch muối riêng biệt: CuCl2, ZnCl2, FeCl3, AlCl3. Nếu thêm dung dịch KOH dư, rồi thêm tiếp dung dịch NH3 dư vào 4 dung dịch trên thì số chất kết tủa thu được là
Đáp án : A Phương pháp giải :
+) KOH dư sẽ không kết tủa với ion Zn2+,Al3+, Cr3+ . +) NH3 có khả năng tạo phức với ion: Cu2+, Ag+, Zn2+ hòa tan kết tủa. Lời giải chi tiết :
Khi cho KOH dư $\begin{gathered}\text{C}{\text{u}^{\text{2 + }}}\text{ + 2O}{\text{H}^\text{ - }}\xrightarrow{{}}\text{Cu(OH}{\text{)}_\text{2}} \downarrow \hfill \\\text{Z}{\text{n}^{\text{2 + }}}\text{ + 4O}{\text{H}^\text{ - }}\xrightarrow{{}}\text{4Zn(OH)}_\text{4}^{\text{2 - }} \hfill \\\text{F}{\text{e}^{\text{3 + }}}\text{ + 3O}{\text{H}^\text{ - }}\xrightarrow{{}}\text{Fe(OH}{\text{)}_\text{3}} \downarrow \hfill \\\text{A}{\text{l}^{\text{3 + }}}\text{ + 4O}{\text{H}^\text{ - }}\xrightarrow{{}}\text{Al(OH)}_\text{4}^\text{ - } \hfill \\ \end{gathered} $ Thêm tiếp NH3 thì NH3 sẽ tạo phức với Cu2+, Zn2+ Zn(OH)2 + 4NH3 → [Zn(NH3)4](OH)2 Cu(OH)2 + 4NH3 → [Cu(NH3)4](OH)2 => chỉ còn kết tủa Fe(OH)3
Câu 14 :
Phản ứng giữa kim loại magie với axit nitric đặc, giả thiết chỉ tạo ra đinitơ oxit. Tổng các hệ số trong phương trình hóa học bằng:
Đáp án : C Phương pháp giải :
Sử dụng phương pháp cân bằng electron Lời giải chi tiết :
Ta có PTHH: 10HNO3 + 4Mg → 5H2O + 4Mg(NO3)2 + N2O
Câu 15 :
Axit nitric đặc, nóng phản ứng được với tất cả các chất trong nhóm nào sau đây?
Đáp án : A Lời giải chi tiết :
HNO3 không phản ứng được với Pt loại B HNO3 không phản ứng được với CO2, Au loại C HNO3 không phản ứng được với Au loại D
Câu 16 :
Hòa tan 1,2 gam kim loại X vào dung dịch HNO3 dư thu được 0,224 lít khí nitơ ở đktc (giả thiết phản ứng chỉ tạo ra khí N2). Vậy X là:
Đáp án : C Phương pháp giải :
Gọi kim loại là X; kim loại có số oxi hóa là +n +) Sử dụng bảo toàn e +) biện luận theo x để tìm M của kim loại Lời giải chi tiết :
Gọi kim loại là X; kim loại có số oxi hóa là +n X → X+n + ne 0,01/n ← 0,01 mol 2N+5 + 10e →N20 0,01←0,02 mol => MX = 12n
Vậy M là Mg
Câu 17 :
Khi bị nhiệt phân, dãy muối nitrat nào sau đây đều cho sản phẩm là kim loại, khí nitơ đioxit và khí oxi?
Đáp án : D Phương pháp giải :
$\underbrace {K,Na,Ca,}_I\underbrace {Mg,Al,Zn,Fe,Ni,Sn,Pb,Cu}_{II},\underbrace {Hg,Ag,Au}_{III}$ +) Nhóm I nhiệt phân tạo muối nitrit và oxi: VD 2KNO3$\xrightarrow{{{t^ \circ }}}$ 2KNO2 + O2↑ +) Nhóm II nhiệt phân tạo oxit lim loại, khí NO2 và oxi: VD 2Cu(NO3)2 $\xrightarrow{{{t^ \circ }}}$2CuO + 4NO2 ↑+ O2↑ +) Nhóm III nhiệt phân tạo lim loại, khí NO2 và oxi: VD 2AgNO3$\xrightarrow{{{t^ \circ }}}$2Ag + 2NO2 ↑+ O2↑ Lời giải chi tiết :
$\underbrace {K,Na,Ca,}_I\underbrace {Mg,Al,Zn,Fe,Ni,Sn,Pb,Cu}_{II},\underbrace {Hg,Ag,Au}_{III}$ Nhiệt phân cho sản phẩm kim loại, khí nitơ đioxit và khí oxi là kim loại nhóm III. PTHH: \[Hg{(N{O_3})_2}\,\,\xrightarrow{{{t^o}}}\,\,Hg\,\, + \,\,2N{O_2} \uparrow \,\, + {O_2} \uparrow \] \[2AgN{O_3}\,\,\xrightarrow{{{t^o}}}\,\,2Ag\,\, + \,\,2N{O_2} \uparrow \,\, + {O_2} \uparrow \] => dãy muối cho sản phẩm kim loại, khí nitơ đioxit và khí oxi là: Hg(NO3)2, AgNO3
Câu 18 :
Nung nóng hoàn toàn 27,3 gam hổn hợp NaNO3, Cu(NO3)2. Hỗn hợp khí thoát ra được dẫn vào nước dư thấy có 1,12 lít khí (ở đktc) không bị hấp thụ, khối lượng Cu(NO3)2 trong hỗn hợp ban đầu là
Đáp án : A Phương pháp giải :
Gọi số mol của NaNO3, Cu(NO3)2 lần lượt là x và y +) Tính số mol NO2 và O2 sinh ra theo a và b +) Khí không bị hấp thụ là O2 còn dư => nO2 dư => a => mCu(NO3)2 Lời giải chi tiết :
Gọi số mol của NaNO3, Cu(NO3)2 lần lượt là x và y NaNO3 → NaNO2 + ½ O2 a → 0,5a Cu(NO3)2→ CuO + 2NO2 + ½ O2 b → 2b → 0,5b Hỗn hợp khí gồm nNO2 = 2b mol, nO2 = 0,5.(a + b) Hấp thụ hỗn hợp khí vào nước 4NO2 + O2 + 2H2O → 4HNO3 2b → 0,5b Khí không bị hấp thụ là O2 còn dư => nO2 dư = 0,5.(a +b) - 0,5b = 0,5a = 0,05 mol => a = 0,1 mol => mCu(NO3)2 = (27,3 – 85.0,1) = 18,8 gam
Câu 19 :
Để nhận biết ion NO3- người ta thường dùng Cu và dung dịch H2SO4 loãng nhờ
Đáp án : D Lời giải chi tiết :
Để nhận biết ion NO3- người ta thường dùng Cu và dung dịch H2SO4 loãng nhờ phản ứng tạo dung dịch màu xanh và khí không màu hóa nâu trong không khí. 3Cu + 8H+ + 2NO3- → 3Cu2+ + 2NO + 4H2O
Câu 20 :
Cho 2 phản ứng Fe + 2HCl → FeCl2 + H2↑ (1) Fe + 4HNO3 →Fe(NO3)3 + NO↑ + 2H2O (2) Tìm phát biểu đúng
Đáp án : B Lời giải chi tiết :
A sai vì H+ ở phản ứng (2) không có sự thay đổi số oxi hóa B đúng vì: 2H+ + 2e → H2 => H+ là hợp phần oxi hóa $\mathop N\limits^{ + 5} + 3{\text{e}} \to \mathop N\limits^{ + 2} $ =>NO3- là hợp phần oxi hóa C sai vì ở phản ứng (1) HCl không có vai trò là môi trường D sai vì 2 phản ứng không kết luận được Fe khử yếu hay khử mạnh
Câu 21 :
Cho hỗn hợp C và S vào dung dịch HNO3 đặc thu được hỗn hợp khí X và dung dịch Y. Thành phần của X là
Đáp án : D Lời giải chi tiết :
C + 4HNO3 đặc → 2H2O + 4NO2 + CO2 S + 2HNO3 đặc → H2SO4 + 2NO2 2 khí thu được là CO2 và NO2
Câu 22 :
Hoà tan hoàn 12,4 gam hỗn hợp X gồm Fe và Cu bằng dung dịch HNO3 1M vừa đủ, sau phản ứng thu được dung dịch A gồm 2 muối Fe(NO3)3 và Cu(NO3)2 đồng thời thu được hỗn hợp khí Y gồm: 0,1 mol NO và 0,15 mol NO2 (đktc). Phần trăm theo khối lượng Fe có trong hỗn hợp là:
Đáp án : A Phương pháp giải :
+) Sử dụng phương pháp bảo toàn e cho các nguyên tố: Cu; Fe; NO; NO2 Lời giải chi tiết :
nCu = x mol; nFe = y mol => mX = 64x + 56y = 12,4 (1)  Bảo toàn electron: n e cho = n e nhận = 2x + 3y = 0,45 mol (2) Giải hệ (1) và (2) => x = 0,15 và y = 0,05 => nFe = 0,05 mol => $\% {m_{Fe}} = \dfrac{{0,05.56}}{{12,4}}.100\% = 22,58\% $
Câu 23 :
Cho sơ đồ chuyển hoá: ${P_2}{O_5}\xrightarrow{{ + KOH dư}}X\xrightarrow{{ + {H_3}P{O_4}}}Y\xrightarrow{{ + KOH}}Z$ Các chất X, Y, Z lần lượt là :
Đáp án : D Lời giải chi tiết :
Ta có: P2O5 +6 KOH dư →2 K3PO4 +3H2O => X là K3PO4 2K3PO4 +H3PO4 → 3K2HPO4 Hoặc: K3PO4 +2H3PO4 → 3KH2PO4 => Y là K2HPO4 hoặc KH2PO4 Y + KOH → Z và X; Y; Z là các chất khác nhau mà KH2PO4 + KOH →2 K2HPO4 +H2O tức Y + KOH → Z => Y là KH2PO4, Z là K2HPO4
Câu 24 :
Trong thành phần của thuốc chuột có hợp chất của photpho là Zn3P2. Khi bả chuột bằng loại thuốc này thì chuột thường chết gần nguồn nước bởi vì khi Zn3P2 vào dạ dày chuột thì sẽ hấp thu một lượng nước lớn và sinh ra đồng thời lượng lớn khí X và kết tủa Y khiến cho dạ dày chuột vỡ ra. Phát biểu nào sau đây không đúng?
Đáp án : D Lời giải chi tiết :
PTHH: Zn3P2 + 6H2O → 2PH3 + 3Zn(OH)2 => khí X là PH3 và kết tủa Y là Zn(OH)2 X không thể tạo ra từ H2 + P
Câu 25 :
Cho 200 ml dung dịch H3PO4 0,3M vào 500 ml dung dịch Ba(OH)2 0,16M. Sau khi phản ứng xảy ra hoàn toàn. Khối lượng muối có phân tử khối bé hơn là
Đáp án : B Phương pháp giải :
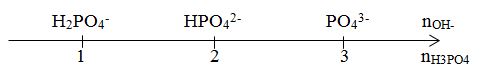 +) tỉ lệ \(\frac{{{n_{O{H^ - }}}}}{{{n_{{H_3}P{O_4}}}}}\) +) Đối chiếu với sơ đổ quy kết muối +) Viết PTHH, đặt ẩn giải hệ Lời giải chi tiết :
${n_{{H_3}P{O_4}}}$= 0,06 mol ${n_{Ba{{(OH)}_2}}}$= 0,08 mol $ \Rightarrow {n_{O{H^ - }}}$= 0,16 mol \(\frac{{{n_{O{H^ - }}}}}{{{n_{{H_3}P{O_4}}}}} = \frac{{0,16}}{{0,06}} = 2,67\) Ta thấy 2 < 2,67 <3 $ \Rightarrow $ Tạo 2 muối $HPO_4^{2 - }$ (x mol) và $PO_4^{3 - }$(y mol) BT nguyên tố P: ${n_{{H_3}P{O_4}}} = {n_{HPO_4^{2 - }}} + {n_{PO_4^{3 - }}}$ => x + y = 0,06 (1) BT điện tích: ${n_{O{H^ - }}} = 2.{n_{HPO_4^{2 - }}} + 3.{n_{PO_4^{3 - }}}$ => 2x + 3y = 0,16 (2) Từ (1) và (2) => x = 0,02 mol; y = 0,04 mol Ta có: ${n_{BaHP{O_4}}} = {n_{HPO_4^{2 - }}}$= 0,02 mol $ \Rightarrow $${m_{BaHP{O_4}}}$= 0,02.233 = 4,66 gam ${n_{B{a_3}{{(P{O_4})}_2}}} = \dfrac{1}{2}{n_{PO_4^{3 - }}}$= 0,02 mol $ \Rightarrow $${m_{B{a_3}{{(P{O_4})}_2}}} = $0,02.601 = 12,02 gam
Câu 26 :
Cho H3PO4 tác dụng hết với dung dịch chứa m gam NaOH, sau phản ứng thu được dung dịch X có chứa 1,22m gam chất tan. Các chất tan trong dung dịch X là
Đáp án : C Phương pháp giải :
+) Gán giá trị m là 20 gam, từ đó tính số mol NaOH và Khối lượng chất rắn. +) Giả sử OH- hết ta có PTHH: H+ + OH- → H2O Sau đó áp dụng bảo toàn khối lượng để tính lại số mol H+, so sánh với OH- xem giả sử đúng hay sai +) Kết luận chất tan. Lời giải chi tiết :
Coi m =20 gam nNaOH =0,5 mol mChất rắn =24,4 gam Giả sử OH- hết Ta thấy bản chất phản ứng: H+ + OH- → H2O 0,5\( \leftarrow \) 0,5 →0,5 BT khối lượng: \({m_{{H_3}P{O_4}}} + {m_{NaOH}} = {m_{{H_2}O}}\) + m chất rắn
\({n_{{H^ + }}}\) phản ứng = 0,1367*3=0,41 mol < 0,5. Vậy OH- dư
Câu 27 :
Đốt cháy hoàn toàn 6,2 gam photpho bằng oxi dư rồi cho sản phẩm tạo thành tác dụng vừa đủ với m gam dung dịch NaOH 32% thu được muối Na2HPO4. Giá trị của m là:
Đáp án : B Phương pháp giải :
Bảo toàn nguyên tố Lời giải chi tiết :
Do phản ứng chỉ tạo ra ${N{a_2}HP{O_4}}$ nên : $2{n_P} = 2{n_{N{a_2}HP{O_4}}} = {n_{NaOH}}$ (bảo toàn nguyên tố) => ${n_{NaOH}} = \dfrac{{2.6,2}}{{31}} = 0,4{\text{ }}mol$ => Khối lượng dung dịch NaOH cần dùng là: $m = \dfrac{{0,4.40.100}}{{32}} = 50\,gam$
Câu 28 :
Cho m gam P2O5 vào 1 lít dung dịch hỗn hợp NaOH 0,2M và KOH 0,3M vừa đủ sau phản ứng hoàn toàn thu được dung dịch X. Cô cạn cẩn thận X thu được 35,4 gam hỗn hợp muối khan. Giá trị của m là
Đáp án : D Phương pháp giải :
+) Vừa đủ => OH- hết : OH- + H+ → H2O => \({n_{O{H^ - }}} = {n_{{H_2}O}}\) +) Bảo toàn khối lượng: ${m_{{H_3}P{O_4}}} + {m_{NaOH}} + {m_{KOH}} = $ mmuối $ + {m_{{H_2}O}}$ Lời giải chi tiết :
Xét H3PO4 phản ứng với bazơ Vừa đủ => OH- hết : OH- + H+ → H2O => nH2O = nOH = 0,5 mol Bảo toàn khối lượng : ${m_{{H_3}P{O_4}}} + {m_{NaOH}} + {m_{KOH}} = $ mmuối $ + {m_{{H_2}O}}$ => ${m_{{H_3}P{O_4}}}$ + 0,2*40+0,3*56= 35,4 + 0,5*18 ${n_{{H_3}P{O_4}}} = 0,2\,gam \Rightarrow {n_{{P_2}{O_5}}} = \dfrac{1}{2}{n_{{H_3}P{O_4}}} = 0,1\,mol$ => m = 14,2 gam
Câu 29 :
Đốt cháy hoàn toàn 6,2 gam photpho trong khí O2 dư, toàn bộ sản phẩm sinh ra cho vào 500 ml dung dịch hỗn hợp NaOH 0,4M và KOH 0,6M, kết thúc phản ứng thu được dung dịch X. Biết các phản ứng xảy ra hoàn toàn. Tổng khối lượng muối có trong dung dịch X là
Đáp án : C Phương pháp giải :
Gọi công thức trung bình của bazơ và làm tương tự như cho 1 bazơ tác dụng với P2O5 Lời giải chi tiết :
2P → P2O5 → 2H3PO4 0,2 → 0,2 ${n_{{H_3}P{O_4}}} = 0,2{\text{ }}mol$ ${n_{O{H^ - }}} = 0,5{\text{ }}mol \Rightarrow 2 < \dfrac{{{n_{O{H^ - }}}}}{{{n_{{H_3}P{O_4}}}}} = 2,5 < 3$ => Muối gồm: \(\left\{ \begin{array}{l}N{a_2}HP{O_4} = xmol\\N{a_3}P{O_4} = ymol\end{array} \right.\) Các phản ứng xảy ra: 2MOH + H3PO4 → M2HPO4 + 2H2O 2x \( \leftarrow \) x \( \leftarrow \)x 3MOH + H3PO4 → M3PO4 + 3H2O 3y \( \leftarrow \) y \( \leftarrow \)y Ta có hệ phương trình:\(\left\{ \begin{array}{l}2x + 3y = 0,5\\x + y = 0,2\end{array} \right.\) => Muối gồm : 0,1 mol M2HPO4 và 0,1 mol M3PO4 mmuối $ = {m_K} + {m_{Na}} + {m_{HPO_4^{2 - }}} + {m_{PO_4^{3 - }}} = 35,4\,gam$
Câu 30 :
Trong phòng thí nghiệm N2O được điều chế bằng cách
Đáp án : C Phương pháp giải :
Dựa vào phương pháp điều chế N2O trong phòng thí nghiệm. Lời giải chi tiết :
Trong phòng thí nghiệm, người ta điều chế N2O bằng phương pháp nhiệt phân muối NH4NO3: NH4NO3 \(\xrightarrow{{{t^o}}}\) N2O + 2H2O
Câu 31 :
Cho các phát biểu sau: (a) Có thể phân biệt dung dịch NH3 với dung dịch HCl bằng quỳ tím. (b) Nhỏ dung dịch NH3 đến dư vào dung dịch AlCl3 thu được kết tủa. (c) CuO tác dụng với dung dịch HNO3 đặc, giải phóng khí NO2. (d) Nhiệt phân NaNO3 thu được hỗn hợp khí. Số phát biểu đúng là
Đáp án : D Lời giải chi tiết :
(a) đúng, vì NH3 làm quỳ tím hóa xanh còn HCl làm quỳ tím hóa đỏ (b) đúng vì AlCl3 + 3NH3 + 3H2O → 3NH4Cl + Al(OH)3 ↓ (kết tủa không bị hòa tan bởi NH3 dư) (c) sai vì Cu có hóa trị cao nhất nên không có phản ứng oxi hóa khử với HNO3 mà chỉ xảy ra phản ứng trao đổi: CuO + 2HNO3 → Cu(NO3)2 + H2O (d) sai vì nhiệt phân NaNO3 chỉ thu được 1 khí là O2. PTHH: NaNO3 → NaNO2 + O2 → 2 phát biểu đúng
Câu 32 :
Axit nitric và axit photphoric cùng phản ứng với nhóm các chất sau:
Đáp án : B Phương pháp giải :
Vì axit nitric và axit photphoric đều là axit nên đều mang tính chất hóa học chung của axit. Từ đó xác định các chất phản ứng được với cả 2 axit này. Lời giải chi tiết :
Axit nitric và axit photphoric cùng phản ứng với nhóm các chất: NaOH, K2O, NH3, Na2CO3 Các phương trình hóa học xảy ra: NaOH + HNO3 → NaNO3 + H2O K2O + 2HNO3 → 2KNO3 + H2O NH3 + HNO3 → NH4NO3 Na2CO3 + 2HNO3 → 2NaNO3 + CO2 + H2O H3PO4 + 3NaOH → Na3PO4 + 3H2O 2H3PO4 + 3K2O → 2K3PO4 + 3H2O 3NH3 + H3PO4 → (NH4)3PO4 3Na2CO3 + 2H3PO4 → 2Na3PO4 + 3CO2 + 3H2O
Câu 33 :
Cho các mẫu phân bón sau: KCl, Ca(H2PO4)2, NH4H2PO4 và NH4NO3. Dùng 1 hóa chất nào sau đây có thể phân biệt được các mẫu phân bón trên?
Đáp án : B Phương pháp giải :
Chọn hóa chất sao cho hiện tượng xảy ra giữa các chất khác nhau. Lời giải chi tiết :
Cho dung dịch Ca(OH)2 vào các dung dịch trên: - Nếu xuất hiện kết tủa trắng thì đó là Ca(H2PO4)2: Ca(H2PO4)2 + 2Ca(OH)2 → Ca3(PO4)2 + 4H2O - Nếu vừa xuất hiện chất khí có mùi khai và kết tủa trắng thì đó là NH4H2PO4 2NH4H2PO4 + 3Ca(OH)2 → Ca3(PO4)2 + 2NH3 + 6H2O - Nếu xuất hiện chất khí có mùi khai thì đó là NH4NO3: 2NH4NO3 + Ca(OH)2 → Ca(NO3)2 + 2NH3 + 2H2O
Câu 34 :
Cho các phát biểu sau: (a) Khoáng vật chính của photpho trong tự nhiên là pirit, apatit và photphoric. (b) Các số oxi hóa có thể có của photpho là -3; +3; +5; 0. (c) Tính chất hóa học điển hình của photpho là tính oxi hóa. (d) Trong phòng thí nghiệm, axit photphoric được điều chế bằng phản ứng giữa P2O5 và H2O. (e) Độ dinh dưỡng của phân lân được đánh giá bằng hàm lượng % của photpho có trong phân. Số phát biểu không đúng là:
Đáp án : C Phương pháp giải :
Dựa vào trạng thái tự nhiên, số oxi hóa và tính chất của photpho và hợp chất của photpho để xác định các phát biểu không đúng. Lời giải chi tiết :
(a) Phát biểu không đúng vì khoáng vật của photpho không phải là pirit. (b) Phát biểu đúng. (c) Phát biểu không đúng vì photpho có cả tính oxi hóa và tính khử. (d) Phát biểu không đúng vì trong phòng thí nghiệm, axit photphoric được điều chế bằng phản ứng P và HNO3 đặc. (e) Phát biểu không đúng vì độ dinh dưỡng của phân lân được đánh giá bằng tỉ lệ phần trăm khối lượng P2O5 tương ứng với lượng P có trong thành phần của nó. Vậy số phát biểu không đúng là 4.
|



















Danh sách bình luận