Trắc nghiệm Bài 1. Sự điện li - Hóa 11Đề bài
Câu 1 :
Câu nào sau đây đúng khi nói về sự điện li?
Câu 2 :
Chất nào sau đây là chất điện li?
Câu 3 :
Chất nào dưới đây không phân li ra ion khi hòa tan trong nước?
Câu 4 :
Saccarozơ là chất không điện li vì :
Câu 5 :
Chất nào sau đây không dẫn điện được?
Câu 6 :
Nước đóng vai trò gì trong quá trình điện li các chất tan trong nước?
Câu 7 :
Chất nào là chất điện li mạnh trong các chất sau?
Câu 8 :
Natri florua( NaF) trong trường hợp nào dưới đây không dẫn được điện?
Câu 9 :
Các dung dịch sau đây có cùng nồng độ 0,10 mol/l, dung dịch nào dẫn điện kém nhất?
Câu 10 :
Dung dịch nào dưới đây dẫn điện tốt nhất ?
Câu 11 :
Trong số những chất sau : H2S; FeCl3; Cl2; CO2; Ba(OH)2 có bao nhiêu chất khi tan trong nước là chất điện li?
Câu 12 :
Trong dung dịch axit axetic (bỏ qua sự phân li của H2O) có những phần tử nào?
Câu 13 :
Phương trình điện li viết đúng là
Câu 14 :
Cho 2 dung dịch axit là HNO3 và HClO có cùng nồng độ. Vậy sự so sánh nào sau đây là đúng?
Câu 15 :
Ion Na+.nH2O được hình thành khi :
Câu 16 :
Dãy chất nào sau đây, trong nước đều là chất điện li mạnh?
Câu 17 :
Dãy chất nào sau đây, trong nước đều là chất điện li yếu?
Câu 18 :
Hòa tan các chất sau vào nước để được các dung dịch riêng rẽ: NaCl, CaO, SO3, C6H12O6, CH3COOH, C2H5OH, Al2(SO4)3. Trong các dung dịch tạo ra có bao nhiêu dung dịch có khả năng dẫn điện?
Câu 19 :
Nồng độ mol của cation và anion trong dung dịch Ba(NO3)2 0,02 M là:
Câu 20 :
Có 4 dung dịch: Natri clorua, rượu etylic (C2H5OH), axit axetic (CH3COOH), kali sunfat đều có nồng độ 0,1 mol/l. Khả năng dẫn điện của các dung dịch đó tăng dần theo thứ tự nào trong các thứ tự sau:
Câu 21 :
Hòa tan 6 gam NaOH vào 44 gam nước được dung dịch A có khối lượng riêng bằng 1,12 g/ml. Cần lấy bao nhiêu ml A để có số mol ion OH– bằng 2.10–3 mol
Câu 22 :
Tính thể tích dung dịch Ba(OH)2 0,5M có chứa số mol ion OH– bằng số mol ion H+ có trong 200 ml dung dịch H2SO4 1M?
Câu 23 :
Chất nào sau đây dẫn được điện ?
Câu 24 :
Dung dịch chất điện li dẫn điện được là do trong dung dịch có chứa:
Câu 25 :
Câu nào sau đây đúng khi nói về sự điện li?
Câu 26 :
Chọn câu đúng:
Câu 27 :
Khi pha loãng dd axit axetic, không thay đổi nhiệt độ, thấy độ điện li của nó tăng. Ý kiến nào sau đây là đúng?
Câu 28 :
Các dung dịch sau đây có cùng nồng độ 0,10 mol/lít, dung dịch có độ dẫn điện nhỏ nhất là:
Câu 29 :
Dung dịch BaCl2 2M có nồng độ mol/l của anion là
Câu 30 :
Cho 500 ml dung dịch NaOH 0,2M; NaAlO2 0,1M vào 500 ml dung dịch Ba(OH)2 0,1M; Ba(AlO2)2 0,1M thu được dung dịch A. Nồng độ ion OH- và AlO2- trong dung dịch A lần lượt là
Câu 31 :
Hòa tan 6g NaOH vào 44g nước được dd A có khối lượng riêng bằng 1,12g/ml. Cần lấy bao nhiêu ml A để có số mol ion OH– bằng 2.10–3 mol
Câu 32 :
A là dung dịch HCl nồng độ 0,01M. Nồng độ của các ion trong dung dịch khi pha loãng A 100 lần là:
Câu 33 :
Cho các chất sau tan trong nước: Na2CO3, CH3COOCH3, HCOOH, MgCl2, HF. Số chất điện li mạnh và điện li yếu lần lượt là:
Câu 34 :
Cho các nhận xét sau: (1) Những chất điện li mạnh là các axit mạnh như HCl, HNO3, H2SO4…; các bazơ mạnh như NaOH, KOH, Ba(OH)2… và hầu hết các muối. (2) Dãy các chất H2S, H2CO3, H2SO3 là các chất điện li yếu. (3) Muối là hợp chất khi tan trong nước chỉ phân li ra cation kim loại và anion gốc axit. (4) Nước cất có khả năng dẫn điện tốt do nước có thể phân li ra ion H+ và OH-. Số nhận xét đúng là?
Câu 35 :
Tiến hành thí nghiệm như hình vẽ: Ban đầu trong cốc chứa nước vôi trong. Sục rất từ từ CO2 vào cốc cho tới dư. Hỏi độ sáng của bóng đèn thay đổi như thế nào?
Câu 36 :
Kết luận nào sau đây không đúng?
Câu 37 :
Dung dịch amoniac trong nước có chứa các ion nào sau đây (bỏ qua sự phân li của nước) :
Câu 38 :
Cho các nhận xét sau: (1) Những chất điện li mạnh là các axit mạnh như HCl, HNO3, H2SO4…; các bazơ mạnh như NaOH, KOH, Ba(OH)2… và hầu hết các muối. (2) Dãy các chất H2S, H2CO3, H2SO3 là các chất điện li yếu. (3) Muối là hợp chất khi tan trong nước chỉ phân li ra cation kim loại và anion gốc axit. (4) Nước cất có khả năng dẫn điện tốt do nước có thể phân li ra ion H+ và OH-. Số nhận xét đúng là?
Câu 39 :
Chất nào sau đây là chất điện li yếu? HCl, AgNO3, H2O, KOH. Chất điện li yếu là: Lời giải và đáp án
Câu 1 :
Câu nào sau đây đúng khi nói về sự điện li?
Đáp án : C Lời giải chi tiết :
Câu đúng là: Sự điện li là sự phân li một chất thành ion dương và ion âm khi chất đó tan trong nước hay ở trạng thái nóng chảy.
Câu 2 :
Chất nào sau đây là chất điện li?
Đáp án : C Phương pháp giải :
- Chất điện li: Những chất tan trong nước phân li thành các ion => axit, bazơ, muối là các chất điện li. Lời giải chi tiết :
Chỉ có axit, bazơ, muối là chất điện li
Câu 3 :
Chất nào dưới đây không phân li ra ion khi hòa tan trong nước?
Đáp án : D Phương pháp giải :
Chất không dẫn điện là chất khi hòa tan trong nước không điện li ra ion. Lời giải chi tiết :
Axit, bazơ, muối là chất điện li C6H12O6 là chất hữu cơ, không thuộc axit, bazơ, muối nên không phân li
Câu 4 :
Saccarozơ là chất không điện li vì :
Đáp án : D Lời giải chi tiết :
Saccarozơ là chất không điện li vì : + Phân tử saccarozơ không có tính dẫn điện. + Phân tử saccarozơ không có khả năng phân li thành ion trong dung dịch. + Phân tử saccrozơ không có khả năng hiđrat hoá với dung môi nước.
Câu 5 :
Chất nào sau đây không dẫn điện được?
Đáp án : A Phương pháp giải :
- Chất dẫn điện: các axit, bazơ, muối trong dung dịch hoặc trong trạng thái nóng chảy. - Chất không dẫn điện: các chất rắn khan (Vd: NaCl, NaOH khan) và các dung dịch ancol etylic, glucozơ, nước cất, … Lời giải chi tiết :
KCl rắn, khan không có sự phân li ra các ion trái dấu, không có sự chuyển động của các tiểu phân mang điện => không dẫn được điện
Câu 6 :
Nước đóng vai trò gì trong quá trình điện li các chất tan trong nước?
Đáp án : C Lời giải chi tiết :
Trong phân tử H2O, liên kết O−H là liên kết cộng hóa trị có cực, cặp e chung lệch về phía oxi => oxi tích điện âm, ở H tích điện dương. Khi quá trình điện li xảy ra tương tác giữa các phân tử nước có cực và các ion chuyển động không ngừng làm cho các chất điện li dễ dàng tan trong nước => nước đóng vai trò dung môi phân cực.
Câu 7 :
Chất nào là chất điện li mạnh trong các chất sau?
Đáp án : A Phương pháp giải :
Chất điện li mạnh: là chất khi tan trong nước, các phân tử hòa tan đều phân li ra ion. VD: các axit mạnh ( HCl, H2SO4, HNO3, HI, HBr, HClO4,….), các bazơ mạnh (KOH, NaOH, Ca(OH)2 , Ba(OH)2…) và hầu hết các muối. Lời giải chi tiết :
Ta thấy axit HNO3 là axit mạnh phân li hoàn toàn nên là chất điện li mạnh. Phương trình phân li:HNO3 → H+ + NO3− Còn lại HClO, CH3COOH, HF là các axit yếu nên là chất điện li yếu Phương trình phân li: HClO $\overset {} \leftrightarrows $ H+ + ClO− CH3COOH $\overset {} \leftrightarrows $ H+ + CH3COO− HF $\overset {} \leftrightarrows $ H+ + F−
Câu 8 :
Natri florua( NaF) trong trường hợp nào dưới đây không dẫn được điện?
Đáp án : C Phương pháp giải :
Trường hợp không dẫn điện được là khi không phân li ra ion Lời giải chi tiết :
Trường hợp không dẫn điện được là khi không phân li ra ion => ở trạng thái rắn, khan.
Câu 9 :
Các dung dịch sau đây có cùng nồng độ 0,10 mol/l, dung dịch nào dẫn điện kém nhất?
Đáp án : B Phương pháp giải :
Các chất điện li mạnh (chất có khả năng phân li hoàn toàn thành ion ở trong môi trường nước) thì dẫn điện tốt. Chất điện li yếu (chỉ phân li một phần trong nước) thì dẫn điện kém. Lời giải chi tiết :
Ta có tính axit: HF < HCl < HBr < HI \( \to\) Do đó khả năng phân li ra ion: HF < HCl < HBr < HI \( \to\) Tính dẫn điện của các dung dịch: HF < HCl < HBr < HI Vậy HF dẫn điện kém nhất
Câu 10 :
Dung dịch nào dưới đây dẫn điện tốt nhất ?
Đáp án : C Phương pháp giải :
xem lại lí thuyết sự điện li Lời giải chi tiết :
Cùng là muối NaCl điện li mạnh, dung dịch nào chứa nhiều ion nhất là dung dịch dẫn điện tốt nhất
Câu 11 :
Trong số những chất sau : H2S; FeCl3; Cl2; CO2; Ba(OH)2 có bao nhiêu chất khi tan trong nước là chất điện li?
Đáp án : C Phương pháp giải :
Chất điện li: Là những chất khi tan trong nước phân li ra ion. => axit, bazơ và muối là những chất điện li. Lời giải chi tiết :
Cl2; CO2 tan trong nước tạo thành HCl, HClO và H2CO3 là chất điện li nhưng không phải là Cl2 và CO2 ban đầu do đó không phải là chất điện li.
Câu 12 :
Trong dung dịch axit axetic (bỏ qua sự phân li của H2O) có những phần tử nào?
Đáp án : C Phương pháp giải :
- Viết phương trình điện ly - Xác định các phần tử thu được Lời giải chi tiết :
CH3COOH là chất điện li yếu: CH3COOH \( \rightleftarrows \) H+ + CH3COO- Do vậy phần tử thu được gồm: CH3COOH, H+, CH3COO-, H2O. Chú ý
CH3COOH là chất điện li yếu do đó khi tan trong nước chỉ có một số phân tử hòa tan phân li ra ion, phần còn lại vẫn tồn tại dưới dạng phân tử trong dung dịch.
Câu 13 :
Phương trình điện li viết đúng là
Đáp án : B Lời giải chi tiết :
A sửa $NaCl \to N{a^ + } + C{l^ - }$ C sai vì C2H5OH là chất không điện li D sửa $C{H_3}COOH\underset {} \leftrightarrows C{H_3}CO{O^ - } + {H^ + }$
Câu 14 :
Cho 2 dung dịch axit là HNO3 và HClO có cùng nồng độ. Vậy sự so sánh nào sau đây là đúng?
Đáp án : D Lời giải chi tiết :
Vì HNO3 phân li hoàn toàn, còn HClO phân li ít nên lượng ${[{H^ + }]_{HN{O_3}}} > {[{H^ + }]_{HClO}}$
Câu 15 :
Ion Na+.nH2O được hình thành khi :
Đáp án : A Phương pháp giải :
xem lại lí thuyết sự điện li Lời giải chi tiết :
A đúng vì khi hòa tan trong nước NaCl phân li ra Na+ và Cl-. Khi đó Na+ sẽ kéo lấy các phần tử tích điện âm của nước tạo thành Na+.nH2O
Câu 16 :
Dãy chất nào sau đây, trong nước đều là chất điện li mạnh?
Đáp án : D Phương pháp giải :
- Các chất điện li mạnh: + axit mạnh (HCl, H2SO4, HNO3,..) + bazơ mạnh (NaOH, KOH, Ba(OH)2, Ca(OH)2,...) + hầu hết các muối - Chất điện li yếu: + axit yếu (H2S, CH3COOH, HF,...) + bazơ yếu (Mg(OH)2,....) + muối HgCl2, Hg(CN)2,... Lời giải chi tiết :
A sai vì H2S là chất điện li yếu B vì H3PO4 là chất điện li yếu C sai vì CH3COOH là chất điện li yếu
Câu 17 :
Dãy chất nào sau đây, trong nước đều là chất điện li yếu?
Đáp án : C Phương pháp giải :
- Chất điện li mạnh: + Axit mạnh (HCl, H2SO4, HNO3,..) + Bazơ mạnh (NaOH, KOH, Ba(OH)2, Ca(OH)2,...) + Hầu hết các muối - Chất điện li yếu: + Axit yếu (H2S, CH3COOH, HF,...) + Bazơ yếu (Mg(OH)2,....) + Một số muối (HgCl2, Hg(CN)2,...) Lời giải chi tiết :
Đáp án A sai vì H2SO4 Là axit mạnh, nên là chất điện li mạnh Đáp án B sai vì Ba(OH)2 là bazo mạnh, nên là chất điện li mạnh Đáp án D sai vì Al2(SO4)3 là muối tan nên là chất điện li mạnh
Câu 18 :
Hòa tan các chất sau vào nước để được các dung dịch riêng rẽ: NaCl, CaO, SO3, C6H12O6, CH3COOH, C2H5OH, Al2(SO4)3. Trong các dung dịch tạo ra có bao nhiêu dung dịch có khả năng dẫn điện?
Đáp án : A Phương pháp giải :
Các dung dịch có khả năng dẫn điện là các dung dịch tan trong nước phân li ra các ion Lời giải chi tiết :
Các dung dịch có khả năng dẫn điện là các dung dịch tan trong nước phân li ra các ion Đó là : NaCl; CaO; SO3; CH3COOH; Al2(SO4)3 CaO và SO3 tan vào nước xảy ra phản ứng: CaO + H2O → Ca(OH)2 ; dd Ca(OH)2 thu được là bazo mạnh nên dẫn được điện SO3 + H2O → H2SO4; dd H2SO4 thu được là axit mạnh nên dẫn được điện
Câu 19 :
Nồng độ mol của cation và anion trong dung dịch Ba(NO3)2 0,02 M là:
Đáp án : B Phương pháp giải :
- Viết phương trình điện li Ba(NO3)2 $\xrightarrow{{}}B{a^{2 + }} + 2N{O_3}^ - $ - Tính nồng độ anion và cation Lời giải chi tiết :
Ba(NO3)2 $\xrightarrow{{}}B{a^{2 + }} + 2N{O_3}^ - $ $[B{a^{2 + }}] = 0,02M$; [NO3−]= 2. 0,02= 0,04M
Câu 20 :
Có 4 dung dịch: Natri clorua, rượu etylic (C2H5OH), axit axetic (CH3COOH), kali sunfat đều có nồng độ 0,1 mol/l. Khả năng dẫn điện của các dung dịch đó tăng dần theo thứ tự nào trong các thứ tự sau:
Đáp án : B Phương pháp giải :
- Xác định các chất điện li - Viết phương trình điện li, so sánh độ dẫn điện của các chất điện li Các dung dịch có cùng nồng độ, dung dịch nào phân li ra nhiều ion sẽ dẫn điện tốt hơn Lời giải chi tiết :
- C2H5OH tan trong nước nhưng không phân li ra ion=>không có khả năng dẫn điện. - CH3COOH là chất điện li yếu =>dẫn điện yếu hơn so với 2 muối Cùng nồng độ 0,1 mol/l thì: NaCl →Na+ +Cl− ; K2SO4 →2K+ + SO42− K2SO4 phân li ra nhiều ion hơn nên dẫn điện mạnh hơn NaCl. => C2H5OH < CH3COOH < NaCl < K2SO4
Câu 21 :
Hòa tan 6 gam NaOH vào 44 gam nước được dung dịch A có khối lượng riêng bằng 1,12 g/ml. Cần lấy bao nhiêu ml A để có số mol ion OH– bằng 2.10–3 mol
Đáp án : C Phương pháp giải :
- Tính CM + Tính mdd: ${m_{{\text{dd}}}} = {m_{NaOH}} + {m_{{H_2}O}}$ + Tính CM - Thể tích dd A cần lấy NaOH → Na+ + OH− Theo pt: nNaOH = nOH- => V = n: CM Lời giải chi tiết :
$ - {m_{{\text{dd}}}} = {m_{NaOH}} + {m_{{H_2}O}} = 6 + 44 = 50(g)$ $ = > {\text{ }}{V_{dd}} = {\text{ }}m{\text{ }}:{\text{ }}d{\text{ }} = {\text{ }}50{\text{ }}:{\text{ }}1,12{\text{ }} = \frac{{625}}{{14}}ml$ ${n_{NaOH}} = \frac{6}{{40}} = 0,15(mol)$ $ = > {C_{MNaOH}}{\text{ }} = {\text{ }}n{\text{ }}:{\text{ }}{V_{dd}} = \frac{{0,15}}{{\frac{{625}}{{14}}{{.10}^{ - 3}}}} = 3,36(M)$ - NaOH → Na+ + OH− Theo pt: nNaOH = nOH- = 2.10-3 (mol) => Thể tích dd A cần lấy là: V = n: CM = 2.10-3 : 3,36 = 6.10-4 lít = 0,6 ml
Câu 22 :
Tính thể tích dung dịch Ba(OH)2 0,5M có chứa số mol ion OH– bằng số mol ion H+ có trong 200 ml dung dịch H2SO4 1M?
Đáp án : C Phương pháp giải :
Dựa vào lý thuyết sự điện ly ta có: \(\begin{gathered} Lời giải chi tiết :
- nH2SO4 = 0,2(mol) H2SO4 → 2H+ + SO42- \({n_{O{H^ - }}} = {n_{{H^ + }}} = 2{n_{{H_2}S{O_4}}} = 2.0,2 = 0,4(mol)\) - Ba(OH)2 → Ba2+ + 2OH− \({n_{Ba{{(OH)}_2}}} = \dfrac{1}{2}{n_{O{H^ - }}} = \dfrac{1}{2}.0,4 = 0,2(mol)\) \( = > {V_{Ba{{(OH)}_2}}} = n:{C_M} = 0,2:0,5 = 0,4(l)\)
Câu 23 :
Chất nào sau đây dẫn được điện ?
Đáp án : A Lời giải chi tiết :
Glucozo là là chất hữu cơ nên không thể dẫn được điện NaOH và KCl đều ở trạng thái rắn, khan nên cũng không thể dẫn được điện
Câu 24 :
Dung dịch chất điện li dẫn điện được là do trong dung dịch có chứa:
Đáp án : B Lời giải chi tiết :
Các chất điện li khi hòa tan vào nước phân li ra các ion (+) và (-) chuyển động tự do nên dẫn điện được.
Câu 25 :
Câu nào sau đây đúng khi nói về sự điện li?
Đáp án : C Lời giải chi tiết :
Sự điện li là sự phân li một chất thành ion khi tan trong nước hay ở trạng thái nóng chảy.
Câu 26 :
Chọn câu đúng:
Đáp án : D Lời giải chi tiết :
A sai vì hợp chất cộng hóa trị cũng có thể bị phân ly khi hòa tan trong nước, ví dụ như HCl,... B sai vì độ điện ly phụ thuộc vào nhiệt độ, nồng độ dung dịch, bản chất của chất tan và dung môi. C sai vì chất điện ly yếu phân ly không hoàn toàn thành ion nên độ điện ly luôn nhỏ hơn 1 và lớn hơn 0. D đúng.
Câu 27 :
Khi pha loãng dd axit axetic, không thay đổi nhiệt độ, thấy độ điện li của nó tăng. Ý kiến nào sau đây là đúng?
Đáp án : C Lời giải chi tiết :
Ka là hằng số phân ly axit. Giá trị Ka chỉ phụ thuộc vào bản chất axit và nhiệt độ. Nhiệt độ không đổi và vẫn axit đó nên Ka không thay đổi.
Câu 28 :
Các dung dịch sau đây có cùng nồng độ 0,10 mol/lít, dung dịch có độ dẫn điện nhỏ nhất là:
Đáp án : C Phương pháp giải :
Những chất có nồng độ ion càng cao dẫn điện càng tốt. Lời giải chi tiết :
CH3COOH là chất điện li yếu. KCl, CH3COOK, HCl là chất điện ly mạnh phân ly hoàn toàn.
Câu 29 :
Dung dịch BaCl2 2M có nồng độ mol/l của anion là
Đáp án : A Phương pháp giải :
Bảo toàn nguyên tố Lời giải chi tiết :
Theo định luật bảo toàn nguyên tố: \({n_{C{l^ - }}} = 2{n_{BaC{l_2}}}\) Mặt khác BaCl2 là chất điện li mạnh, phân li hoàn toàn thành các ion => [Cl-] = 2.CM dd BaCl2 = 4M
Câu 30 :
Cho 500 ml dung dịch NaOH 0,2M; NaAlO2 0,1M vào 500 ml dung dịch Ba(OH)2 0,1M; Ba(AlO2)2 0,1M thu được dung dịch A. Nồng độ ion OH- và AlO2- trong dung dịch A lần lượt là
Đáp án : A Phương pháp giải :
Tính được số mol NaOH, NaAlO2, Ba(OH)2, Ba(AlO2)2 Các chất đều là chất điện li mạnh nên điện li hoàn toàn thành ion Suy ra số mol các ion OH- và AlO2- Tính nồng độ của các ion dựa vào công thức: CM = n : V Lời giải chi tiết :
nNaOH = 0,5.0,2 = 0,1 mol; nNaAlO2 = 0,5.0,1 = 0,05 mol nBa(OH)2 = 0,5.0,1 = 0,05 mol; nBa(AlO2)2 = 0,5.0,1 = 0,05 mol. Các chất đều là chất điện li mạnh nên điện li hoàn toàn thành ion. Vậy trong dung dịch A: nOH- = nNaOH + 2nBa(OH)2 = 0,1 + 2.0,05 = 0,2 mol ⟹ [OH-] = 0,2/1 = 0,2M nAlO2- = nNaAlO2 + 2nBa(AlO2)2 = 0,05 + 2.0,05 = 0,15 mol ⟹ [AlO2-] = 0,15/1 = 0,15M
Câu 31 :
Hòa tan 6g NaOH vào 44g nước được dd A có khối lượng riêng bằng 1,12g/ml. Cần lấy bao nhiêu ml A để có số mol ion OH– bằng 2.10–3 mol
Đáp án : C Lời giải chi tiết :
\({m_{{\rm{dd}}}} = {m_{NaOH}} + {m_{{H_2}O}} = 6 + 44 = 50(g)\) \( \to {V_{dd}} = m:d = 50:1,12 = \frac{{625}}{{14}}ml\) \({n_{NaOH}} = \frac{6}{{40}} = 0,15(mol)\) \( \to {C_{MNaOH}} = n:{V_{dd}} = \frac{{0,15}}{{\frac{{625}}{{14}}{{.10}^{ - 3}}}} = 3,36(M)\) NaOH → Na+ + OH− Theo pt: nNaOH = nOH- = 2.10-3 (mol) ⟹ Thể tích dd A cần lấy là: V = n : CM = 2.10-3 : 3,36 = 6.10-4 (l) = 0,6 (ml)
Câu 32 :
A là dung dịch HCl nồng độ 0,01M. Nồng độ của các ion trong dung dịch khi pha loãng A 100 lần là:
Đáp án : B Lời giải chi tiết :
Khi pha loãng dung dịch 100 lần thì nồng độ các ion trong dung dịch cũng giảm 100 lần HCl→H+ + Cl− Trước khi pha loãng: $${\rm{[}}{{\rm{H}}^ + }{\rm{]}} = {\rm{[C}}{{\rm{l}}^ - }{\rm{]}} = 0,01M$$ Sau khi pha loãng: $${\rm{[}}{{\rm{H}}^ + }{\rm{]}} = {\rm{[C}}{{\rm{l}}^ - }{\rm{]}} = 1,{0.10^{ - 4}}M$$
Câu 33 :
Cho các chất sau tan trong nước: Na2CO3, CH3COOCH3, HCOOH, MgCl2, HF. Số chất điện li mạnh và điện li yếu lần lượt là:
Đáp án : A Phương pháp giải :
Dựa vào khái niệm chất điện li để xác định chất điện li mạnh hay chất điện li yếu. Lời giải chi tiết :
- Chất điện li mạnh: Na2CO3 → 2Na+ + CO32- MgCl2 → Mg2+ + 2Cl- - Chất điện li yếu: HCOOH ⇄ HCOO- + H+ HF ⇄ H+ + F- - Chất không điện li: CH3COOCH3
Câu 34 :
Cho các nhận xét sau: (1) Những chất điện li mạnh là các axit mạnh như HCl, HNO3, H2SO4…; các bazơ mạnh như NaOH, KOH, Ba(OH)2… và hầu hết các muối. (2) Dãy các chất H2S, H2CO3, H2SO3 là các chất điện li yếu. (3) Muối là hợp chất khi tan trong nước chỉ phân li ra cation kim loại và anion gốc axit. (4) Nước cất có khả năng dẫn điện tốt do nước có thể phân li ra ion H+ và OH-. Số nhận xét đúng là?
Đáp án : C Lời giải chi tiết :
(1) đúng (2) đúng (3) sai. VD: (NH4)2CO3 là muối điện li ra ion NH4+ không phải là ion kim loại. (4) sai vì nước cất không dẫn điện → Vậy có 2 nhận xét đúng
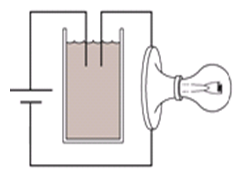
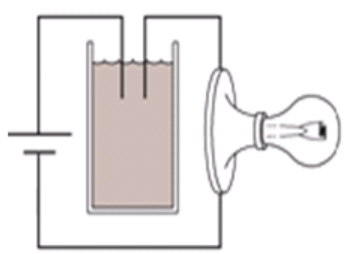
Câu 35 :
Tiến hành thí nghiệm như hình vẽ: Ban đầu trong cốc chứa nước vôi trong. Sục rất từ từ CO2 vào cốc cho tới dư. Hỏi độ sáng của bóng đèn thay đổi như thế nào?
Đáp án : A Lời giải chi tiết :
+ Khi CO2 vào thì ban đầu nước vôi trong dư so với CO2 nên ion Ca2+ dần đến hết vì bị kết tủa thành CaCO3 ⟹ lượng ion trong dung dịch giảm dần về 0 + Khi CO2 dư thì kết tủa lại bị hòa tan, tạo thành ion Ca2+ và HCO3- ⟹ lượng ion tăng dần Vậy đèn có độ sáng giảm dần đến tắt rồi lại sáng tăng dần. Đáp án A
Câu 36 :
Kết luận nào sau đây không đúng?
Đáp án : D Lời giải chi tiết :
A, B, C đúng D sai vì chất điện li mạnh là chất khi tan trong nước phân li hoàn toàn thành ion
Câu 37 :
Dung dịch amoniac trong nước có chứa các ion nào sau đây (bỏ qua sự phân li của nước) :
Đáp án : D Lời giải chi tiết :
NH4OH → NH4+ + OH-
Câu 38 :
Cho các nhận xét sau: (1) Những chất điện li mạnh là các axit mạnh như HCl, HNO3, H2SO4…; các bazơ mạnh như NaOH, KOH, Ba(OH)2… và hầu hết các muối. (2) Dãy các chất H2S, H2CO3, H2SO3 là các chất điện li yếu. (3) Muối là hợp chất khi tan trong nước chỉ phân li ra cation kim loại và anion gốc axit. (4) Nước cất có khả năng dẫn điện tốt do nước có thể phân li ra ion H+ và OH-. Số nhận xét đúng là?
Đáp án : C Phương pháp giải :
Dựa vào lý thuyết về sự điện li. Lời giải chi tiết :
(1) đúng. (2) đúng. (3) sai. VD: (NH4)2CO3 là muối điện li ra ion NH4+ không phải là ion kim loại. (4) sai, vì nước cất không dẫn điện → Vậy có 2 nhận xét đúng.
Câu 39 :
Chất nào sau đây là chất điện li yếu? HCl, AgNO3, H2O, KOH. Chất điện li yếu là: Đáp án
Chất điện li yếu là: Phương pháp giải :
- Chất điện li mạnh là khi chất tan trong nước thì phần tan phân li hoàn toàn toàn ra các ion. - Chất điện li mạnh gồm có: + Axit mạnh + Bazơ mạnh + Hầu hết các muối Lời giải chi tiết :
PT điện li của các chất là: HCl → H+ + Cl-. AgNO3 → Ag+ + NO3-. H2O ⇄ H+ + OH-. KOH → K+ + OH-. Vậy chất điện li yếu là H2O
|



















Danh sách bình luận