Trắc nghiệm Bài 8. Amoniac - Hóa 11Đề bài
Câu 1 :
Tính bazơ của NH3 là do
Câu 2 :
Tính chất hóa học của NH3 là
Câu 3 :
Cho quỳ tím vào dung dịch NH3 1M, quỳ tím chuyển sang màu gì ?
Câu 4 :
NH3 thể hiện tính bazơ trong phản ứng
Câu 5 :
Khí NH3 có lẫn hơi nước. Hóa chất dùng để làm khô khí NH3 là
Câu 6 :
Cặp muối nào tác dụng với dung dịch NH3 dư đều thu được kết tủa ?
Câu 7 :
Cho phản ứng tổng hợp NH3 trong công nghiệp: N2 + 3H2 $\overset{{{t}^{0}},xt}{\leftrightarrows}$ 2NH3 ∆H = – 92 KJ Hiệu suất của phản ứng giữa N2 và H2 tạo thành NH3 tăng nếu
Câu 8 :
Cho dung dịch NH3 dư vào dung dịch chứa FeCl3, CuCl2, AlCl3, ZnSO4, MgCl2 thu được kết tủa Y. Thành phần của Y gồm
Câu 9 :
Nhận biết dung dịch AlCl3 và ZnCl2 người ta dùng hóa chất nào sau đây ?
Câu 10 :
Trong phòng thí nghiệm, khí NH3 được điều chế bằng cách
Câu 11 :
Phản ứng của NH3 với Cl2 tạo ra “khói trắng” . Chất này có công thức phân tử là :
Câu 12 :
Cho phương trình hoá học của phản ứng tổng hợp amoniac: N2 (k) + 3H2 (k) $\overset{{{t}^{0}},xt}{\leftrightarrows}$ 2NH3 (k) Khi tăng nồng độ của hiđro lên 2 lần, tốc độ phản ứng thuận
Câu 13 :
Điều chế NH3 từ hỗn hợp gồm N2 và H2 (tỉ lệ 1 : 3). Tỉ khối hỗn hợp trước so với hỗn hợp sau phản ứng là 0,6. Hiệu suất phản ứng là
Câu 14 :
Trong một bình kín chứa 10 lít nitơ và 10 lít hiđro ở nhiệt độ 0oC và 10 atm. Sau phản ứng tổng hợp NH3, lại đưa bình về 0oC. Biết rằng có 60% hiđro tham gia phản ứng, áp suất trong bình sau phản ứng là :
Câu 15 :
Hỗn hợp X gồm N2 và H2 có ${{\overline{M}}_{X}}=12,4.$ Dẫn X đi qua bình đựng bột Fe rồi nung nóng biết rằng hiệu suất tổng hợp NH3 đạt 40% thì thu được hỗn hợp Y. ${{\overline{M}}_{Y}}$ có giá trị là
Câu 16 :
Cho hỗn hợp gồm N2, H2 và NH3 có tỉ khối so với hiđro là 8. Dẫn hỗn hợp đi qua H2SO4 đặc, dư thì thể tích khí còn lại một nửa. Thành phần phần trăm (%) theo thể tích của mỗi khí trong hỗn hợp lần lượt là :
Câu 17 :
Sau quá trình tổng hợp NH3 từ H2 và N2 $({{n}_{{{H}_{2}}}}:{{n}_{{{N}_{2}}}}=3:1)$, áp suất trong bình giảm đi 10% so với áp suất lúc đầu. Biết nhiệt độ của phản ứng giữ không đổi trước và sau phản ứng. Phần trăm theo thể tích của N2, H2, NH3 trong hỗn hợp khí thu được sau phản ứng lần lượt là :
Câu 18 :
Hỗn hợp khí X gồm N2 và H2 có tỉ khối so với He bằng 1,8. Đun nóng X một thời gian trong bình kín (bột Fe làm xúc tác), thu được hỗn hợp khí Y có tỉ khối so với He bằng 2. Hiệu suất của phản ứng tổng hợp NH3 là
Câu 19 :
Một bình kín có thể tích là 0,5 lít chứa 0,5 mol H2 và 0,5 mol N2, ở nhiệt độ (toC). Khi ở trạng thái cân bằng có 0,2 mol NH3 tạo thành. Hằng số cân bằng KC của phản ứng tổng hợp NH3 là :
Câu 20 :
Dẫn 2,24 lít NH3 (đktc) đi qua ống đựng 32 gam CuO nung nóng thu được chất rắn A và khí B. Ngâm chất rắn A trong dung dịch HCl 2M dư. Tính thể tích dung dịch axit đã tham gia phản ứng ? Coi hiệu suất quá trình phản ứng là 100%.
Câu 21 :
Cho NH3 dư vào 100ml dung dịch gồm CuSO4 1M ; ZnCl2 0,5M, AgNO3 1M và AlCl3 1M. Khối lượng kết tủa sau phản ứng là
Câu 22 :
Dung dịch X chứa các ion sau: Al3+, Cu2+, SO42- và NO3-. Để kết tủa hết ion SO42- có trong 250 ml dung dịch X cần 50 ml dung dịch BaCl2 1M. Cho 500 ml dung dịch X tác dụng với dung dịch NH3 dư thì được 7,8 gam kết tủa. Cô cạn 500 ml dung dịch X được 37,3 gam hỗn hợp muối khan. Nồng độ mol/l của NO3- là :
Câu 23 :
Tìm phát biểu không phù hợp với phản ứng này \({N_2} + 3{H_2} \rightleftarrows 2N{H_3}\,\,\,\,\,\,\,\,\,\,\,\,\,\Delta H = - 92kJ\)
Câu 24 :
Đốt cháy hổn hợp gồm 6,72 lít khí Oxi và 7 lít khí amoniac (đo ở cùng điều kiện nhiệt độ và áp suất). Sau phản ứng thu được nhóm các chất là:
Câu 25 :
Trong phòng thí nghiệm, để thử tính chất của khí X người ta đã thực hiện thí nghiệm như hình vẽ dưới đây:
Khí X là:
Câu 26 :
Thành phần của dung dịch NH3 gồm:
Câu 27 :
Phát biểu nào dưới đây không đúng:
Câu 28 :
Một học sinh đã điều chế và thu khí NH3 theo sơ đồ sau đây, nhưng kết quả thí nghiệm không thành công. Lí do chính là:
Câu 29 :
Phản ứng nào dưới đây NH3 không đóng vai trò chất khử?
Câu 30 :
Cho phản ứng: N2 (k) + 3H2 (k) \( \rightleftarrows \) 2NH3 (k). Nếu ở trạng thái cân bằng nồng độ NH3 là 0,30 mol/l, N2 là 0,05 mol/l và của H2 là 0,10 mol/l thì hằng số cân bằn của phản ứng là
Câu 31 :
NH3 có thể phản ứng được với tất cả các chất trong nhóm nào sau đây (các điều kiện coi như có đủ)
Câu 32 :
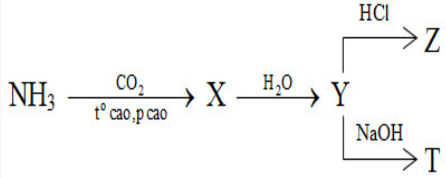
Cho sơ đồ phản ứng sau:
X, Y, Z, T tương ứng là
Câu 33 :
Trong phân tử NH3 chứa liên kết:
Câu 34 :
Trong công nghiệp, người ta điều chế khí amoniac từ
Câu 35 :
Nung nóng bình kín chứa a mol hỗn hợp NH3 và O2 ( có xúc tác Pt) để chuyển toàn bộ NH3 thành NO. Làm nguội và thêm nước vào bình, lắc đều thu được 1 lít dung dịch HNO3 có pH = 1, còn lại 0,25a mol khí O2. Biết các phản ứng xảy ra hoàn toàn. Giá trị của a là
Câu 36 :
Cho x mol N2 và 12 mol H2 vào bình kín. Tại thời điểm cân bằng thấy có 6 mol NH3 tạo thành. Biết hiệu suất chung của phản ứng là 75%. Tìm x?
Câu 37 :
Một bình kín chứa 4 mol khí N2 và 10 mol khí H2 có áp suất là 200atm. Khi đạt trạng thái cân bằng thì áp suất trong bình là 180 atm, nhiệt độ trong bình được giữ không đổi. Tính hiệu suất của phản ứng tổng hợp NH3 trên.
Câu 38 :
Từ 34 tấn NH3 sản xuất 160 tấn HNO3 63%. Hiệu suất của phản ứng điều chế HNO3 là:
Câu 39 :
Cho 6 mol N2 và 20 mol H2 vào bình kín. Tại thời điểm cân bằng thu được 18 mol hỗn hợp khí. Hiệu suất của phản ứng tổng hợp NH3 trên.
Câu 40 :
Cho hỗn hợp N2 và H2 vào bình phản ứng có nhiệt độ không đổi. Sau thời gian phản ứng, áp suất khí trong bình giảm 5% so với áp suất ban đầu. Biết ti lệ số mol của nitơ đã phản ứng là 10%. Thành phần phần trăm về số mol của N2 và H2 trong hỗn hợp đầu?
Câu 41 :
Cho các oxit kim loại: CuO, FeO, Al2O3, Na2O, PbO, CaO. Số oxit NH3 có thể khử được:
Câu 42 :
Cho NH3 dư lần lượt vào các dung dịch: CuSO4, AgNO3, Zn( NO3 )2, AlCl3, FeSO4, NaBr, MgCl2. Có bao nhiêu dung dịch tạo phức với NH3 ?
Câu 43 :
Cho 6,72 lít khí N2 tác dụng với 13,44 lít khí H2 với điều kiện thích hợp thu được V lít hỗn hợp khí (biết H% = 20%). Biết các khí được đo ở điều kiện tiêu chuẩn. Giá trị V là
Câu 44 :
Cho 17,92 lít hỗn hợp N2, H2 nung trong điều kiện thích hợp sau một thời gian thu được 13,888 lít hỗn hợp khí với hiệu suất 30% tính theo N2. Biết các khí đều được đo ở điều kiện tiêu chuẩn. Thể tích N2 trong hỗn hợp ban đầu là
Câu 45 :
Nung hỗn hợp X gồm N2 và H2 (biết tỉ khối của X so với H2 bằng 6,2). Sau phản ứng thu được hỗn hợp Y trong đó amoniac chiếm 25% thể tích. Hiệu suất phản ứng là
Trước đây, trong thời kỳ Chiến tranh Thế giới thứ I, NH3 lỏng từng được thiết kế sử dụng làm thuốc phóng tên lửa. Hiện nay, NH3 được sử dụng nhiều nhất trong sản xuất phân bón và một số hóa chất cơ bản. Trong đó lượng sử dụng cho sản xuất phân bón (cả dạng rắn và lỏng) chiếm đến trên 80% sản lượng NH3 toàn thế giới và tương đương với khoảng 1% tổng công suất phát năng lượng của thế giới. Bên cạnh đó NH3 vẫn được sử dụng trong công nghiệp đông lạnh (sản xuất nước đá, bảo quản thực phẩm,…), trong các phòng thí nghiệm, trong tổng hợp hữu cơ, hóa dược, y tế và cho các mục đích dân dụng khác. Ngoài ra trong công nghệ môi trường, NH3 còn được dùng để loại bỏ khí SO2 trong khí thải của các nhà máy có quá trình đốt nhiên liệu hóa thạch (than, dầu) và sản phẩm amoni sunfat thu hồi của các quá trình này có thể được sử dụng làm phân bón. Vì những lí do trên mà trong công nghiệp, có những mối quan tâm nhất định đến quy trình tổng hợp NH3 sao cho đạt hiệu suất cao nhất và hạn chế chi phí một cách tối đa. Vấn đề này có liên quan đến tính hiệu quả và kinh tế của phương pháp Haber tổng hợp amoniac, được biểu diễn bằng phương trình: N2 (k) + 3H2 (k) ⇄ 2NH3 (k) ; ΔH = -92 kJ.mol-1 Câu 46
Trong công nghiệp thường sử dụng hai biện pháp để làm tăng hiệu suất của phản ứng tổng hợp amoniac là
Câu 47
Thực hiện phản ứng tổng hợp amoniac trong bình kín ở nhiệt độ xác định. Khi giảm nồng độ N2 đi 2 lần và tăng nồng độ của H2 lên 2 lần thì tốc độc của phản ứng thuận thay đổi như thế nào so với lúc chưa thay đổi nồng độ?
Câu 48
Nung hỗn hợp khí A gồm 0,1 mol N2; 0,45 mol H2 trong điều kiện thích hợp thu được hỗn hợp B có dA/B = 10/11. Hiệu suất phản ứng là
Lời giải và đáp án
Câu 1 :
Tính bazơ của NH3 là do
Đáp án : A Lời giải chi tiết :
- Tính bazơ của NH3 là do trên nguyên tử N còn cặp e tự do không tham gia liên kết. - Theo thuyết bronsted , bazo là chất nhận proton - Theo thuyết areniut, bazo là chất tan trong nước phân li ra ion OH- H2O + NH3 ⇌ OH– + NH4+
Câu 2 :
Tính chất hóa học của NH3 là
Đáp án : C Lời giải chi tiết :
Tính chất hóa học của NH3 là vừa có tính khử, vừa có tính bazơ
Câu 3 :
Cho quỳ tím vào dung dịch NH3 1M, quỳ tím chuyển sang màu gì ?
Đáp án : A Lời giải chi tiết :
Vì dung dịch NH3 có tính bazơ => làm quỳ chuyển xanh
Câu 4 :
NH3 thể hiện tính bazơ trong phản ứng
Đáp án : A Lời giải chi tiết :
NH3 thể hiện tính bazơ trong phản ứng: 2NH3 + H2SO4 → (NH4)2SO4.
Câu 5 :
Khí NH3 có lẫn hơi nước. Hóa chất dùng để làm khô khí NH3 là
Đáp án : C Lời giải chi tiết :
Hóa chất dùng để làm khô khí NH3 là chất không tác dụng được với NH3 => chất đó là CaO A loại vì P2O5 khi tác dụng với nước thu được H3PO4 phản ứng được với NH3 B loại vì H2SO4 phản ứng được với NH3
Câu 6 :
Cặp muối nào tác dụng với dung dịch NH3 dư đều thu được kết tủa ?
Đáp án : B Lời giải chi tiết :
Cặp muối khi tác dụng với dung dịch NH3 dư đều tạo kết tủa là AlCl3 và FeCl3 A sai vì Na2SO4 không tạo kết tủa với NH3 C sai vì CuSO4 tạo kết tủa, sau đó kết tủa tan khi NH3 dư D sai vì AgNO3, Zn(NO3)2 đều tạo kết tủa, sau đó kết tủa tan khi NH3 dư
Câu 7 :
Cho phản ứng tổng hợp NH3 trong công nghiệp: N2 + 3H2 $\overset{{{t}^{0}},xt}{\leftrightarrows}$ 2NH3 ∆H = – 92 KJ Hiệu suất của phản ứng giữa N2 và H2 tạo thành NH3 tăng nếu
Đáp án : D Phương pháp giải :
*Đối với nhiệt độ: Dựa vào ∆H ⟹ Phản ứng thuận là thu hay tỏa nhiệt ⟹ phương pháp để tăng hiệu suất phản ứng tổng hợp NH3. Mẹo: Trong trường hợp tăng/giảm nhiệt độ ta ghi nhớ câu: "tăng - thu; giảm - tỏa" tức là: + Tăng nhiệt độ thì cân bằng chuyển dịch theo chiều thu nhiệt. + Giảm nhiệt độ thì cân bằng chuyển dịch theo chiều tỏa nhiệt. *Đối với áp suất: - Xét tổng mol chất khí ở vế trái và vế phải ⟹ phương pháp để tăng hiệu suất phản ứng tổng hợp NH3. - Ảnh hưởng của áp suất đến sự chuyển dịch cân bằng: + Tăng áp suất ⟹ cân bằng chuyển dịch theo chiều làm giảm số mol phân tử khí. + Giảm áp suất ⟹ cân bằng chuyển dịch theo chiều làm tăng số mol phân tử khí. Lời giải chi tiết :
Theo nguyên lí Lơ-sa-tơ-li-ê: Một phản ứng thuận nghịch đang ở trạng thái cân bằng khi chịu một tác động từ bên ngoài như biến đổi nồng độ, áp suất, nhiệt độ thì cân bằng sẽ chuyển dịch theo chiều làm giảm tác động bên ngoài đó. Theo phương trình, chiều thuận làm giảm áp suất và tăng nhiệt độ (∆H < 0) là phản ứng tỏa nhiệt Khi tăng áp suất => cân bằng chuyển dịch theo chiều làm giảm áp suất => chiều thuận Khi giảm nhiệt độ => cân bằng chuyển dịch theo chiều làm tăng nhiệt độ => chiều thuận
Câu 8 :
Cho dung dịch NH3 dư vào dung dịch chứa FeCl3, CuCl2, AlCl3, ZnSO4, MgCl2 thu được kết tủa Y. Thành phần của Y gồm
Đáp án : B Lời giải chi tiết :
NH3 dư có Cu(OH)2 và Zn(OH)2 tạo phức tan => kết tủa thu được gồm Fe(OH)3, Al(OH)3, Mg(OH)2.
Câu 9 :
Nhận biết dung dịch AlCl3 và ZnCl2 người ta dùng hóa chất nào sau đây ?
Đáp án : C Lời giải chi tiết :
Để nhận biết AlCl3 và ZnCl2, người ta dùng dung dịch NH3 dư AlCl3 tạo kết tủa và không tan trong NH3 dư còn ZnCl2 tạo kết tủa sau đó tan.
Câu 10 :
Trong phòng thí nghiệm, khí NH3 được điều chế bằng cách
Đáp án : D Lời giải chi tiết :
Trong phòng thí nghiệm, khí NH3 được điều chế bằng cách cho muối amoni tác dụng với kiềm.
Câu 11 :
Phản ứng của NH3 với Cl2 tạo ra “khói trắng” . Chất này có công thức phân tử là :
Đáp án : D Lời giải chi tiết :
2NH3 + 3Cl2 → N2 + 6HCl NH3 khí + HClkhí → NH4Cl (khói trắng)
Câu 12 :
Cho phương trình hoá học của phản ứng tổng hợp amoniac: N2 (k) + 3H2 (k) $\overset{{{t}^{0}},xt}{\leftrightarrows}$ 2NH3 (k) Khi tăng nồng độ của hiđro lên 2 lần, tốc độ phản ứng thuận
Đáp án : A Lời giải chi tiết :
tốc độ phản ứng thuận : v = [N2].[H2]3 Khi tăng nồng độ của hiđro lên 2 lần => v’ = [N2].(2.[H2])3 = 8.[N2].[H2]3 = 8v => tốc độ phản ứng tăng lên 8 lần
Câu 13 :
Điều chế NH3 từ hỗn hợp gồm N2 và H2 (tỉ lệ 1 : 3). Tỉ khối hỗn hợp trước so với hỗn hợp sau phản ứng là 0,6. Hiệu suất phản ứng là
Đáp án : D Phương pháp giải :
Bảo toàn khối lượng: mtrước = msau => Mt.nt = Ms.ns\(\,\, = > \,\,\frac{{{M_t}}}{{{M_s}}} = \frac{{{n_s}}}{{{n_t}}}\,\,\) Lời giải chi tiết :
N2 + 3H2 \( \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} \) 2NH3 ban đầu: 1 mol 3 mol phản ứng: a → 3a → 2a dư: 1 – a 3 – 3a 2a => nhỗn hợp sau phản ứng = 1 – a + 3 – 3a + 2a = 4 – 2a nhỗn hợp trước phản ứng = 1 + 3 = 4 mol Bảo toàn khối lượng: mtrước = msau => Mt.nt = Ms.ns \(\,\, = > \,\,\frac{{{M_t}}}{{{M_s}}} = \frac{{{n_s}}}{{{n_t}}}\,\, = > \,\,\frac{{4 - 2a}}{4} = 0,6\,\, = > \,\,a = 0,8\) $=>H = \frac{{0,8}}{1}.100\% = 80\% $
Câu 14 :
Trong một bình kín chứa 10 lít nitơ và 10 lít hiđro ở nhiệt độ 0oC và 10 atm. Sau phản ứng tổng hợp NH3, lại đưa bình về 0oC. Biết rằng có 60% hiđro tham gia phản ứng, áp suất trong bình sau phản ứng là :
Đáp án : B Phương pháp giải :
+) Xét hiệu suất tính theo chất phản ứng thiếu +) Tính thể tích các chất phản ứng => thể tích các chất sau phản ứng +) Vì trước và sau phản ứng nhiệt độ không thay đổi nên : \(\frac{{{V_1}}}{{{V_2}}} = \frac{{{n_1}}}{{{n_2}}} = \frac{{{p_1}}}{{p{}_2}}\) Lời giải chi tiết :
Theo phương trình phản ứng tổng hợp NH3 ta thấy N2 và H2 phản ứng theo tỉ lệ là \(\frac{{{n_{{H_2}}}}}{{{n_{{N_2}}}}} = \frac{3}{1}\). Theo đề bài ta thấy \(\frac{{{n_{{H_2}}}}}{{{n_{{N_2}}}}} = \frac{{{V_{{H_2}}}}}{{{V_{{N_2}}}}} = \frac{1}{1}\). Vậy H2 thiếu nên hiệu suất phản ứng tính theo H2. Thể tích H2 phản ứng là 10.60% = 6 lít VH2 phản ứng = 6 lít => VN2 phản ứng = 2 lít N2 + 3H2 \( \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} \) 2NH3 ban đầu: 10 10 phản ứng: 2 → 6 → 4 dư: 8 4 4 => Vsau = 8 + 4 + 4 = 16 Vì trước và sau phản ứng nhiệt độ không thay đổi nên : \(\frac{{{V_1}}}{{{V_2}}} = \frac{{{n_1}}}{{{n_2}}} = \frac{{{p_1}}}{{p{}_2}} \Rightarrow \frac{{20}}{{16}} = \frac{{10}}{{{p_2}}} \Rightarrow {p_2} = 8\,\,atm.\) Chú ý
Độ giảm thể tích của hỗn hợp sau phản ứng bằng 1 nửa so với thể tích hỗn hợp phản ứng.
Câu 15 :
Hỗn hợp X gồm N2 và H2 có ${{\overline{M}}_{X}}=12,4.$ Dẫn X đi qua bình đựng bột Fe rồi nung nóng biết rằng hiệu suất tổng hợp NH3 đạt 40% thì thu được hỗn hợp Y. ${{\overline{M}}_{Y}}$ có giá trị là
Đáp án : C Phương pháp giải :
+) Áp dụng sơ đồ đường ché => tỉ lệ N2 : H2 => hiệu suất phản ứng tính theo chất thiếu +) Chọn số mol N2 và H2 => nH2 phản ứng => nN2 phản ứng và nNH3 sinh ra +) Tính nkhí giảm => nY = nX – ngiảm +) Theo định luật bảo toàn khối lượng ta có : \({m_Y} = {m_X} = {m_{{N_2}}} + {m_{{H_2}}}\)=> \({\overline M _Y} = \frac{{{m_Y}}}{{{n_Y}}}\) Lời giải chi tiết :
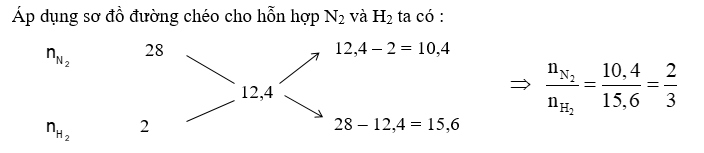 Với tỉ lệ trên suy ra H2 thiếu, hiệu suất phản ứng tính theo H2. Trong hỗn hợp X ta chọn nN2 = 2 mol và nH2 = 3 mol => nH2 phản ứng = 3.40% = 1,2 mol => nN2 phản ứng = 0,4 mol, nNH3 sinh ra = 0,8 mol nkhí giảm = (1,2 + 0,4) – 0,8 = 0,8 mol => \({n_Y} = {n_X} - 0,8 = 2 + 3 - 0,8 = 4,2\,\,mol\) Theo định luật bảo toàn khối lượng ta có : \({m_Y} = {m_X} = {m_{{N_2}}} + {m_{{H_2}}} = 2.28 + 3.2 = 62\,\,gam\) Vậy \({\overline M _Y} = \frac{{{m_Y}}}{{{n_Y}}} = \frac{{62}}{{4,2}} = 14,76\)
Câu 16 :
Cho hỗn hợp gồm N2, H2 và NH3 có tỉ khối so với hiđro là 8. Dẫn hỗn hợp đi qua H2SO4 đặc, dư thì thể tích khí còn lại một nửa. Thành phần phần trăm (%) theo thể tích của mỗi khí trong hỗn hợp lần lượt là :
Đáp án : A Phương pháp giải :
+)NH3 có tính bazơ nên sẽ bị H2SO4 đặc hấp thụ +) Theo giả thiết thì sau khi đi qua dung dịch H2SO4 đặc thì thể tích khí còn lại một nửa nên ta coi V(NH3)=1 =>V(N2) + V(H2) =1. +) Kết hợp với phương trình liên quan đến tỉ khối => V(N2), V(H2), V(NH3) Lời giải chi tiết :
Khi cho hỗn hợp gồm N2, H2 và NH3 đi qua dung dịch H2SO4 đặc, dư thì toàn bộ NH3 bị hấp thụ. Theo giả thiết thì sau khi đi qua dung dịch H2SO4 đặc thì thể tích khí còn lại một nửa => Coi V(NH3 )=1 thì V(N2) +V(H2)=1 (1) $\frac{{1*17 + {V_{{N_2}}}*28 + {V_{{H_2}}}*2}}{2}*100\% = 8*2$ (2) Giải (1) và (2) ta có V (N2)=0,5, V(NH3)=0,5 %N2 = %VH2= $\frac{{0,5}}{2}*100\% = 25\% $ %NH3 =50%
Câu 17 :
Sau quá trình tổng hợp NH3 từ H2 và N2 $({{n}_{{{H}_{2}}}}:{{n}_{{{N}_{2}}}}=3:1)$, áp suất trong bình giảm đi 10% so với áp suất lúc đầu. Biết nhiệt độ của phản ứng giữ không đổi trước và sau phản ứng. Phần trăm theo thể tích của N2, H2, NH3 trong hỗn hợp khí thu được sau phản ứng lần lượt là :
Đáp án : C Phương pháp giải :
Theo giả thiết \({n_{{H_2}}}:{n_{{N_2}}} = 3:1\) nên ta giả sử lúc đầu có 1 mol N2 và 3 mol H2. Trong một bình kín có nhiệt độ không đổi thì áp suất tỉ lệ thuận với số mol hỗn hợp khí : $\frac{{{n_1}}}{{{n_2}}} = \frac{{{p_1}}}{{{p_2}}} = \frac{{{p_1}}}{{90\% {p_1}}}$ Gọi số mol N2 và H2 phản ứng là x và 3x mol. Sau phản ứng số mol khí giảm bằng một nửa lượng phản ứng tức là giảm 2x mol. Ta có : nN2, H2 ban đầu - nkhí giảm = nN2, H2, NH3 sau phản ứng Lời giải chi tiết :
Theo giả thiết \({n_{{H_2}}}:{n_{{N_2}}} = 3:1\) nên ta giả sử lúc đầu có 1 mol N2 và 3 mol H2. Trong một bình kín có nhiệt độ không đổi thì áp suất tỉ lệ thuận với số mol hỗn hợp khí : $\frac{{{n_1}}}{{{n_2}}} = \frac{{{p_1}}}{{{p_2}}} = \frac{{{p_1}}}{{90\% {p_1}}}$ \( \Rightarrow \) nhỗn hợp khí sau phản ứng = \({n_2}\)= $4.\frac{{90}}{{100}} = 3,6\,\,mol$ Cách 1 : Tính số mol của các chất sau phản ứng dựa vào phản ứng Phương trình phản ứng hoá học: N2 + 3H2 $ \rightleftarrows $ 2NH3 (1) bđ: 1 3 0 : mol pư: x 3x 2x : mol dư: 1–x 3–3x 2x : mol Theo (1) ta thấy : nhỗn hợp khí sau phản ứng = (1 – x) + (3 – 3x) + 2x = 4 – 2x = 3,6 \( \Rightarrow \) x = 0,2 Vậy phần trăm về thể tích của các khí là : $\% {V_{{N_2}}} = \frac{{1 - 0,2}}{{3,6}}.100\% = 22,22\% ;\,\,\% {V_H}_{_2} = \frac{{3 - 3.0,2}}{{3,6}}.100\% = 66,67\% ;\,\,\,\% {V_{N{H_3}}} = 11,11\% .$ Cách 2 : Dựa vào sự tăng giảm thể tích khí Gọi số mol N2 và H2 phản ứng là x và 3x mol. Sau phản ứng số mol khí giảm bằng một nửa lượng phản ứng tức là giảm 2x mol. Ta có : ${n_{({N_2},\,\,{H_2})\,\,ban\,\,đầu}} - {n_{khí\,\,gỉam}} = {n_{({N_2},\,\,{H_2},\,\,N{H_3})\,\,sau\,\,phản\,\,ứng}} \Rightarrow 4 - 2x = 3,6 \Rightarrow x = 0,2\,\,mol.$
Câu 18 :
Hỗn hợp khí X gồm N2 và H2 có tỉ khối so với He bằng 1,8. Đun nóng X một thời gian trong bình kín (bột Fe làm xúc tác), thu được hỗn hợp khí Y có tỉ khối so với He bằng 2. Hiệu suất của phản ứng tổng hợp NH3 là
Đáp án : D Phương pháp giải :
+) Áp dụng sơ đồ đường chéo, sau đó chọn \({n_{{N_2}}} = 1\,\,mol\,\,;\,\,{n_{{H_2}}}\) +) Tính nhỗn hợp khí sau phản ứng +) Áp dụng định luật bảo toàn khối lượng ta có : mX = mY \( \Leftrightarrow \) nX.\({\overline M _X}\) = nY.\({\overline M _Y}\) +) Hiệu suất phản ứng tính theo N2 vì H2 dư Lời giải chi tiết :
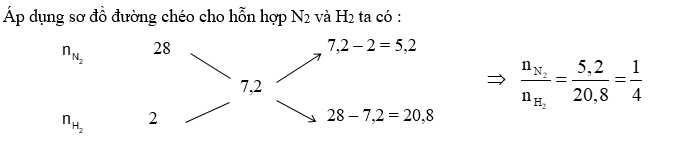 Chọn \({n_{{N_2}}} = 1\,\,mol\,\,;\,\,{n_{{H_2}}} = 4\,\,mol\) Phương trình phản ứng hoá học: N2 + 3H2 \( \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} \) 2NH3 (1) bđ: 1 4 0 mol pư: x 3x 2x mol dư: 1–x 4–3x 2x mol Theo (1) ta thấy : nhỗn hợp khí sau phản ứng = (1–x) + (4–3x) + 2x = 5 – 2x Áp dụng định luật bảo toàn khối lượng ta có : mX = mY \( \Leftrightarrow \) nX.\({\overline M _X}\) = nY.\({\overline M _Y}\) \( \Leftrightarrow \)\(\frac{{{{\rm{n}}_{\rm{X}}}}}{{{{\rm{n}}_{\rm{Y}}}}} = \frac{{{{\overline M }_Y}}}{{{{\overline M }_X}}} = \frac{{2.4}}{{1,8.4}} = \frac{5}{{5 - 2x}} \Rightarrow x = 0,25\) Hiệu suất phản ứng tính theo N2 vì H2 dư : H =\(\frac{{0,25}}{1}.100\% = 25\% \)
Câu 19 :
Một bình kín có thể tích là 0,5 lít chứa 0,5 mol H2 và 0,5 mol N2, ở nhiệt độ (toC). Khi ở trạng thái cân bằng có 0,2 mol NH3 tạo thành. Hằng số cân bằng KC của phản ứng tổng hợp NH3 là :
Đáp án : B Phương pháp giải :
+) Tính nồng độ các chất lúc cân bằng theo nồng độ NH3 +) \({K_C} = \frac{{{{{\rm{[}}N{H_3}{\rm{]}}}^2}}}{{{\rm{[}}{N_2}{\rm{][}}{H_2}{{\rm{]}}^3}}} \) Lời giải chi tiết :
Theo giả thiết ta thấy ban đầu ${\rm{[}}{H_2}{\rm{]}} = {\rm{[}}{N_2}{\rm{]}} = 1M$. Thực hiện phản ứng tổng hợp NH3 đến thời điểm cân bằng ${\rm{[}}N{H_3}{\rm{]}} = 0,4M.$ Phương trình phản ứng hoá học : N2 + 3H2 \( \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} \) 2NH3 (1) bđ: 1 1 0 pư: 0,2 ← 0,6 ← 0,4 cb: 0,8 0,4 0,4 Theo (1) tại thời điểm cân bằng [NH3] = 0,8M; [H2] =0,4M; [NH3] = 0,4M. Vậy hằng số cân bằng của phản ứng tổng hợp NH3 là : \({K_C} = \frac{{{{{\rm{[}}N{H_3}{\rm{]}}}^2}}}{{{\rm{[}}{N_2}{\rm{][}}{H_2}{{\rm{]}}^3}}} = \frac{{{{(0,4)}^2}}}{{0,8.{{(0,4)}^3}}} = 3,125.\)
Câu 20 :
Dẫn 2,24 lít NH3 (đktc) đi qua ống đựng 32 gam CuO nung nóng thu được chất rắn A và khí B. Ngâm chất rắn A trong dung dịch HCl 2M dư. Tính thể tích dung dịch axit đã tham gia phản ứng ? Coi hiệu suất quá trình phản ứng là 100%.
Đáp án : C Phương pháp giải :
- Tính số mol NH3, CuO - Xác định số mol các chất trong hỗn hợp A 2NH3 + 3CuO $\xrightarrow{{{t}^{o}}}$ 3Cu + N2 + 3H2O (1) - Tính số mol HCl phản ứng CuO + 2HCl \( \to \) CuCl2 + H2O (2) => VHCl Lời giải chi tiết :
\(-{n_{N{H_3}}} = 0,1\,\,mol,\,\,{n_{CuO}} = 0,4\,\,mol.\) - Phương trình phản ứng : 2NH3 + 3CuO $\xrightarrow{{{t}^{o}}}$ 3Cu + N2 + 3H2O (1) mol: 0,1 0,4 \( \to \) 0,15 => nCuO dư = 0,4 - 0,15 = 0,25mol A gồm Cu (0,15 mol) và CuO dư (0,25 mol) - Phản ứng của A với dung dịch HCl : CuO + 2HCl \( \to \) CuCl2 + H2O (2) mol: 0,25 \( \to \) 0,5 Theo (2) và giả thiết ta suy ra : VHCl =\(\frac{{0,5}}{2} = 0,25\,lít.\)
Câu 21 :
Cho NH3 dư vào 100ml dung dịch gồm CuSO4 1M ; ZnCl2 0,5M, AgNO3 1M và AlCl3 1M. Khối lượng kết tủa sau phản ứng là
Đáp án : C Phương pháp giải :
Vì các ion Cu2+, Zn2+, Ag+ tạo kết tủa với NH3, sau đó kết tủa tan trong NH3 dư tạo phức => kết tủa thu được chỉ gồm Al(OH)3 +) nAl(OH)3 = nAlCl3 Lời giải chi tiết :
Vì các ion Cu2+, Zn2+, Ag+ tạo kết tủa với NH3, sau đó kết tủa tan trong NH3 dư tạo phức => kết tủa thu được chỉ gồm Al(OH)3 nAl(OH)3 = nAlCl3 = 0,1 mol => m = 7,8 gam
Câu 22 :
Dung dịch X chứa các ion sau: Al3+, Cu2+, SO42- và NO3-. Để kết tủa hết ion SO42- có trong 250 ml dung dịch X cần 50 ml dung dịch BaCl2 1M. Cho 500 ml dung dịch X tác dụng với dung dịch NH3 dư thì được 7,8 gam kết tủa. Cô cạn 500 ml dung dịch X được 37,3 gam hỗn hợp muối khan. Nồng độ mol/l của NO3- là :
Đáp án : C Phương pháp giải :
+) Từ số mol Ba2+ tính số mol SO42- +) Tính số mol SO42- có trong 500 ml dung dịch X +) X phản ứng với dung dịch NH3 dư thì chỉ có Al3+ tạo kết tủa, Cu2+ lúc đầu tạo kết tủa sau đó tạo phức tan +) nAl(OH)3 = nAl3+ +) Đặt nCu2+ = x mol và nNO3- = y mol Theo định luật bảo toàn điện tích và khối lượng ta có : \(\left\{ \begin{array}{l}3.{n_{A{l^{3 + }}}} + 2.{n_{C{u^{2 + }}}} = 2.{n_{S{O_4}^{2 - }}} + 1.{n_{N{O_3}^ - }}\\{m_{A{l^{3 + }}}} + {m_{C{u^{2 + }}}} + {m_{C{l^ - }}} + {m_{N{O_3}^ - }} = {m_{muối}}\end{array} \right.\) Lời giải chi tiết :
Khi cho X phản ứng với dung dịch BaCl2 thì xảy ra phản ứng : Ba2+ + SO42- → BaSO4 (1) mol: 0,05 → 0,05 => trong 250 ml dung dịch X có 0,05 mol SO42- vậy trong 500 ml dung dịch X có 0,1 mol SO42-. Khi cho X phản ứng với dung dịch NH3 dư thì xảy ra các phản ứng : Al3+ + 3NH3 + 3H2O → Al(OH)3 + 3NH4+ (2) mol: 0,1 ← 0,1 Cu2+ + 2NH3 + 2H2O → Cu(OH)2 + 2NH4+ (3) Cu(OH)2 + 4NH3 → [Cu(NH3)4]2+ + 2OH- (4) X phản ứng với dung dịch NH3 dư thì chỉ có Al3+ tạo kết tủa, Cu2+ lúc đầu tạo kết tủa sau đó tạo phức tan Theo (2) và giả thiết ta thấy trong 500 ml dung dịch X có 0,1 mol Al3+. Đặt số mol của Cu2+ và NO3- trong 500 ml dung dịch X là x và y Theo định luật bảo toàn điện tích và khối lượng ta có : \(\left\{ \begin{array}{l}3.{n_{A{l^{3 + }}}} + 2.{n_{C{u^{2 + }}}} = 2.{n_{S{O_4}^{2 - }}} + 1.{n_{N{O_3}^ - }}\\{m_{A{l^{3 + }}}} + {m_{C{u^{2 + }}}} + {m_{C{l^ - }}} + {m_{N{O_3}^ - }} = {m_{muối}}\end{array} \right. \Rightarrow \left\{ \begin{array}{l}3.0,1 + 2x = 2.0,1 + y\\0,1.27 + 64x + 96.0,1 + 62.y = 37,3\end{array} \right. \Rightarrow \left\{ \begin{array}{l}x = 0,1\\y = 0,3\end{array} \right.\) Vậy [NO3-] = \(\dfrac{{0,3}}{{0,5}} = 0,6M\)
Câu 23 :
Tìm phát biểu không phù hợp với phản ứng này \({N_2} + 3{H_2} \rightleftarrows 2N{H_3}\,\,\,\,\,\,\,\,\,\,\,\,\,\Delta H = - 92kJ\)
Đáp án : B Lời giải chi tiết :
92kJ là lượng nhiệt tỏa ra chứ không phải lượng nhiệt hấp thụ
Câu 24 :
Đốt cháy hổn hợp gồm 6,72 lít khí Oxi và 7 lít khí amoniac (đo ở cùng điều kiện nhiệt độ và áp suất). Sau phản ứng thu được nhóm các chất là:
Đáp án : B Phương pháp giải :
Phản ứng: 4NH3 + 3O2 → 2N2 + 6H2O Dựa vào phản ứng, so sánh tỷ lệ số mol và đưa ra kết luận Lời giải chi tiết :
Phản ứng: 4NH3 + 3O2 → 2N2 + 6H2O So sánh tỉ lệ thể tích 4 : 3 và 7 : 6,72, ta thấy dư oxi. Do đó, các chất thu được sau phản ứng là khí nitơ, nước được tạo thành và khí oxi dư.
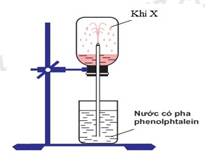
Câu 25 :
Trong phòng thí nghiệm, để thử tính chất của khí X người ta đã thực hiện thí nghiệm như hình vẽ dưới đây:
Khí X là:
Đáp án : B Lời giải chi tiết :
Khí X làm đổi màu dung dịch phenolphtalein sang màu hồng => khí X tan trong nước, tạo thành dung dịch có tính bazơ => X là NH3
Câu 26 :
Thành phần của dung dịch NH3 gồm:
Đáp án : C Phương pháp giải :
Viết phương trình điện li của NH3 trong nước Lời giải chi tiết :
\(N{H_3} + {H_2}O \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over Như vậy dung dịch NH3 gồm: NH4+, OH-, NH3 và H2O
Câu 27 :
Phát biểu nào dưới đây không đúng:
Đáp án : C Lời giải chi tiết :
C sai vì NH3 là chất có mùi khai
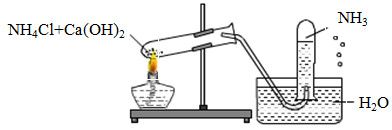
Câu 28 :
Một học sinh đã điều chế và thu khí NH3 theo sơ đồ sau đây, nhưng kết quả thí nghiệm không thành công. Lí do chính là:
Đáp án : B Phương pháp giải :
Dựa vào tính tan của NH3 Lời giải chi tiết :
NH3 tan nhiều trong nước nên ta không sử dụng phương pháp đẩy nước để thu khí.
Câu 29 :
Phản ứng nào dưới đây NH3 không đóng vai trò chất khử?
Đáp án : C Phương pháp giải :
NH3 + 3CuO \(\xrightarrow{{{t^0}}}\) 3Cu + N2 + 3H2O Lời giải chi tiết :
Phản ứng mà số oxi hóa của N trong NH3 không tăng sau phản ứng thì NH3 không đóng vai trò chất khử \(A.\,4\mathop N\limits^{ - 3} {H_3} + 5{O_2}\xrightarrow{{{t^0}}}4\mathop N\limits^{ + 2} O + 6{H_2}O\) \(B.\,2\mathop N\limits^{ - 3} {H_3} + 3\mathop {C{l_2}}\limits^0 \to \mathop {{N_2}}\limits^0 + 6HCl\) \(C.\,\,\mathop N\limits^{ - 3} {H_3} + {H_2}{O_2} + MnS{O_4} \to Mn{O_2} + {(\mathop N\limits^{ - 3} {H_4})_2}S{O_4}\) \(D.\,\,\mathop N\limits^{ - 3} {H_3} + 3CuO\xrightarrow{{{t^0}}}3Cu + \mathop {{N_2}}\limits^0 + 3{H_2}O\) Ta thấy phản ứng ở đán án C NH3 không có sự thay đổi số oxi hóa trước và sau phản ứng → không đóng vai trò là chất khử. Các phản ứng còn lại số oxi hóa của N trong NH3 đều tăng sau phản ứng nên NH3 đóng vai trò là chất khử
Câu 30 :
Cho phản ứng: N2 (k) + 3H2 (k) \( \rightleftarrows \) 2NH3 (k). Nếu ở trạng thái cân bằng nồng độ NH3 là 0,30 mol/l, N2 là 0,05 mol/l và của H2 là 0,10 mol/l thì hằng số cân bằn của phản ứng là
Đáp án : D Phương pháp giải :
Áp dụng công thức tính hằng số cân bằng: \(Kc = \frac{{{{{\rm{[}}N{H_3}]}^2}}}{{{\rm{[}}{N_2}].{\rm{[}}{H_2}]}} = ?\) với [NH3]; [N2]; [H2] là nồng độ mol/l của các chất đó ở trạng thái cân bằng. Lời giải chi tiết :
N2 (k) + 3H2 (k) \( \rightleftarrows \) 2NH3 (k). Áp dụng công thức tính hằng số cân bằng: \(Kc = \frac{{{{[N{H_3}]}^2}}}{{[{N_2}].{{{\rm{[}}{H_2}]}^3}}} = \frac{{0,{3^2}}}{{0,05.0,{1^3}}} = 1800\)
Câu 31 :
NH3 có thể phản ứng được với tất cả các chất trong nhóm nào sau đây (các điều kiện coi như có đủ)
Đáp án : B Phương pháp giải :
Dựa vào tính chất hóa học của NH3 trong sgk hóa 11 Lời giải chi tiết :
A. Loại KOH không có pư B. Thỏa mãn NH3 + HCl → NH4Cl NH3 + O2 \(\buildrel {{t^0}} \over\longrightarrow \) N2 + H2O NH3 + Cl2 → NH4Cl + N2 NH3 + CuO \(\buildrel {{t^0}} \over\longrightarrow \) Cu + N2 + H2O NH3 + AlCl3 + H2O → Al(OH)3 + NH4Cl C. Loại KOH D. Loại NaOH
Câu 32 :
Cho sơ đồ phản ứng sau:
X, Y, Z, T tương ứng là
Đáp án : B Phương pháp giải :
Viết các PTHH từ đó xác định được các chất X, Y, Z, T tương ứng. Lời giải chi tiết :
2NH3 + CO2 \(\xrightarrow{{{t^o}\,cao,\,p\,\,cao}}\) (NH2)2CO (X) + H2O (NH2)2CO (X) + 2H2O → (NH4)2CO3 (Y) (NH4)2CO3 (Y) + 2HCl → 2NH4Cl + H2O + CO2 (Z) (NH4)2CO3 (Y) + 2NaOH → Na2CO3 + 2NH3 (T) + 2H2O
Câu 33 :
Trong phân tử NH3 chứa liên kết:
Đáp án : B Phương pháp giải :
Dựa vào cấu tạo được học về NH3 trong sgk hóa 11 Lời giải chi tiết :
Trong phân tử NH3 chứa liên kết cộng hóa trị có phân cực, cặp e dùng chung lệch về phía nguyên tử nito (vì nito có độ âm điện lớn hơn hidro)
Câu 34 :
Trong công nghiệp, người ta điều chế khí amoniac từ
Đáp án : C Phương pháp giải :
Kiến thức về điều chế NH3 sgk hóa 11 – trang 35 Lời giải chi tiết :
Trong công nghiệp NH3 được điều chế từ N2 và H2. N2 + 3H2 \(\underset{{}}{\overset{{{t^0},p,xt}}{\longleftrightarrow}}\) 2NH3
Câu 35 :
Nung nóng bình kín chứa a mol hỗn hợp NH3 và O2 ( có xúc tác Pt) để chuyển toàn bộ NH3 thành NO. Làm nguội và thêm nước vào bình, lắc đều thu được 1 lít dung dịch HNO3 có pH = 1, còn lại 0,25a mol khí O2. Biết các phản ứng xảy ra hoàn toàn. Giá trị của a là
Đáp án : D Phương pháp giải :
pH = 1 => nHNO3 = ? (mol) BTNT N => nNH3 = nHNO3 = ?(mol) => nO2(pu) BT e : => 8nNH3 = 4nO2 => a = ? (mol) Lời giải chi tiết :
pH = 1=> [H+] = 10-1 = 0,1 (M) => \({{n}_{HN{{O}_{3}}}}=\text{ }0,1\text{ }\left( mol \right)\) BTNT Nito \(=>{{n}_{N{{H}_{3}}}}=\text{ }{{n}_{HN{{O}_{3}}}}=\text{ }0,1\text{ }\left( mol \right)\) \(=>\text{ }{{n}_{{{O}_{2}}(pu)}}=\text{ }a\text{ }\text{- }0,1-0,25a=0,75a-0,1\text{ }\left( mol \right)\) Sau quá trình \(\begin{gathered} BT e \(:\text{ }=>\text{ }8{{n}_{N{{H}_{3}}}}=\text{ }4{{n}_{{{O}_{2}}}}\) => 8.0,1 = 4 (0,75a – 0,1) => a = 0,4 (mol)
Câu 36 :
Cho x mol N2 và 12 mol H2 vào bình kín. Tại thời điểm cân bằng thấy có 6 mol NH3 tạo thành. Biết hiệu suất chung của phản ứng là 75%. Tìm x?
Đáp án : D Phương pháp giải :
\(\begin{gathered} Nhận thấy: \(\frac{{{n_{{H_2}pu}}}}{{{n_{{H_2}bd}}}}.100\% = \frac{9}{{12}}.100\% = H\% \) => Hiệu suất tính theo H2 Lời giải chi tiết :
\(\begin{gathered} Nhận thấy: \(\frac{{{n_{{H_2}pu}}}}{{{n_{{H_2}bd}}}}.100\% = \frac{9}{{12}}.100\% = H\% \) => Hiệu suất tính theo H2 Nếu H% tính theo N2 thì: nN2 bđ = 3.(100/75) = 4 => nN2 bđ = x ≥ 4
Câu 37 :
Một bình kín chứa 4 mol khí N2 và 10 mol khí H2 có áp suất là 200atm. Khi đạt trạng thái cân bằng thì áp suất trong bình là 180 atm, nhiệt độ trong bình được giữ không đổi. Tính hiệu suất của phản ứng tổng hợp NH3 trên.
Đáp án : A Phương pháp giải :
Áp dụng: P1V= n1RT (n1=14) Xét phương trình hóa học, khảo sát các chất còn lại và tạo thành sau phản ứng => x Lời giải chi tiết :
P1V= n1RT (n1=14) N2 + 3 H2 <-> 2NH3 có 4 10 p/u x 3x 2x sau 4-x 10-3x 2x 4-x + 10-3x+ 2x=12,6 => 14-2x=12,6 => x=0,7 => Tính theo H2 => H= 21%
Câu 38 :
Từ 34 tấn NH3 sản xuất 160 tấn HNO3 63%. Hiệu suất của phản ứng điều chế HNO3 là:
Đáp án : A Phương pháp giải :
4NH3 + 5O2 -> 4NO + 6H2o 2NO+ O2 -> 2NO2 4NO2 + 2H2O + O2 -> 4HNO3 Bảo toàn N nN(NH3) =nN(HNO3) => m NH3 => H% Lời giải chi tiết :
4NH3 + 5O2 -> 4NO + 6H2o 2NO+ O2 -> 2NO2 4NO2 + 2H2O + O2 -> 4HNO3 Bảo toàn N nN(NH3) =nN(HNO3) = =>
Câu 39 :
Cho 6 mol N2 và 20 mol H2 vào bình kín. Tại thời điểm cân bằng thu được 18 mol hỗn hợp khí. Hiệu suất của phản ứng tổng hợp NH3 trên.
Đáp án : C Phương pháp giải :
Phương pháp: N2 + 3 H2 <-> 2NH3 có 6 20 p/u x 3x 2x sau 6-x 20-3x 2x => nsau =18 => x
=> H Lời giải chi tiết :
N2 + 3 H2 <-> 2NH3 có 6 20 p/u x 3x 2x sau 6-x 20-3x 2x 6-x + 20-3x+ 2x=18 => 26-2x=18 => x=4
Câu 40 :
Cho hỗn hợp N2 và H2 vào bình phản ứng có nhiệt độ không đổi. Sau thời gian phản ứng, áp suất khí trong bình giảm 5% so với áp suất ban đầu. Biết ti lệ số mol của nitơ đã phản ứng là 10%. Thành phần phần trăm về số mol của N2 và H2 trong hỗn hợp đầu?
Đáp án : A Phương pháp giải :
Phương pháp: gọi số mol ban đầu của N2 là x, H2 : y N2 + 3 H2 -> 2NH3 bd x y p/u 0,1x 0,3x 0,2x Sau 0,9x y-0,3x 0,2x => Lời giải chi tiết :
Gọi số mol ban đầu của N2 là x, H2 : y N2 + 3 H2 -> 2NH3 bd x y p/u 0,1x 0,3x 0,2x Sau 0,9x y-0,3x 0,2x ns= 0,9x+y-0,3x+0,2x=0,8x+y => 0,95(x+y)= 0,8x+y => 0,15x=0,05y => y=3x =>
Câu 41 :
Cho các oxit kim loại: CuO, FeO, Al2O3, Na2O, PbO, CaO. Số oxit NH3 có thể khử được:
Đáp án : B Phương pháp giải :
Tương tự CO, H2 thì NH3 chỉ khử được oxit của kim loại đứng sau nhôm Lời giải chi tiết :
NH3 chỉ khử được CuO, FeO, PbO => khử được 3 chất .
Câu 42 :
Cho NH3 dư lần lượt vào các dung dịch: CuSO4, AgNO3, Zn( NO3 )2, AlCl3, FeSO4, NaBr, MgCl2. Có bao nhiêu dung dịch tạo phức với NH3 ?
Đáp án : B Lời giải chi tiết :
Trừ AlCl3, FeSO4, NaBr, MgCl2 Chú ý đây là phản ứng dùng để phân biệt các hợp chất của Al và Zn
Câu 43 :
Cho 6,72 lít khí N2 tác dụng với 13,44 lít khí H2 với điều kiện thích hợp thu được V lít hỗn hợp khí (biết H% = 20%). Biết các khí được đo ở điều kiện tiêu chuẩn. Giá trị V là
Đáp án : D Phương pháp giải :
Tính số mol hai khí N2 và H2 dựa vào công thức n = V/22,4. Dùng công thức \(H\% {\rm{ }} = \;\dfrac{{{n_{pu}}.100}}{{{n_{bd}}}}\) tính số mol khí phản ứng và tìm ra thể tích hỗn hợp khí sau phản ứng. Lời giải chi tiết :
nN2 = 0,3 mol; nH2 = 0,6 mol N2 + 3H2 ⇄ 2NH3 Ta có: \(\dfrac{{{n_{{N_2}}}}}{1} > \dfrac{{{n_{{H_2}}}}}{3}\) ⟹ H2 hết và N2 dư. ⟹ nH2pu = 0,6.20% = 0,12 mol N2 + 3H2 ⇄ 2NH3 0,04 ← 0,12 → 0,08 (mol) nN2 du = 0,3 - 0,04 = 0,26 mol nH2 du = 0,6 - 0,12 = 0,48 mol nhỗn hợp khí = 0,08 + 0,26 + 0,48 = 0,82 mol ⟹ Vkhí = 18,368 lít
Câu 44 :
Cho 17,92 lít hỗn hợp N2, H2 nung trong điều kiện thích hợp sau một thời gian thu được 13,888 lít hỗn hợp khí với hiệu suất 30% tính theo N2. Biết các khí đều được đo ở điều kiện tiêu chuẩn. Thể tích N2 trong hỗn hợp ban đầu là
Đáp án : A Phương pháp giải :
Ta có: ngiảm = nNH3 Tính theo PTHH ⟹ nN2 pư Từ hiệu suất ⟹ nN2 ban đầu ⟹ VN2 ban đầu Lời giải chi tiết :
nkhí ban đầu = 17,92/22,4 = 0,8 mol nkhí sau = 13,888/22,4 = 0,62 mol PTHH: N2 + 3H2 ⇄ 2NH3 ngiảm = nNH3 = nkhí bđ – nkhí sau = 0,8 – 0,62 = 0,18 mol PTHH: N2 + 3H2 ⇄ 2NH3 0,09 ← 0,18 ⟹ nN2 pu = 0,09 mol ⟹ nN2 bđ = nN2 pu.100/30 = 0,09.100/30 = 0,3 mol ⟹ VN2 = 0,3.22,4 = 6,72 lít
Câu 45 :
Nung hỗn hợp X gồm N2 và H2 (biết tỉ khối của X so với H2 bằng 6,2). Sau phản ứng thu được hỗn hợp Y trong đó amoniac chiếm 25% thể tích. Hiệu suất phản ứng là
Đáp án : D Phương pháp giải :
Xét 1 mol hỗn hợp X và từ tỉ khối X so với khí hidro xác định tỉ lệ nN2, nH2. Xác định hiệu suất tính theo chất nào dựa vào tỉ lệ số mol. Xét 1 mol hỗn hợp X kết hợp với %nNH3 trong Y tìm hiệu suất. Lời giải chi tiết :
Xét 1 mol hỗn hợp X và gọi nN2 =x; nH2 = y nên ta có: x + y = 1; 24x + 2y = 12,4 ⟹ x = 0,4; y = 0,6 Xét tỉ lệ \(\dfrac{{{n_{{N_2}}}}}{1} = \dfrac{{0,4}}{1} > \dfrac{{{n_{{H_2}}}}}{3} = \dfrac{{0,6}}{3}\) ⟹ Tính hiệu suất theo H2 Gọi nNH3 = a mol PTHH: N2 + 3H2 ⇄ 2NH3. 0,5a 1,5a ← a nN2 dư = 0,4 – 0,5a; nH2 dư = 0,6 – 1,5a; nNH3 = a Ta có nNH3 = 25%nY ⟹ \(a = 0,25.(0,4 - 0,5a + 0,6 - 1,5a + a)\)⟹ a = 0,2 nH2 pư = 0,3 mol ⟹ H% = 50%. Trước đây, trong thời kỳ Chiến tranh Thế giới thứ I, NH3 lỏng từng được thiết kế sử dụng làm thuốc phóng tên lửa. Hiện nay, NH3 được sử dụng nhiều nhất trong sản xuất phân bón và một số hóa chất cơ bản. Trong đó lượng sử dụng cho sản xuất phân bón (cả dạng rắn và lỏng) chiếm đến trên 80% sản lượng NH3 toàn thế giới và tương đương với khoảng 1% tổng công suất phát năng lượng của thế giới. Bên cạnh đó NH3 vẫn được sử dụng trong công nghiệp đông lạnh (sản xuất nước đá, bảo quản thực phẩm,…), trong các phòng thí nghiệm, trong tổng hợp hữu cơ, hóa dược, y tế và cho các mục đích dân dụng khác. Ngoài ra trong công nghệ môi trường, NH3 còn được dùng để loại bỏ khí SO2 trong khí thải của các nhà máy có quá trình đốt nhiên liệu hóa thạch (than, dầu) và sản phẩm amoni sunfat thu hồi của các quá trình này có thể được sử dụng làm phân bón. Vì những lí do trên mà trong công nghiệp, có những mối quan tâm nhất định đến quy trình tổng hợp NH3 sao cho đạt hiệu suất cao nhất và hạn chế chi phí một cách tối đa. Vấn đề này có liên quan đến tính hiệu quả và kinh tế của phương pháp Haber tổng hợp amoniac, được biểu diễn bằng phương trình: N2 (k) + 3H2 (k) ⇄ 2NH3 (k) ; ΔH = -92 kJ.mol-1 Câu 46
Trong công nghiệp thường sử dụng hai biện pháp để làm tăng hiệu suất của phản ứng tổng hợp amoniac là
Đáp án : C Phương pháp giải :
Áp dụng nguyên lý chuyển dịch cân bằng Lơ Sa-tơ-li-ê: “Một phản ứng thuận nghịch đang ở trạng thái cân bằng khi chịu tác động từ bên ngoài như biến đổi nồng độ, áp suất, nhiệt độ, thì cân bằng sẽ chuyển dịch theo chiều làm giảm tác động bên ngoài đó.’’ Những cân bằng có tổng số mol khí hai vế bằng nhau hoặc không có chất khí thì áp suất không ảnh hưởng đến cân bằng. Lời giải chi tiết :
- Cân bằng có tổng số mol khí ở vế trái bằng 4 mol và vế phải bằng 2 mol. Khi tăng áp suất chung của hệ sẽ làm cân bằng chuyển dịch theo chiều thuận ⟹ Làm tăng hiệu suất phản ứng. - Phản ứng thuận là phản ứng tỏa nhiệt (ΔH < 0) ⟹ Khi giảm nhiệt độ của hệ sẽ làm cân bằng chuyển dịch theo chiều thuận ⟹ Làm tăng hiệu suất phản ứng. Vậy trong công nghiệp thường sử dụng hai biện pháp để làm tăng hiệu suất của phản ứng tổng hợp amoniac là giảm nhiệt độ và tăng áp suất. Câu 47
Thực hiện phản ứng tổng hợp amoniac trong bình kín ở nhiệt độ xác định. Khi giảm nồng độ N2 đi 2 lần và tăng nồng độ của H2 lên 2 lần thì tốc độc của phản ứng thuận thay đổi như thế nào so với lúc chưa thay đổi nồng độ?
Đáp án : A Lời giải chi tiết :
Tốc độ phản ứng thuận tính theo nồng độ của các chất tham gia phản ứng là v = k.[N2].[H2]3 Khi giảm nồng độ N2 đi 2 lần và tăng nồng độ của H2 lên 2 lần thì tốc độ phản ứng thuận khi đó: v' = k.0,5[N2].23[H2]3 = 4.k.[N2].[H2]3 = 4v. ⟹ Tốc độ phản ứng thuận tăng 4 lần khi giảm nồng độ N2 đi 2 lần và tăng nồng độ của H2 lên 2 lần. Câu 48
Nung hỗn hợp khí A gồm 0,1 mol N2; 0,45 mol H2 trong điều kiện thích hợp thu được hỗn hợp B có dA/B = 10/11. Hiệu suất phản ứng là
Đáp án : D Phương pháp giải :
- Dựa vào số mol N2 và H2 xác định hiệu suất phản ứng tính theo chất nào. - Áp dụng định luật bảo toàn khối lượng: mA = mB suy ra tỉ lệ \(\dfrac{{\overline {{M_A}} }}{{\overline {{M_B}} }} = \dfrac{{{n_B}}}{{{n_A}}}\), từ đó tính được số mol hỗn hợp B. Lời giải chi tiết :
- Xét tỉ lệ số mol: \(\dfrac{{{n_{{N_2}}}}}{1} = \dfrac{{0,1}}{1} < \dfrac{{{n_{{H_2}}}}}{3} = \dfrac{{0,45}}{3}\) ⟹ Tính hiệu suất phản ứng theo N2. - BTKL: mA = mB ⟹ \({n_A}.\overline {{M_A}} = {n_B}.\overline {{M_B}} \) ⟹ \(\dfrac{{\overline {{M_A}} }}{{\overline {{M_B}} }} = \dfrac{{{n_B}}}{{{n_A}}} \Rightarrow \dfrac{{10}}{{11}} = \dfrac{{{n_B}}}{{0,1 + 0,45}} \Rightarrow {n_B} = 0,5(mol)\) - Gọi số mol N2 phản ứng là x (mol). PTHH: N2 + 3H2 ⇄ 2NH3. x ⟶ 3x → 2x (mol) ⟹ Hỗn hợp B gồm N2 dư: 0,1 – x mol; H2 dư: 0,45 – 3x mol; NH3: 2x mol ⟹ nB = 0,1 – x + 0,45 – 3x + 2x = 0,55 – 2x = 0,5 ⟹ x = 0,025 mol. Vậy \(H = \dfrac{{{n_{{N_2}(pu)}}.100\% }}{{{n_{{N_2}(bd)}}}} = \dfrac{{0,025.100\% }}{{0,1}} = 25\% \)
|














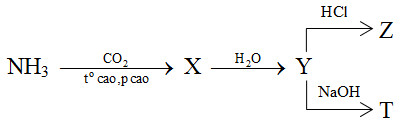
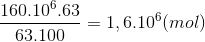
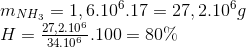





Danh sách bình luận