Trắc nghiệm Tổng hợp bài tập điện li hay và khó - Hóa 11Đề bài
Câu 1 :
Dung dịch X chứa m gam 3 ion : Mg2+, NH4+, SO42-. Chia dung dịch X thành 2 phần bằng nhau. Phần 1 cho tác dụng với dung dịch KOH thu được 5,8 gam kết tủa. Phần 2 đun nóng với dung dịch NaOH dư thu được 3,36 lít khí (đktc). Giá trị của m là :
Câu 2 :
Dung dịch E chứa các ion: Ca2+, Na+, HCO3-, Cl- trong đó số mol của Cl- gấp đôi số mol của ion Na+. Cho một nửa dung dịch E phản ứng với dd NaOH dư thu được 4 gam kết tủa. Cho một nửa dd E còn lại phản ứng với dd Ca(OH)2 dư thu được 5 gam kết tủa. Mặt khác, nếu đun sôi đến cạn dung dịch E thu được m gam chất rắn khan. Giá trị của m là
Câu 3 :
Cho dung dịch X chứa các ion: Fe3+, SO4 2-, NH4+, NO3-. Chia dung dịch X thành 2 phần bằng nhau - Phần 1 tác dụng với dung dịch NaOH dư, đun nóng, được 1,07 gam kết tủa và 0,672 lít khí (đktc). - Phần 2 tác dụng với dung dịch BaCl2 dư, được 4,66 gam kết tủa. Tổng khối lượng các chất tan trong dung dịch X là
Câu 4 :
Một dung dịch X chứa 0,01 mol Ba2+, 0,01 mol NO3-, a mol OH-, b mol Na+. Để trung hòa lượng dung dịch X này cần dùng 400 ml dung dịch HCl có pH = 1. Khối lượng chất rắn thu được sau khi cô cạn dung dịch X là:
Câu 5 :
Cho dung dịch X chứa 0,1 mol Al3+, 0,2 mol Mg2+, 0,2 mol NO3-, x mol Cl-, y mol Cu2+ - Nếu cho dung dịch X tác dụng với dung dịch AgNO3 dư thì thu được 86,1 gam kết tủa - Nếu cho 850 ml dung dịch NaOH 1M vào dung dịch X thì khối lượng kết tủa thu được là :
Câu 6 :
Cho rất từ từ 0,2 lít dung dịch HCl 1M vào 0,2 lít dung dịch hỗn hợp KOH 0,5M, K2CO3 0,4M đến phản ứng hoàn toàn, thu được x lít khí ở đktc. Giá trị của x là:
Câu 7 :
Trộn dung dịch X chứa OH- (0,17 mol), Na+ (0,02 mol) và Ba2+ với dung dịch Y chứa CO32- (0,03 mol), Na+ (0,1 mol) và HCO3- thu được m gam kết tủa. Giá trị của m là
Câu 8 :
Trộn 100 ml dung dịch hỗn hợp gồm H2SO4 0,05M và HCl 0,1M với 100 ml dung dịch hỗn hợp gồm NaOH 0,2M và Ba(OH)2 0,1M thu được dung dịch X. Dung dịch X có pH là
Câu 9 :
Trộn 300ml dung dịch có pH = 2 gồm HCl và HNO3 với 300ml dung dịch NaOH nồng độ a (mol/l) thu được 600 ml dung dịch có pH = 11. Giá trị của a là:
Câu 10 :
Dung dịch X chứa 0,02 mol Al3+; 0,04 mol Mg2+; 0,04 mol NO3-; x mol Cl- và y mol Cu2+. Cho X tác dụng hết với dung dịch AgNO3 dư, thu được 17,22 gam kết tủa. Mặt khác, cho 170 ml dung dịch NaOH 1M vào X, thu được m gam kết tủa. Biết các phản ứng đều xảy ra hoàn toàn. Giá trị của m là
Câu 11 :
Thêm từ từ dung dịch HCl có pH = 0 vào dung dịch chứa 5,25 gam hỗn hợp muối cacbonnat của 2 kim loại kiềm kế tiếp nhau đến khi có 0,015 mol khí thoát ra thì dừng lại. Cho dung dịch thu được tác dụng với dung dịch Ca(OH)2 dư cho 3 gam kết tủa. Công thức của 2 muối và thể tích dung dịch HCl đã dùng là
Câu 12 :
Dung dịch X chứa 0,2 mol Ca2+; 0,08 mol Cl- ; z mol HCO3- và t mol NO3-. Cô cạn X rồi nung đến khối lượng không đổi, thu được 16,44 gam chất rắn Y. Nếu thêm t mol HNO3 vào X rồi đun dung dịch đến cạn thì thu được muối khan có khối lượng là
Câu 13 :
Dung dịch X và dung dịchY là các dung dịch HCl với nồng độ mol tương ứng là C1 và C2 (Mol/lít), trong đó C1 > C2. Trộn 150 ml dung dịch X với 500 ml dung dịch Y, thu được dung dịch Z. Để trung hòa 1/10 dung dịch Z cần 10 ml dung dịch hỗn hợp NaOH 1 M và Ba(OH)2 0,25 M. Mặt khác lấy V1 lít dung dịch X chứa 0,05 mol HCl trộn với V2 lít dung dịch Y chứa 0,15 mol HCl thu được 1,1 lít dung dịch. Giá trị của C1 và C2 tương ứng là:
Câu 14 :
Cho a gam dung dịch H2SO4 loãng nồng độ C% tác dụng hoàn toàn với hỗn hợp 2 kim loại K và Fe (Lấy dư so với lượng phản ứng). Sau phản ứng, khối lượng khí sinh ra là 0,04694a gam. Giá trị của C% là :
Câu 15 :
Dung dịch X chứa các ion: Na+, Ba2+ và HCO3-. Chia X thành ba phần bằng nhau. Phần một tác dụng với KOH dư, được m gam kết tủa. Phần hai tác dụng với Ba(OH)2 dư, được 4m gam kết tủa. Đun sôi đến cạn phần ba, thu được V1 lít CO2 (đktc) và chất rắn Y. Nung Y đến khối lượng không đổi, thu được thêm V2 lít CO2 (đktc). Tỉ lệ V1 : V2 bằng
Câu 16 :
Cho a mol Mg và b mol Zn vào dung dịch chứa c mol Cu2+ và d mol Ag+. Sau khi phản ứng kết thúc thu được dung dịch chứa 2 ion kim loại. Điều kiện về b (so với a, c, d) để được kết quả này là:
Lời giải và đáp án
Câu 1 :
Dung dịch X chứa m gam 3 ion : Mg2+, NH4+, SO42-. Chia dung dịch X thành 2 phần bằng nhau. Phần 1 cho tác dụng với dung dịch KOH thu được 5,8 gam kết tủa. Phần 2 đun nóng với dung dịch NaOH dư thu được 3,36 lít khí (đktc). Giá trị của m là :
Đáp án : B Phương pháp giải :
+) Từ số mol kết tủa và khí => số mol Mg2+ và NH4+ +) Bảo toàn điện tích : ${{n}_{SO_{4}^{2-}(1\,phan)}}\text{ }=\frac{1}{2}.(2{{n}_{Mg}}~+\text{ }{{n}_{NH_{4}^{+}}})$ Lời giải chi tiết :
${{n}_{Mg{{\left( OH \right)}_{2}}}}=0,1\text{ }mol;\,{{n}_{N{{H}_{3}}}}=0,15\text{ }mol$ Mg2+ + 2OH- → Mg(OH)2 NH4+ + OH- → NH3 + H2O Trong mỗi phần có : 0,1 mol Mg2+ và 0,15 mol NH4+ Bảo toàn điện tích : ${{n}_{SO_{4}^{2-}(1\,phan)}}\text{ }=\frac{1}{2}.(2{{n}_{Mg}}~+\text{ }{{n}_{NH_{4}^{+}}})=0,175\text{ }mol$ => m = (0,1.24 + 0,15.18 + 0,175.96).2 = 43,8 gam
Câu 2 :
Dung dịch E chứa các ion: Ca2+, Na+, HCO3-, Cl- trong đó số mol của Cl- gấp đôi số mol của ion Na+. Cho một nửa dung dịch E phản ứng với dd NaOH dư thu được 4 gam kết tủa. Cho một nửa dd E còn lại phản ứng với dd Ca(OH)2 dư thu được 5 gam kết tủa. Mặt khác, nếu đun sôi đến cạn dung dịch E thu được m gam chất rắn khan. Giá trị của m là
Đáp án : A Phương pháp giải :
Đặt Ca2+: a mol có trong 1/2 dung dịch Na+: b mol HCO3-: c mol Cl-: 2b mol 1/2 dung dịch E tác dụng NaOH dư HCO3- + OH- → CO32- + H2O CO32- + Ca2+ → CaCO3 1/2 dung dịch E tác dụng Ca(OH)2 dư HCO3- + OH- → CO32- + H2O CO32- + Ca2+ → CaCO3 => nCaCO3↓ lần đầu và nCaCO3↓ sau => c và a Bảo toàn mol điện tích => b Đun sôi dung dịch đến cạn : 2HCO3− → H2O + CO2 + CO32− => m chất rắn Lời giải chi tiết :
Đặt Ca2+: a mol có trong 1/2 dung dịch Na+: b mol HCO3-: c mol Cl-: 2b mol 1/2 dung dịch E tác dụng NaOH dư HCO3- + OH- → CO32- + H2O c c CO32- + Ca2+ → CaCO3 c a 0,04 1/2 dung dịch E tác dụng Ca(OH)2 dư HCO3- + OH- → CO32- + H2O c c CO32- + Ca2+ → CaCO3 c c = 0,05 Ta có: nCaCO3↓ lần đầu = 0,04 mol và sau = 0,05 => c = 0,05 mol và a = 0,04 Bảo toàn mol điện tích ta có: 2a + b = c + 2b => b = 0,03 Đun sôi dung dịch đến cạn 2HCO3− → H2O + CO2 + CO32− 0,05 → 0,025 m chất rắn = (40a + 23b + 60c/2 + 35,5.2.0,03).2 = 11,84 gam
Câu 3 :
Cho dung dịch X chứa các ion: Fe3+, SO4 2-, NH4+, NO3-. Chia dung dịch X thành 2 phần bằng nhau - Phần 1 tác dụng với dung dịch NaOH dư, đun nóng, được 1,07 gam kết tủa và 0,672 lít khí (đktc). - Phần 2 tác dụng với dung dịch BaCl2 dư, được 4,66 gam kết tủa. Tổng khối lượng các chất tan trong dung dịch X là
Đáp án : B Phương pháp giải :
P1: ${{n}_{Fe{{\left( OH \right)}_{3}}}}\Rightarrow {{n}_{F{{e}^{3+}}}}$ ${{n}_{N{{H}_{3}}}}\Rightarrow {{n}_{NH_{4}^{+}}}$ P2: ${{n}_{BaS{{O}_{4}}}}\Rightarrow {{n}_{SO_{4}^{2-}}}$ BTĐT $\Rightarrow {{n}_{NO_{3}^{-}}}$ Lời giải chi tiết :
P1: ${{n}_{Fe{{\left( OH \right)}_{3}}}}={{n}_{F{{e}^{3+}}}}=\frac{1,07}{107}=0,01\text{ }mol$ ${{n}_{N{{H}_{3}}}}={{n}_{NH_{4}^{+}}}=\frac{0,672}{22,4}=0,03\text{ }mol$ P2: ${{n}_{BaS{{O}_{4}}}}={{n}_{SO_{4}^{2-}}}=\frac{4,66}{233}=0,02\text{ }mol$ BTĐT $\Rightarrow {{n}_{NO_{3}^{-}}}=3{{n}_{F{{e}^{3+}}}}+{{n}_{NH_{4}^{+}}}-2{{n}_{SO_{4}^{2-}}}=0,02\text{ }mol$ => m chất tan (1 phần) = 0,01.56 + 0,03.18 + 0,02.96 + 0,02.62 = 4,26 gam => m chất tan trong X = 8,52 gam
Câu 4 :
Một dung dịch X chứa 0,01 mol Ba2+, 0,01 mol NO3-, a mol OH-, b mol Na+. Để trung hòa lượng dung dịch X này cần dùng 400 ml dung dịch HCl có pH = 1. Khối lượng chất rắn thu được sau khi cô cạn dung dịch X là:
Đáp án : A Phương pháp giải :
+) $a={{n}_{O{{H}^{-}}}}={{n}_{{{H}^{+}}}}$ BTĐT: $2{{n}_{B{{a}^{2+}}}}+{{n}_{N{{a}^{+}}}}={{n}_{NO_{3}^{-}}}+{{n}_{O{{H}^{-}}}}$ => b Lời giải chi tiết :
$a={{n}_{O{{H}^{-}}}}={{n}_{{{H}^{+}}}}=0,1.0,4=0,04\text{ }mol$ BTĐT: $2{{n}_{B{{a}^{2+}}}}+{{n}_{N{{a}^{+}}}}={{n}_{NO_{3}^{-}}}+{{n}_{O{{H}^{-}}}}~\Rightarrow 2.0,01+b=0,01+0,04$ => b = 0,03 m chất rắn = 0,01.137 + 0,01.62 + 0,04.17 + 0,03.23 = 3,36 gam
Câu 5 :
Cho dung dịch X chứa 0,1 mol Al3+, 0,2 mol Mg2+, 0,2 mol NO3-, x mol Cl-, y mol Cu2+ - Nếu cho dung dịch X tác dụng với dung dịch AgNO3 dư thì thu được 86,1 gam kết tủa - Nếu cho 850 ml dung dịch NaOH 1M vào dung dịch X thì khối lượng kết tủa thu được là :
Đáp án : A Phương pháp giải :
+) Từ nAgCl => x +) BTĐT => y +) Xác định số mol các chất kết tủa khi tác dụng với NaOH => khối lượng Lời giải chi tiết :
Câu 6 :
Cho rất từ từ 0,2 lít dung dịch HCl 1M vào 0,2 lít dung dịch hỗn hợp KOH 0,5M, K2CO3 0,4M đến phản ứng hoàn toàn, thu được x lít khí ở đktc. Giá trị của x là:
Đáp án : C Phương pháp giải :
B1: Tính ${{n}_{{{H}^{+}}}}~;~\text{ }{{n}_{O{{H}^{-}}~}}~;\text{ }{{n}_{CO_{3}^{2-}}}$ B2: Viết phương trình ion rút gọn thứ tự các phản ứng xảy ra H+ + OH - → H2O H+ + CO32- → HCO3- H+ + HCO3- → CO2 + H2O B3: Tính toán theo phương trình với chú ý, chất nào phản ứng hết thì theo số mol của chất đó Lời giải chi tiết :
${{n}_{{{H}^{+}}}}={{n}_{HCl}}~=0,2\text{ }\left( mol \right);$ ${{n}_{O{{H}^{-}}}}~={{n}_{KOH}}=0,1\text{ }\left( mol \right);\text{ }{{n}_{CO_{3}^{2-}}}~={{n}_{{{K}_{2}}C{{O}_{3}}}}=0,08\text{ }\left( mol \right)$ Thứ tự xảy ra phản ứng: H+ + OH- → H2O 0,1← 0,1 H+ + CO32- → HCO3- 0,08 ← 0,08 → 0,08 H+ + HCO3- → CO2 + H2O (0,2 – 0,1 – 0,08) → 0,02 ${{n}_{C{{O}_{2}}}}=0,02\text{ }\left( mol \right)\Rightarrow {{V}_{C{{O}_{2}}}}=0,02.22,4=0,448\text{ }\left( l \right)$
Câu 7 :
Trộn dung dịch X chứa OH- (0,17 mol), Na+ (0,02 mol) và Ba2+ với dung dịch Y chứa CO32- (0,03 mol), Na+ (0,1 mol) và HCO3- thu được m gam kết tủa. Giá trị của m là
Đáp án : D Phương pháp giải :
+Bảo toàn điện tích để tìm được ${{n}_{B{{a}^{2+}}}};\text{ }{{n}_{HCO_{3}^{-}}}$ + Viết phương trình ion rút gọn khi trộn dd X với Y, tính toán theo chất phản ứng hết: OH- + HCO3- → CO32- + H2O Ba2+ + CO32- → BaCO3↓ Lời giải chi tiết :
Bảo toàn điện tích với dd X ta có: $0,17.1=0,02.1+2.{{n}_{B{{a}^{2+}}}}\Rightarrow {{n}_{B{{a}^{2+}}}}~=0,075\text{ }\left( mol \right)$ Bảo toàn điện tích với dd Y ta có: $2.0,03+1.{{n}_{HCO_{3}^{-}}}~=0,1.1\Rightarrow {{n}_{HCO_{3}^{-}}}~=0,04\text{ }\left( mol \right)$ Trộn dd X với Y xảy ra phản ứng: OH- + HCO3- → CO32- + H2O 0,04 →0,04 → 0,04 (mol) Ba2+ + CO32- → BaCO3↓ 0,07 ←(0,03+0,04) → 0,07 (mol) => ${{m}_{\downarrow }}~={{m}_{BaC{{O}_{3}}}}=0,07.197=13,79\text{ }(gam)$
Câu 8 :
Trộn 100 ml dung dịch hỗn hợp gồm H2SO4 0,05M và HCl 0,1M với 100 ml dung dịch hỗn hợp gồm NaOH 0,2M và Ba(OH)2 0,1M thu được dung dịch X. Dung dịch X có pH là
Đáp án : A Phương pháp giải :
$\sum {{n}_{{{H}^{+}}}}~=2.{{n}_{{{H}_{2}}S{{O}_{4}}}}+{{n}_{HCl}}=?$ $\sum {{n}_{O{{H}^{-}}}}={{n}_{NaOH}}+2.{{n}_{Ba{{\left( OH \right)}_{2}}}}~=?$ PT ion rút gọn, tính toán theo chất phản ứng hết H+ + OH- → H2O pH = - log[H+] Lời giải chi tiết :
$\sum {{n}_{H+}}~=2.{{n}_{{{H}_{2}}S{{O}_{4}}}}+{{n}_{HCl}}=2.0,1.0,05+0,1.0,1=0,02\text{ }\left( mol \right)$ $\sum {{n}_{O{{H}^{-}}}}={{n}_{NaOH}}+2{{n}_{Ba{{\left( OH \right)}_{2}}}}=0,1.0,2+2.0,1.0,1=0,04\text{ }\left( mol \right)$ H+ + OH- → H2O 0,02 → 0,02 => nOH- dư = 0,04 – 0,02 = 0,02 (mol) => [OH-] = n: V = 0,02 : 0,2 = 0,01 M pH = 14 + log[OH-] = 14 + (-1) = 13
Câu 9 :
Trộn 300ml dung dịch có pH = 2 gồm HCl và HNO3 với 300ml dung dịch NaOH nồng độ a (mol/l) thu được 600 ml dung dịch có pH = 11. Giá trị của a là:
Đáp án : A Phương pháp giải :
+ Tính ∑nH+ ; + pH >7 => dư bazơ + pH = x => [H+] = 10-x + Viết phương trình ion rút gọn: H+ + OH- → H2O + Tính toán theo phương trình Lời giải chi tiết :
pH = 11 => OH- dư sau phản ứng => pOH = 3 => nOH- sau = Vsau . [OH-] = 10-3. 0,6 = 0,0006 = 6.10-4 (mol) pH = 2 => [H+] = 10-2 = 0,01M => nH+ = 0,3 . 0,01 = 0,003 nOH- = 0,3.a H+ + OH- → H2O Ban đầu: 0,003 0,3.a Phản ứng: 0,003 0,003 Sau: 0 0,3.a-0,003 => nOH- sau = 6.10-4 = 0,3a - 0,003 => a = 0,012M
Câu 10 :
Dung dịch X chứa 0,02 mol Al3+; 0,04 mol Mg2+; 0,04 mol NO3-; x mol Cl- và y mol Cu2+. Cho X tác dụng hết với dung dịch AgNO3 dư, thu được 17,22 gam kết tủa. Mặt khác, cho 170 ml dung dịch NaOH 1M vào X, thu được m gam kết tủa. Biết các phản ứng đều xảy ra hoàn toàn. Giá trị của m là
Đáp án : C Phương pháp giải :
${{n}_{\downarrow }}={{n}_{AgCl}}\Rightarrow {{n}_{C{{l}^{-}}}}$ BTĐT $\Rightarrow {{n}_{C{{u}^{2+}}}}$ Tính theo PTHH để tính khối lượng kết tủa Lời giải chi tiết :
${{n}_{\downarrow }}={{n}_{AgCl}}={{n}_{C{{l}^{-}}}}=x=\frac{17,22}{143,5}=0,12\text{ }mol$ BTĐT: $3{{n}_{A{{l}^{3+}}}}+2{{n}_{M{{g}^{2+}}}}+2{{n}_{C{{u}^{2+}}}}={{n}_{NO_{3}^{-}}}~+\text{ }{{n}_{C{{l}^{-}}}}$ => 3.0,02 + 0,04.2 + 2y = 0,04 + 0,12 => y = 0,01 Mg2++ 2OH- → Mg(OH)2 0,04→ 0,08 0,04 Cu2+ + 2OH- → Cu(OH)2 0,01→ 0,02 0,01 Al3+ + 3OH- → Al(OH)3 0,02→ 0,06 0,02 Al(OH)3 + OH- → AlO2- + H2O 0,01← 0,17-0,16 Vậy kết tủa gồm: 0,04 mol Mg(OH)2; 0,01 mol Cu(OH)2; 0,01 mol Al(OH)3. => m = 4,08 gam. Chú ý
Al(OH)3 tác dụng với NaOH dư nên lượng kết tủa bị hòa tan 1 phần
Câu 11 :
Thêm từ từ dung dịch HCl có pH = 0 vào dung dịch chứa 5,25 gam hỗn hợp muối cacbonnat của 2 kim loại kiềm kế tiếp nhau đến khi có 0,015 mol khí thoát ra thì dừng lại. Cho dung dịch thu được tác dụng với dung dịch Ca(OH)2 dư cho 3 gam kết tủa. Công thức của 2 muối và thể tích dung dịch HCl đã dùng là
Đáp án : D Lời giải chi tiết :
pH = 0 => CM(HCl) = 1M Dung dịch sau phản ứng + Ca(OH)2 dư tạo 3 g kết tủa => có tạo HCO3- : nHCO3 = nCaCO3 = 0,03 mol => nCO3 bđ = nCaCO3 + nCO2 = 0,045 mol => MM2CO3 = 116,67g => MM = 28,33 => Na2CO3 và K2CO3 2H+ + CO32- -> CO2 + H2O H+ + CO32- -> HCO3- ,nHCl = nHCO3+ 2nCO2 = 0,06 mol => Vdd HCl = 0,06 lit
Câu 12 :
Dung dịch X chứa 0,2 mol Ca2+; 0,08 mol Cl- ; z mol HCO3- và t mol NO3-. Cô cạn X rồi nung đến khối lượng không đổi, thu được 16,44 gam chất rắn Y. Nếu thêm t mol HNO3 vào X rồi đun dung dịch đến cạn thì thu được muối khan có khối lượng là
Đáp án : C Lời giải chi tiết :
Sau khi cô cạn và nung đến khối lượng không đổi X thì: 2HCO3- → CO32- + CO2 ↑ → O2- + CO2↑ NO3‑ → NO2- => chất rắn gồm: CaO, CaCl2, Ca(NO2)2 (0,2 mol Ca2+ ; 0,08 mol Cl- ; 0,5z mol O2- ; t mol NO2-) => mY = 16,44 gam = 0,2.40 + 0,08.35,5 + 0,5z.16 + 46t (1) Bảo toàn điện tích cho dung dịch X: 2nCa2+ = nCl- + nHCO3- + nNO3- => 2.0,2 = 0,08 + z + t (2) Từ (1) và (2) => z = 0,24 mol; t = 0,08 mol Khi cho t = 0,08 mol HNO3 vào X: HNO3 + HCO3- → CO2 +H2O + NO3‑ 0,08 → 0,08 (dư 0,24 - 0,08 = 0,16 mol) Dung dịch thu được chứa: Ca2+ (0,2 mol); Cl- (0,08 mol); HCO3- (0,16 mol); NO3- (0,08 + 0,08 = 0,16 mol) Khi đun đến cạn thì: 2HCO3- → CO32- + CO2 + H2O 0,16 → 0,08 Vậy chất rắn thu được chứa: Ca2+ (0,2 mol); Cl- (0,08 mol); CO32- (0,08 mol); NO3- (0,16 mol) => mrắn = mCa2+ + mCO3 2- + mNO3- + mCl- = 0,2.40 + 0,08.35,5 + 0,08.60 + 0,16.62 = 25,56g
Câu 13 :
Dung dịch X và dung dịchY là các dung dịch HCl với nồng độ mol tương ứng là C1 và C2 (Mol/lít), trong đó C1 > C2. Trộn 150 ml dung dịch X với 500 ml dung dịch Y, thu được dung dịch Z. Để trung hòa 1/10 dung dịch Z cần 10 ml dung dịch hỗn hợp NaOH 1 M và Ba(OH)2 0,25 M. Mặt khác lấy V1 lít dung dịch X chứa 0,05 mol HCl trộn với V2 lít dung dịch Y chứa 0,15 mol HCl thu được 1,1 lít dung dịch. Giá trị của C1 và C2 tương ứng là:
Đáp án : A Lời giải chi tiết :
Câu 14 :
Cho a gam dung dịch H2SO4 loãng nồng độ C% tác dụng hoàn toàn với hỗn hợp 2 kim loại K và Fe (Lấy dư so với lượng phản ứng). Sau phản ứng, khối lượng khí sinh ra là 0,04694a gam. Giá trị của C% là :
Đáp án : D Lời giải chi tiết :
Câu 15 :
Dung dịch X chứa các ion: Na+, Ba2+ và HCO3-. Chia X thành ba phần bằng nhau. Phần một tác dụng với KOH dư, được m gam kết tủa. Phần hai tác dụng với Ba(OH)2 dư, được 4m gam kết tủa. Đun sôi đến cạn phần ba, thu được V1 lít CO2 (đktc) và chất rắn Y. Nung Y đến khối lượng không đổi, thu được thêm V2 lít CO2 (đktc). Tỉ lệ V1 : V2 bằng
Đáp án : C Lời giải chi tiết :
Câu 16 :
Cho a mol Mg và b mol Zn vào dung dịch chứa c mol Cu2+ và d mol Ag+. Sau khi phản ứng kết thúc thu được dung dịch chứa 2 ion kim loại. Điều kiện về b (so với a, c, d) để được kết quả này là:
Đáp án : D Lời giải chi tiết :
Trình tự phản ứng: - Thứ tự phản ứng của KL: Mg, Zn - Thứ tự phản ứng của ion KL: Ag+, Cu2+ Theo đề bài sau phản ứng có 2 ion KL => Đó là Mg2+, Zn2+ + Cu2+, Ag+ hết (vì nếu ko hết thì dd sau pư có nhiều hơn 2 ion KL) + Mg hết (vì Mg hết thì mới đến lượt Zn phản ứng tạo Zn2+) + Zn có thể vừa đủ hoặc dư Như vậy: 2nMg + 2nZn ≥ nAg+ + 2nCu2+ hay 2a + 2b ≥ d + 2c => b ≥ c - a + d/2
|














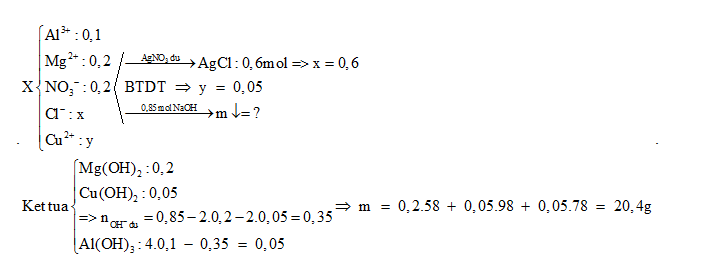

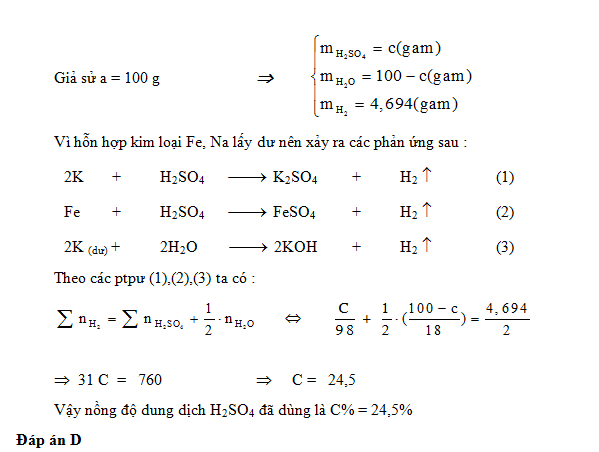
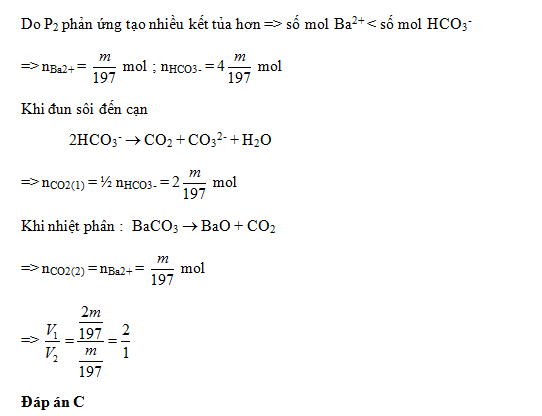





Danh sách bình luận