Trắc nghiệm Bài 9. Axit nitric và muối nitrat - Hóa 11Đề bài
Câu 1 :
Trong phân tử HNO3 nguyên tử N có :
Câu 2 :
HNO3 tinh khiết là chất lỏng không màu, nhưng dung dịch HNO3 để lâu thường ngả sang màu vàng là do
Câu 3 :
Các tính chất hoá học của HNO3 là :
Câu 4 :
Dãy gồm tất cả các chất khi tác dụng với HNO3 mà HNO3 chỉ thể hiện tính acid là :
Câu 5 :
Nước cường toan là hỗn hợp của HNO3 đặc và HCl đặc có tỉ lệ thể tích lần lượt là :
Câu 6 :
Nhiệt phân hoàn toàn Fe(NO3)2 trong không khí thu được sản phẩm gồm :
Câu 7 :
Khi bị nhiệt phân dãy muối nitrat nào sau đây cho sản phẩm là oxit kim loại, khí nitơ đioxit và oxi ?
Câu 8 :
Tiến hành nhiệt phân hoàn toàn 1 mol chất rắn nào sau đây mà khối lượng chất rắn thu được sau phản ứng là lớn nhất ?
Câu 9 :
Phản ứng nhiệt phân không đúng là :
Câu 10 :
Kim loại Cu có thể bị hoà tan trong hỗn hợp dung dịch nào
Câu 11 :
Để nhận biết ion NO3- người ta thường dùng Cu và dung dịch H2SO4 loãng và đun nóng, bởi vì :
Câu 12 :
Khi cho kim loại Fe phản ứng với HNO3 tạo thành khí độc hại. Biện pháp nào xử lý tốt nhất để chống ô nhiễm môi trường ?
Câu 13 :
Trong phòng thí nghiệm HNO3 được điều chế theo phản ứng sau : NaNO3 (rắn) + H2SO4 (đặc) → HNO3 + NaHSO4 Phản ứng trên xảy ra là vì :
Câu 14 :
Cho hai muối X, Y thỏa mãn điều kiện sau : X + Y → không xảy ra phản ứng X + Cu → không xảy ra phản ứng Y + Cu → không xảy ra phản ứng X + Y + Cu → xảy ra phản ứng X, Y là muối nào dưới đây ?
Câu 15 :
Cho các dung dịch : X1 : dung dịch HCl X2 : dung dịch KNO3 X3 : dung dịch HCl + KNO3 X4 : dung dịch Fe2(SO4)3 Các dung dịch không thể hòa tan được bột Cu là :
Câu 16 :
Cho các mệnh đề sau : 1) Các muối nitrat đều tan trong nước và đều là chất điện li mạnh. 2) Ion NO3- có tính oxi hóa trong môi trường axit. 3) Khi nhiệt phân muối nitrat rắn ta đều thu được khí NO2. 4) Hầu hết muối nitrat đều bền nhiệt. Các mệnh đề đúng là :
Câu 17 :
Cho các phản ứng sau : (1) nhiệt phân Cu(NO3)2; (2) nhiệt phân NH4NO2; (3) NH3 + O2 (t0, xt); (4) NH3 + Cl2; (5) nhiệt phân NH4Cl; (6) NH3 + CuO. Các phản ứng tạo ra được N2 là
Câu 18 :
Phân biệt ba dung dịch axit NaCl ; NaNO3 và Na3PO4 bằng :
Câu 19 :
Phân biệt 5 dung dịch riêng biệt sau : NH4NO3 ; (NH4)2SO4 ; NaCl ; Mg(NO3)2 và FeCl2 bằng
Câu 20 :
Đem nung một lượng Cu(NO3)2 sau một thời gian thì dừng lại làm nguội rồi cân thấy khối lượng giảm 0,54 gam. Khối lượng muối đã bị nhiệt phân là
Câu 21 :
Nhiệt phân hết 9,4 gam một muối nitrat của kim loại M được 4 gam chất rắn là oxit kim loại. Kim loại M là
Câu 22 :
Nung nóng hết 27,3 gam hỗn hợp X gồm NaNO3 và Cu(NO3)2 rồi hấp thụ toàn bộ khí thu được vào H2O thấy có 1,12 lít khí (đktc) bay ra. Khối lượng Cu(NO3)2 trong X là
Câu 23 :
Nhiệt phân một lượng AgNO3 được chất rắn X và hỗn hợp khí Y. Dẫn toàn bộ Y vào một lượng dư H2O, thu được dung dịch Z. Cho toàn bộ X vào Z, X chỉ tan một phần và thoát ra khí NO (sản phẩm khử duy nhất). Biết các phản ứng xảy ra hoàn toàn. Phần trăm khối lượng của X đã phản ứng là
Câu 24 :
Từ 34 tấn NH3 điều chế được 160 tấn dung dịch HNO3 63%. Hiệu suất của cả quá trình tổng hợp là
Câu 25 :
Thí nghiệm với dung dịch HNO3 thường sinh ra khí độc NO2. Để hạn chế khí NO2 thoát ra từ ống nghiệm, người ta nút ống nghiệm bằng (a) bông khô (b) bông có tẩm nước (c) bông có tẩm nước vôi trong (d) bông có tẩm giấm ăn Trong 4 biện pháp trên, biện pháp có hiệu quả nhất là:
Câu 26 :
Những kim loại nào sau đây không tác dụng được với dung dịch HNO3 đặc, nguội
Câu 27 :
Cho bột Fe vào dung dịch AgNO3 dư, sau khi kết thúc thí nghiệm thu được dung dịch X gồm:
Câu 28 :
Hòa tan hoàn toàn m gam P2O5 vào dung dịch chứa 0,7 mol NaOH, sau phản ứng thu được dung dịch chỉ chứa 2,1033m gam muối. Tỉ lệ mol của P2O5 và NaOH gần nhất với:
Câu 29 :
Nhiệt phân hoàn toàn 37,8 gam muối nitrat có hóa trị không đổi thu được oxit kim loại và 11,2 lít hỗn hợp khí (đktc) có khối lượng 21,6 gam. Công thức của muối nitrat là
Câu 30 :
Nhiệt phân hoàn toàn 22,2 gam muối nitrat của kim loại có hóa trị không đổi thu được oxit kim loại và hỗn hợp khí X. Hòa tan hỗn hợp khí X trong 3 lít nước thu được dung dịch axit có pH = 1. Công thức hóa học của muối là
Câu 32 :
Nhiệt phân hoàn toàn 52,8 gam hỗn hợp Cu(NO3)2; AgNO3 thu được chất rắn X. Hòa tan X trong dung dịch HNO3 dư thấy thoát ra 4,48 lít khí NO2 (đktc). Khối lượng Cu(NO3)2 trong hỗn hợp là
Câu 33 :
Nhiệt phân hoàn toàn 28,2 gam muối nitrat của kim loại hóa trị không đổi thu được oxit kim loại và thấy khối lượng chất rắn giảm 16,2 gam so với lượng ban đầu. Công thức của muối nitrat là
Câu 34 :
Để 26,88 gam phôi Fe ngoài không khí một thời gian, thu được hỗn hợp rắn X gồm Fe và các oxit. Hòa tan hết X trong 288 gam dung dịch HNO3 31,5%, thu được dung dịch Y chứa các muối và hỗn hợp khí Z gồm 2 khí, trong đó oxi chiếm 61,11% về khối lượng. Cô cạn Y, rồi nung đến khối lượng không đổi thấy khối lượng chất rắn giảm 67,84 gam. Xác định nồng độ % Fe(NO3)3 trong Y?
Câu 35 :
Nhiệt phân hoàn toàn hỗn hợp chất rắn X gồm Cu(NO3)2 và AgNO3. Hỗn hợp khí thu được cho lội qua nước lạnh thu được dung dịch Y và 168ml khí Z không màu (ở điều kiện tiêu chuẩn). Cho Y tác dụng với lượng vừa đủ dung dịch NaOH thu được dung dịch chứa 9,35 gam một muối. Phần trăm khối lượng AgNO3 trong X là (Cho biết nguyên tử khối của các nguyên tố: H = 1; N = 14; O = 16; Na = 23; Cu = 64; Ag = 108.)
Lời giải và đáp án
Câu 1 :
Trong phân tử HNO3 nguyên tử N có :
Đáp án : B Phương pháp giải :
Xem lại lí thuyết axit nitric và muối nitrat Lời giải chi tiết :
Trong phân tử HNO3 nguyên tử N có : hoá trị IV, số oxi hoá +5.
Câu 2 :
HNO3 tinh khiết là chất lỏng không màu, nhưng dung dịch HNO3 để lâu thường ngả sang màu vàng là do
Đáp án : D Lời giải chi tiết :
HNO3 tinh khiết là chất lỏng không màu, nhưng dung dịch HNO3 để lâu thường ngả sang màu vàng là do dung dịch HNO3 bị phân hủy 1 phần tạo thành một lượng nhỏ NO2.
Câu 3 :
Các tính chất hoá học của HNO3 là :
Đáp án : B Lời giải chi tiết :
Các tính chất hoá học của HNO3 là : tính axit mạnh, tính oxi hóa mạnh và bị phân huỷ.
Câu 4 :
Dãy gồm tất cả các chất khi tác dụng với HNO3 mà HNO3 chỉ thể hiện tính acid là :
Đáp án : C Phương pháp giải :
Dựa vào tính chất hoá học của HNO3 Lời giải chi tiết :
HNO3 chỉ thể hiện tính acid là không có phản ứng oxi hóa – khử => các chất đều đã đạt số oxi hóa tối đa
Câu 5 :
Nước cường toan là hỗn hợp của HNO3 đặc và HCl đặc có tỉ lệ thể tích lần lượt là :
Đáp án : D Phương pháp giải :
Xem lại lí thuyết axit nitric và muối nitrat Lời giải chi tiết :
Nước cường toan là hỗn hợp của HNO3 đặc và HCl đặc có tỉ lệ thể tích 1 : 3
Câu 6 :
Nhiệt phân hoàn toàn Fe(NO3)2 trong không khí thu được sản phẩm gồm :
Đáp án : C Lời giải chi tiết :
4Fe(NO3)2 $\xrightarrow{{{t}^{o}}}$ 2Fe2O3 + 8NO2 + O2
Câu 7 :
Khi bị nhiệt phân dãy muối nitrat nào sau đây cho sản phẩm là oxit kim loại, khí nitơ đioxit và oxi ?
Đáp án : C Lời giải chi tiết :
Nhiệt phân các muối của các kim loại từ Mg đến Cu thu được oxit kim loại, khí NO2và O2
Câu 8 :
Tiến hành nhiệt phân hoàn toàn 1 mol chất rắn nào sau đây mà khối lượng chất rắn thu được sau phản ứng là lớn nhất ?
Đáp án : D Lời giải chi tiết :
Mg(NO3)2 → MgO => mMgO = 40 NH4NO3 và NH4NO2 không tạo chất rắn KNO3 → KNO2 => mKNO2 = 85
Câu 9 :
Phản ứng nhiệt phân không đúng là :
Đáp án : B Lời giải chi tiết :
B sai vì: NH4NO3 $\xrightarrow{{{t}^{o}}}$ N2O + 2H2O
Câu 10 :
Kim loại Cu có thể bị hoà tan trong hỗn hợp dung dịch nào
Đáp án : B Lời giải chi tiết :
Kim loại Cu có thể bị hoà tan trong hỗn hợp dung dịch NaNO3 và HCl
Câu 11 :
Để nhận biết ion NO3- người ta thường dùng Cu và dung dịch H2SO4 loãng và đun nóng, bởi vì :
Đáp án : D Lời giải chi tiết :
Để nhận biết ion NO3- người ta thường dùng Cu và dung dịch H2SO4 loãng và đun nóng, bởi vì tạo ra khí không màu, hoá nâu trong không khí.
Câu 12 :
Khi cho kim loại Fe phản ứng với HNO3 tạo thành khí độc hại. Biện pháp nào xử lý tốt nhất để chống ô nhiễm môi trường ?
Đáp án : D Phương pháp giải :
Xem lại lí thuyết axit nitric và muối nitrat Lời giải chi tiết :
Khí sinh ra là NO2 => cần dung dịch kiềm để hấp thụ => nút ống nghiệm bằng bông tẩm xút.
Câu 13 :
Trong phòng thí nghiệm HNO3 được điều chế theo phản ứng sau : NaNO3 (rắn) + H2SO4 (đặc) → HNO3 + NaHSO4 Phản ứng trên xảy ra là vì :
Đáp án : B Lời giải chi tiết :
Vì HNO3 dễ bay hơi => làm giảm lượng HNO3 trong bình => phản ứng làm tăng lượng HNO3 (chiều thuận)
Câu 14 :
Cho hai muối X, Y thỏa mãn điều kiện sau : X + Y → không xảy ra phản ứng X + Cu → không xảy ra phản ứng Y + Cu → không xảy ra phản ứng X + Y + Cu → xảy ra phản ứng X, Y là muối nào dưới đây ?
Đáp án : B Lời giải chi tiết :
X không phản ứng với Cu => loại C vì Fe(NO3)3 phản ứng với Cu X + Y + Cu → xảy ra phản ứng => trong X chứa NO3- và Y chứa H+ Loại A vì NaHCO3 không có môi trường axit mạnh
Câu 15 :
Cho các dung dịch : X1 : dung dịch HCl X2 : dung dịch KNO3 X3 : dung dịch HCl + KNO3 X4 : dung dịch Fe2(SO4)3 Các dung dịch không thể hòa tan được bột Cu là :
Đáp án : D Phương pháp giải :
Xem lại lí thuyết axit nitric và muối nitrat Lời giải chi tiết :
Các dung dịch không thể hòa tan được bột Cu là : HCl; KNO3
Câu 16 :
Cho các mệnh đề sau : 1) Các muối nitrat đều tan trong nước và đều là chất điện li mạnh. 2) Ion NO3- có tính oxi hóa trong môi trường axit. 3) Khi nhiệt phân muối nitrat rắn ta đều thu được khí NO2. 4) Hầu hết muối nitrat đều bền nhiệt. Các mệnh đề đúng là :
Đáp án : D Lời giải chi tiết :
Các mệnh đề đúng là: (1) và (2) (3) sai vì muối nitrat của K, Na, Ba, Ca nhiệt phân không thu được khí NO2 (4) sai vì các muối nitrat hầu hết kém bền nhiệt
Câu 17 :
Cho các phản ứng sau : (1) nhiệt phân Cu(NO3)2; (2) nhiệt phân NH4NO2; (3) NH3 + O2 (t0, xt); (4) NH3 + Cl2; (5) nhiệt phân NH4Cl; (6) NH3 + CuO. Các phản ứng tạo ra được N2 là
Đáp án : D Lời giải chi tiết :
(1) 2Cu(NO3)2 $\xrightarrow{{{t}^{o}}}$ 2CuO + 4NO2 + O2 (2) NH4NO2 $\xrightarrow{{{t}^{o}}}$ N2 + 2H2O (3) 2NH3 + 5/2O2 $\xrightarrow{{{t}^{o}},xt}$ 2NO + 3H2O (4) 2NH3 + 3Cl2 → N2 + 6HCl (5) NH4Cl $\xrightarrow{{{t}^{o}}}$ NH3 + HCl (6) 2NH3 + 3CuO $\xrightarrow{{{t}^{o}}}$ N2 + 3Cu + 3H2O
Câu 18 :
Phân biệt ba dung dịch axit NaCl ; NaNO3 và Na3PO4 bằng :
Đáp án : D Lời giải chi tiết :
Phân biệt ba dung dịch axit NaCl ; NaNO3 và Na3PO4 bằng AgNO3 + NaCl tạo kết tủa trắng + Na3PO4 tạo kết tủa vàng + NaNO3 không hiện tượng
Câu 19 :
Phân biệt 5 dung dịch riêng biệt sau : NH4NO3 ; (NH4)2SO4 ; NaCl ; Mg(NO3)2 và FeCl2 bằng
Đáp án : C Lời giải chi tiết :
- dùng Ba(OH)2
Câu 20 :
Đem nung một lượng Cu(NO3)2 sau một thời gian thì dừng lại làm nguội rồi cân thấy khối lượng giảm 0,54 gam. Khối lượng muối đã bị nhiệt phân là
Đáp án : D Phương pháp giải :
+) Gọi số mol Cu(NO3)2 là x => tính số mol các khí theo x +) mgiảm = mkhí sinh ra = mNO2 + mO2 => tính x Lời giải chi tiết :
2Cu(NO3)2 $\xrightarrow{{{t}^{o}}}$ 2CuO + 4NO2 + O2 x → x → 2x → 0,5x mgiảm = mkhí sinh ra = mNO2 + mO2 => 2x.46 + 0,5x.32 = 0,54 => x = 0,005 mol => mCu(NO3)2 = 0,94 gam
Câu 21 :
Nhiệt phân hết 9,4 gam một muối nitrat của kim loại M được 4 gam chất rắn là oxit kim loại. Kim loại M là
Đáp án : B Phương pháp giải :
TH1: Nếu muối nitrat của M là Fe(NO3)2 Xét số mol Fe(NO3)2 và số mol Fe2O3 có phù hợp không => loại TH2: Muối nitrat có hóa trị không đổi khi nhiệt phân 2M(NO3)n → M2On + 2nNO2 + n/2O2 $=>\,\,\frac{4,7}{M+62n}\,\,=\,\,\frac{4}{2M+16n}$ Lời giải chi tiết :
TH1: Nếu muối nitrat của M là Fe(NO3)2 4Fe(NO3)2 → 2Fe2O3 + 8NO2 + O2 47/900 mol 0,025 mol => loại TH2: Muối nitrat có hóa trị không đổi khi nhiệt phân 2M(NO3)n → M2On + 2nNO2 + n/2O2 $\frac{9,4}{M+62n}$ → $\frac{4,7}{M+62n}$ $=>\,\,\frac{4,7}{M+62n}\,\,=\,\,\frac{4}{2M+16n}=>M=32n$ Với n = 2 => M = 64 => M là Cu
Câu 22 :
Nung nóng hết 27,3 gam hỗn hợp X gồm NaNO3 và Cu(NO3)2 rồi hấp thụ toàn bộ khí thu được vào H2O thấy có 1,12 lít khí (đktc) bay ra. Khối lượng Cu(NO3)2 trong X là
Đáp án : A Phương pháp giải :
+) mhỗn hợp = PT (1) 2NaNO3 $\xrightarrow{{{t}^{o}}}$ 2NaNO2 + O2 a → 0,5a 2Cu(NO3)2 $\xrightarrow{{{t}^{o}}}$ 2CuO + 4NO2 + O2 b → 2b → 0,5b 4NO2 + O2 + 2H2O → 4HNO3 2b → 0,5b +) Tính số mol khí thu được => số mol khí còn lại => a Lời giải chi tiết :
Gọi nNaNO3 = a mol; nCu(NO3)2 = b mol => mhỗn hợp = 85a + 188b = 27,3 (1) 2NaNO3 $\xrightarrow{{{t}^{o}}}$ 2NaNO2 + O2 a → 0,5a 2Cu(NO3)2 $\xrightarrow{{{t}^{o}}}$ 2CuO + 4NO2 + O2 b → 2b → 0,5b Hấp thụ khí vào nước: 4NO2 + O2 + 2H2O → 4HNO3 2b → 0,5b => nkhí còn lại = 0,5a = 0,05 => a = 0,1 Thay a = 0,1 vào (1) => b = 0,1 => mCu(NO3)2 = 0,1.188 = 18,8 gam
Câu 23 :
Nhiệt phân một lượng AgNO3 được chất rắn X và hỗn hợp khí Y. Dẫn toàn bộ Y vào một lượng dư H2O, thu được dung dịch Z. Cho toàn bộ X vào Z, X chỉ tan một phần và thoát ra khí NO (sản phẩm khử duy nhất). Biết các phản ứng xảy ra hoàn toàn. Phần trăm khối lượng của X đã phản ứng là
Đáp án : D Phương pháp giải :
2AgNO3 $\xrightarrow{{{t}^{o}}}$ 2Ag + 2NO2 + O2 4NO2 + O2 + 2H2O → 4HNO3 => nAg = nHNO3 3Ag + 4HNO3 → 3AgNO3 + NO + 2H2O Lời giải chi tiết :
2AgNO3 $\xrightarrow{{{t}^{o}}}$ 2Ag + 2NO2 + O2 x → x → x → 0,5x 4NO2 + O2 + 2H2O → 4HNO3 x → 0,25x → x => nAg = nHNO3 = x mol 3Ag + 4HNO3 → 3AgNO3 + NO + 2H2O 0,75x ← x => %mAg phản ứng = 75%
Câu 24 :
Từ 34 tấn NH3 điều chế được 160 tấn dung dịch HNO3 63%. Hiệu suất của cả quá trình tổng hợp là
Đáp án : C Phương pháp giải :
+) Tính sơ đồ phản ứng: NH3 → HNO3 +) Tính số mol HNO3 thực tế +) Tính số mol HNO3 lí thuyết theo số mol NH3 Lời giải chi tiết :
mHNO3 = 160.63/100 = 100,8 tấn => nHNO3 = 1,6.106 mol nNH3 = 2.106 mol NH3 → HNO3 Lí thuyết: 2.106 → 2.106 Thực tế: 2.106 1,6.106 => hiệu suất phản ứng là: H = $\frac{{{n}_{TT}}}{{{n}_{LT}}}.100\%=\frac{1,{{6.10}^{6}}}{{{2.10}^{6}}}=80\%$
Câu 25 :
Thí nghiệm với dung dịch HNO3 thường sinh ra khí độc NO2. Để hạn chế khí NO2 thoát ra từ ống nghiệm, người ta nút ống nghiệm bằng (a) bông khô (b) bông có tẩm nước (c) bông có tẩm nước vôi trong (d) bông có tẩm giấm ăn Trong 4 biện pháp trên, biện pháp có hiệu quả nhất là:
Đáp án : D Phương pháp giải :
Để ngăn khí độc ta dùng hóa chất phản ứng với khí đó tạo thành chất không độc. Lời giải chi tiết :
Trong 4 biện pháp trên, biện pháp có hiệu quả nhất là dùng bông có tẩm nước vôi trong để nút vào ống nghiệm. 2Ca(OH)2 + 4NO2 → Ca(NO3)2 + Ca(NO2)2 + 2H2O
Câu 26 :
Những kim loại nào sau đây không tác dụng được với dung dịch HNO3 đặc, nguội
Đáp án : A Phương pháp giải :
Ghi nhớ một số KL bị thụ động với HNO3 đặc nguội như Al, Fe, Cr Lời giải chi tiết :
Al, Fe là những kim loại bị thụ động với HNO3 đặc nguội
Câu 27 :
Cho bột Fe vào dung dịch AgNO3 dư, sau khi kết thúc thí nghiệm thu được dung dịch X gồm:
Đáp án : C Lời giải chi tiết :
2AgNO3 + Fe → 2Ag + Fe(NO3)2 AgNO3 + Fe(NO3)2 → Ag + Fe(NO3)3
Câu 28 :
Hòa tan hoàn toàn m gam P2O5 vào dung dịch chứa 0,7 mol NaOH, sau phản ứng thu được dung dịch chỉ chứa 2,1033m gam muối. Tỉ lệ mol của P2O5 và NaOH gần nhất với:
Đáp án : A Phương pháp giải :
P2O5 + 3H2O → 2 H3PO4 NaOH + H3PO4 → NaH2PO4 + H2O 2NaOH + H3PO4 → Na2HPO4 + 2H2O 3NaOH + H3PO4 → Na3PO4 + 3H2O Vì dung dịch sau phản ứng chỉ chứa muối nên ta có: nH2O = nNaOH Áp dụng định luật bảo toàn khối lượng ta tính được khối lượng H3PO4, từ đó tính được giá trị m và tỉ lệ mol của P2O5 và NaOH. Lời giải chi tiết :
P2O5 + 3H2O → 2 H3PO4 m/142 2m/142 mol NaOH + H3PO4 → NaH2PO4 + H2O 2NaOH + H3PO4 → Na2HPO4 + 2H2O 3NaOH + H3PO4 → Na3PO4 + 3H2O Vì dung dịch sau phản ứng chỉ chứa muối nên ta có: nH2O = nNaOH = 0,7 (mol) Áp dụng định luật bảo toàn khối lượng ta có: mNaOH + mH3PO4 = mmuối + mH2O → 0,7.40 + (2m/142).98 = 2,1033m + 0,7.18 → m = 21,3 gam → nP2O5 = 0,15 mol. Do đó ta có tỉ lệ \(\frac{{{n_{P2O5}}}}{{{n_{NaOH}}}} = \frac{{0,15}}{{0,7}} = 0,214\)
Câu 29 :
Nhiệt phân hoàn toàn 37,8 gam muối nitrat có hóa trị không đổi thu được oxit kim loại và 11,2 lít hỗn hợp khí (đktc) có khối lượng 21,6 gam. Công thức của muối nitrat là
Đáp án : C Phương pháp giải :
Bước 1: Tính số mol mỗi khí trong hỗn hợp ban đầu Nhiệt phân muối nitrat thu được hỗn hợp khí gồm NO2 (a mol) và O2 (b mol): nkhí = a + b (1); mkhí = 46a + 32b (2) => a, b Bước 2: Viết PTHH tìm số mol muối nitrat 2M(NO3)n → M2On + 2nNO2 + 0,5nO2. Đặt mol khí vào phương trình suy ra số mol muối nitrat. Bước 3: Lập phương trình mối liên hệ giữa M và n. Biện luận với n = 1; 2; 3. Lời giải chi tiết :
Bước 1: Tính số mol mỗi khí trong hỗn hợp ban đầu Xét hỗn hợp khí gồm NO2 (a mol) và O2 (b mol): ⟹ nkhí = a + b = 0,5 (1) ⟹ mkhí = 46a + 32b = 21,6 (2) Giải hệ trên được a = 0,4 và b = 0,1 Bước 2: Viết PTHH tìm số mol muối nitrat 2M(NO3)n → M2On + 2nNO2 + 0,5nO2 0,4/n ← 0,4 Bước 3: Lập phương trình mối liên hệ giữa M và n. Biện luận với n = 1; 2; 3. ⟹ mmuối = 0,4/n.(M + 62n) = 37,8 ⟹ M = 32,5n Biện luận với n = 1, 2, 3: + Nếu n = 1 ⟹ M = 32,5 (loại). + Nếu n = 2 ⟹ M = 65 (Zn). + Nếu n = 3 ⟹ M = 97,5 (loại). Vậy công thức của muối nitrat là Zn(NO3)2.
Câu 30 :
Nhiệt phân hoàn toàn 22,2 gam muối nitrat của kim loại có hóa trị không đổi thu được oxit kim loại và hỗn hợp khí X. Hòa tan hỗn hợp khí X trong 3 lít nước thu được dung dịch axit có pH = 1. Công thức hóa học của muối là
Đáp án : B Phương pháp giải :
Bước 1: Tính số mol HNO3 Từ giá trị pH ⟹ nHNO3 Bước 2: Tính số mol muối nitrat 2NO2 + 0,5O2 + H2O → 2HNO3 2M(NO3)n → M2On + 2nNO2 + 0,5nO2 nHNO3 ⟹ nNO2 ⟹ nmuối nitrat Bước 3: Biện luận tìm muối nitrat + Từ khối lượng muối và số mol muối nitrat M(NO3)n lập được mối liên hệ giữa M và n. + Biện luận với n = 1; 2; 3. Chọn giá trị (n; M) thỏa mãn. Lời giải chi tiết :
Bước 1: Tính số mol HNO3 pH = 1 ⟹ [H+] = 0,1M = CM HNO3 ⟹ nHNO3 = 0,3 mol Bước 2: Tính số mol muối nitrat 2NO2 + 0,5O2 + H2O → 2HNO3 0,3 ← 0,3 2M(NO3)n → M2On + 2nNO2 + 0,5nO2 0,3/n ← 0,3 Bước 3: Biện luận tìm muối nitrat ⟹ Mmuối = 22,2 : (0,3/n) = 74n ⟹ M + 62n = 74n ⟹ M = 12n Biện luận với n = 1; 2; 3 ta có: + n = 1 ⟹ M = 12 (loại) + n = 2 ⟹ M = 24 (Mg) + n = 3 ⟹ M = 36 (loại) Vậy muối có công thức là Mg(NO3)2.
Đáp án : B Phương pháp giải :
Bước 1: Xác định thành phần chất Y Viết PTHH phản ứng nhiệt phân muối nitrat, xác định Y ⟹ Chất rắn Y gồm Fe2O3 và Al2O3. Bước 2: Tính nFe2O3 và nAl2O3 - Cho Y vào NaOH thì chỉ có Al2O3 phản ứng; từ nNaOH ⟹ nAl2O3 - Từ khối lượng chất rắn Y ⟹ mFe2O3 ⟹ nFe2O3 Bước 3: Tính m gam hh Al(NO3)3 và Fe(NO3)2 - BTNT Fe: nFe(NO3)2 = 2nFe2O3 ⟹ mFe(NO3)2 BTNT Al: nAl(NO3)3 = 2nAl2O3 ⟹ mAl(NO3)3 - Tính giá trị của m. Lời giải chi tiết :
Bước 1: Xác định thành phần chất Y 2Fe(NO3)2 → Fe2O3 + 4NO2 + 0,5O2 4Al(NO3)3 → 2Al2O3 + 12NO2 + 3O2 ⟹ Chất rắn Y gồm Fe2O3 và Al2O3 Bước 2: Tính nFe2O3 và nAl2O3 Khi cho Y vào NaOH thì chỉ có Al2O3 phản ứng 2NaOH + Al2O3 → 2NaAlO2 + H2O. 0,3 → 0,15 ⟹ mAl2O3 = 102.0,15 = 15,3 gam ⟹ mFe2O3 = mchất rắn - mAl2O3 = 47,3 - 15,3 = 32 gam ⟹ nFe2O3 = 0,2 mol Bước 3: Tính m gam hh Al(NO3)3 và Fe(NO3)2 Bảo toàn nguyên tố Fe ⟹ nFe(NO3)2 = 2nFe2O3 = 0,4 mol ⟹ mFe(NO3)2 = 72 gam Bảo toàn nguyên tố Al ⟹ nAl(NO3)3 = 2nAl2O3 = 0,3 mol ⟹ mAl(NO3)3 = 63,9 gam ⟹ m = mFe(NO3)2 + mAl(NO3)3 = 135,9 gam.
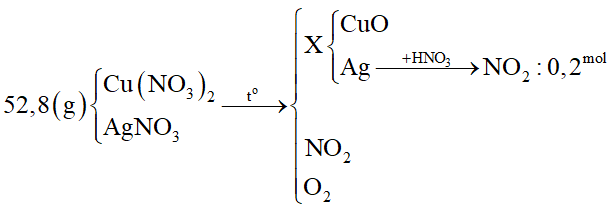
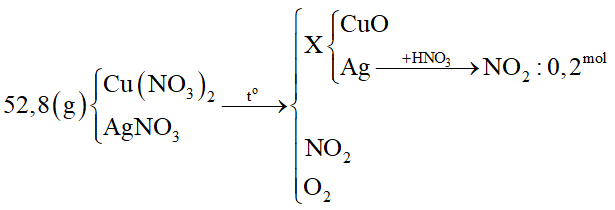
Câu 32 :
Nhiệt phân hoàn toàn 52,8 gam hỗn hợp Cu(NO3)2; AgNO3 thu được chất rắn X. Hòa tan X trong dung dịch HNO3 dư thấy thoát ra 4,48 lít khí NO2 (đktc). Khối lượng Cu(NO3)2 trong hỗn hợp là
Đáp án : B Phương pháp giải :
Bước 1: Viết sơ đồ tóm tắt
Bước 2: Tính nAg - Khi cho X phản ứng với HNO3 dư thì chỉ có phản ứng oxi hóa - khử giữa Ag và HNO3: - Viết các bán phản ứng trao đổi e của Ag và N+5 - Tính số mol NO2 suy ra số mol Ag. Bước 3: Tính khối lượng Cu(NO3)2 - Bảo toàn nguyên tố Ag suy ra số mol AgNO3 ⟹ khối lượng AgNO3 Lời giải chi tiết :
Bước 1: Viết sơ đồ tóm tắt
Bước 2: Tính nAg - Khi cho X phản ứng với HNO3 dư thì chỉ có phản ứng oxi hóa - khử giữa Ag và HNO3: N+5 + 1e → N+4 0,2 ← 0,2 Ag → Ag+ + 1e 0,2 ← 0,2 Bước 3: Tính khối lượng Cu(NO3)2 - Bảo toàn Ag ⟹ nAgNO3 = nAg = 0,2 mol ⟹ mAgNO3 = 0,2.170 = 34 gam ⟹ mCu(NO3)2 = mhh – mAgNO3 = 52,8 - 34 = 18,8 gam.
Câu 33 :
Nhiệt phân hoàn toàn 28,2 gam muối nitrat của kim loại hóa trị không đổi thu được oxit kim loại và thấy khối lượng chất rắn giảm 16,2 gam so với lượng ban đầu. Công thức của muối nitrat là
Đáp án : B Phương pháp giải :
Bước 1: Tính nNO2 Gọi số mol khí NO2 là a (mol) - Viết PTPƯ nhiệt phân: 2M(NO3)n → M2On + 2nNO2 + n/2 O2 - Khối lượng chất rắn giảm bằng khối lượng khí sinh ra: mchất rắn giảm = mNO2 + mO2 ⟹ a = nNO2 Bước 2: Tính nmuối nitrat - Theo PTPƯ: nmuối nitrat = a/n Bước 3: Tìm CT muối nitrat - Lập biểu thức tính Mmuối = mmuối/nmuối Lời giải chi tiết :
Bước 1: Tính nNO2 Gọi số mol khí NO2 là a (mol) 2M(NO3)n → M2On + 2nNO2 + n/2 O2 a/n ← a → 0,25a Ta có: mchất rắn giảm = mNO2 + mO2 ⟹ 46.a + 32.0,25a = 16,2 ⟹ a = 0,3 mol Bước 2: Tính nmuối nitrat - Theo PTPƯ: nmuối nitrat = a/n = 0,3/n mol Bước 3: Tìm CT muối nitrat - Mmuối = 28,2 : (0,3/n) = 94n ⟹ M + 62n = 94n ⟹ M = 32n - Biện luận với n = 1; 2; 3 ta có: + n = 1 ⟹ M = 32 (loại) + n = 2 ⟹ M = 64 (Cu) + n = 3 ⟹ M = 96 (loại) Vậy muối có công thức là Cu(NO3)2.
Câu 34 :
Để 26,88 gam phôi Fe ngoài không khí một thời gian, thu được hỗn hợp rắn X gồm Fe và các oxit. Hòa tan hết X trong 288 gam dung dịch HNO3 31,5%, thu được dung dịch Y chứa các muối và hỗn hợp khí Z gồm 2 khí, trong đó oxi chiếm 61,11% về khối lượng. Cô cạn Y, rồi nung đến khối lượng không đổi thấy khối lượng chất rắn giảm 67,84 gam. Xác định nồng độ % Fe(NO3)3 trong Y?
Đáp án : C Phương pháp giải :
Bước 1: Tính nFe(NO3)2 và nFe(NO3)3 - Cô cạn Y thu được chất rắn khan gồm Fe(NO3)2 (a mol) và Fe(NO3)3 (b mol). - Lập hệ phương trình tính nFe(NO3)2 và nFe(NO3)3 + Phương trình (1): BTNT Fe ta có: a + b = nFe + Viết PT nung muối: 2 Fe(NO3)2 → Fe2O3 + 4NO2 + 1/2O2 2 Fe(NO3)3 → Fe2O3 + 6NO2 + 3/2O2 => Phương trình (2): mgiảm = mNO2 + mO2 = 46(2a + 3b) + 32(a/4 + 3b/4) => nNO3- (Y) = 2a + 3b Bước 2: Tính nO (Z) - BTNT N để tính được nN (Z): nN(trong Z) = nHNO3 - nNO3- (Y) - Vì trong hỗn hợp khí Z oxi chiếm 61,11% về khối lượng nên nitơ chiếm 38,89% về khối lượng. → mZ = mN.(100/38,89) => nO (Z) Bước 3: Tính mX - Quy đổi X thành Fe (0,48 mol) và O (x mol). BT electron để tìm khối lượng X: 2.nFe2+ + 3.nFe3+ + 2.nO (Z) = 2.nO (X) + 5.nN (Z) → x = nO → mX = mFe + mO Bước 4: Tính C%Fe(NO3)3 Sơ đồ: X + HNO3 → Muối + Z + H2O - BTKL ta có: mdung dịch Y = mX + mdd HNO3 - mZ Lời giải chi tiết :
Bước 1: Tính nFe(NO3)2 và nFe(NO3)3 - Cô cạn Y thu được chất rắn khan gồm Fe(NO3)2 (a mol) và Fe(NO3)3 (b mol). Bảo toàn nguyên tố Fe ta có: a + b = nFe = 26,88 : 56 = 0,48 (mol). 2 Fe(NO3)2 → Fe2O3 + 4NO2 + 1/2O2 a mol → 2a 0,25a 2 Fe(NO3)3 → Fe2O3 + 6NO2 + 3/2O2 b mol → 3b 0,75b - Sau khi nung đến khối lượng không đổi thì khối lượng chất rắn giảm chính là tổng khối lượng NO2 và O2 thoát ra: 46(2a + 3b) + 32(a/4 + 3b/4) = 67,84 Ta có hệ: \(\left\{ \begin{array}{l}a + b = 0,48\\46(2a + 3b) + 32(0,25a + 0,75b) = 67,84\end{array} \right. \to \left\{ \begin{array}{l}a = 0,16{\rm{ mol}}\\{\rm{b = 0,32 mol}}\end{array} \right.\) → nNO3- (Y) = 2a + 3b = 2.0,16 + 3.0,32 = 1,28 mol Bước 2: Tính nO (Z) - Ta có: nHNO3 ban đầu = 1,44 mol Bảo toàn nguyên tố N: nN(trong Z) = nHNO3 - nNO3- (Y) = 1,44 - 1,28 = 0,16 mol - Vì trong hỗn hợp khí Z oxi chiếm 61,11% về khối lượng nên nitơ chiếm 38,89% về khối lượng. → mZ = mN.(100/38,89) = 0,16.14.(100/38,89) = 5,76 gam Ta có: nO (Z) = 5,76.61,11%/16 = 0,22 (mol) Bước 3: Tính mX - Quy đổi X thành Fe (0,48 mol) và O (x mol). Áp dụng định luật bảo toàn electron: 2.nFe2+ + 3.nFe3+ + 2.nO (Z) = 2.nO (X) + 5.nN (Z) ⟹ 0,16.2 + 0,32.3 + 0,22.2 = 2x + 0,16.5 → x = 0,46 mol → mX = mFe + mO = 26,88 + 0,46.16 = 34,24 (gam) Bước 4: Tính C%Fe(NO3)3 Sơ đồ: X + HNO3 → Muối + Z + H2O - Áp dụng định luật bảo toàn khối lượng ta có: mdung dịch Y = mX + mdd HNO3 - mZ = 34,24 + 288 - 5,76 = 316,48 (gam) - Vậy \(C{\% _{Fe\left({NO3} \right)3}} = \dfrac{{0,32.242.100\% }}{{316,48}} = {\text{ }}24,47\% \)
Câu 35 :
Nhiệt phân hoàn toàn hỗn hợp chất rắn X gồm Cu(NO3)2 và AgNO3. Hỗn hợp khí thu được cho lội qua nước lạnh thu được dung dịch Y và 168ml khí Z không màu (ở điều kiện tiêu chuẩn). Cho Y tác dụng với lượng vừa đủ dung dịch NaOH thu được dung dịch chứa 9,35 gam một muối. Phần trăm khối lượng AgNO3 trong X là (Cho biết nguyên tử khối của các nguyên tố: H = 1; N = 14; O = 16; Na = 23; Cu = 64; Ag = 108.)
Đáp án : B Phương pháp giải :
Bước 1: Xác định số mol hh khí NO2 và O2 - Đặt số mol Cu(NO3)2 = x và AgNO3 = y - Viết PTHH nhiệt phân muối nitrat. ⟹ Hỗn hợp khí gồm (2x + y) mol NO2 và (0,5x + 0,5y) mol O2. Bước 2: Tính số mol Cu(NO3)2 và AgNO3. - Viết PTHH hỗn hợp khí qua nước: 4NO2 + O2 + 2H2O → 4HNO3 → Lập phương trình tính nO2 dư (*) - Viết PTHH cho HNO3 tác dụng với dd NaOH: HNO3 + NaOH → NaNO3 + H2O → Lập phương trình tính mmuối (**) - Giải phương trình (*), (**) ⟹ x, y Lời giải chi tiết :
Bước 1: Viết PTHH nhiệt phân muối nitrat. - Đặt nCu(NO3)2 = x mol; nAgNO3 = y mol. Cu(NO3)2 → CuO + 2NO2 + 0,5O2 x → 2x → 0,5x (mol) AgNO3 → Ag + NO2 + 0,5O2 y → y → 0,5y (mol) Hỗn hợp khí gồm (2x + y) mol NO2 và (0,5x + 0,5y) mol O2. Bước 2: Tính số mol Cu(NO3)2 và AgNO3. - Cho hỗn hợp khí qua nước: 4NO2 + O2 + 2H2O → 4HNO3 (2x+y) → (0,5x+0,25y) → (2x+y) (mol) + Khí Z: nO2 dư = (0,5x + 0,5y) - (0,5x + 0,25y) = 0,25y (mol) ⟹ 0,25y = 0,168/22,4 ⟹ y = 0,03 (*) + DD Y: HNO3 (2x + y mol) - HNO3 + NaOH → NaNO3 + H2O (2x+y) → (2x+y) (mol) ⟹ mmuối = 85.(2x + y) = 9,35 (**) Từ (*) và (**) ⟹ x = 0,04; y = 0,03. Bước 3: Tính %mAgNO3 %mAgNO3 = \(\dfrac{{170.0,03}}{{188.0,04.170.0,03}}.100\% \) = 40,41%.
|



















Danh sách bình luận