Trắc nghiệm Tổng hợp bài tập xác định công thức phân tử hợp chất hữu cơ - Hóa học 9Đề bài
Câu 1 :
Axit axetic có công thức là C2H4O2. Phần trăm nguyên tố C trong phân tử axit axetic là
Câu 2 :
Công thức đơn giản nhất của hợp chất hữu cơ A là CH2Cl. Biết MA = 99. CTPT của A là
Câu 3 :
Hợp chất hữu cơ A gồm 3 nguyên tố C, H, O trong đó %mC = 48,65% và %mH = 8,11%. Biết khối lượng mol phân tử của A là 74. Xác định CTPT của A
Câu 4 :
Một hợp chất X chứa 3 nguyên tố C, H, O có tỉ lệ khối lượng mC : mH : mO = 21 : 2 : 4. Hợp chất X có công thức đơn giản nhất trùng với CTPT. CTPT X là:
Câu 5 :
Hiđrocacbon X có 83,33% khối lượng Cacbon. Số đồng phân cấu tạo của X là:
Câu 6 :
Phân tử hợp chất hữu cơ A có 2 nguyên tố. Đốt cháy hoàn toàn 3 gam chất A thu được 5,4 gam nước. Biết khối lượng mol của A là 30 gam. Công thức phân tử của A là
Câu 7 :
Vitamin A là một chất dinh dưỡng thiết yếu cho con người. Trong thực phẩm, vitamin A tồn tại ở dạng chính là retinol (chứa C, H, O) trong đó thành phần % khối lượng H và O tương ứng là 10,49% và 5,594%. Biết CTPT của retinol là:
Câu 8 :
Một hợp chất hữu cơ Y khi đốt cháy hoàn toàn thu được CO2 và H2O có số mol bằng nhau. Đồng thời số mol oxi tối thiểu cần dùng bằng 4 lần số mol của Y. Biết trong Y chỉ chứa 1 nguyên tử O. Công thức phân tử của Y là
Câu 9 :
Đốt cháy hoàn toàn 0,42 gam hợp chất hữu cơ X rồi dẫn toàn bộ sản phẩm cháy (chỉ gồm CO2 và H2O) lần lượt qua bình (1) đựng H2SO4 đặc dư, bình (2) đựng dung dịch KOH dư. Kết thúc thí nghiệm thấy khối lượng bình (1) và bình (2) tăng lần lượt là 0,54 gam và 1,32 gam. Biết rằng 0,42 gam X chiếm thể tích hơi bằng thể tích của 0,192 gam O2 ở cùng điều kiện nhiệt độ và áp suất. Công thức phân tử của X là
Câu 10 :
Có bao nhiêu CTPT hợp chất hữu cơ X (chứa C, H, O) có tỉ khối hơi so với H2 bằng 30?
Lời giải và đáp án
Câu 1 :
Axit axetic có công thức là C2H4O2. Phần trăm nguyên tố C trong phân tử axit axetic là
Đáp án : B Phương pháp giải :
\(\% {m_C} = \frac{{2.{M_C}}}{{{M_{{C_2}{H_4}{O_2}}}}}.100\% \) Lời giải chi tiết :
Khối lượng mol của C2H4O2 là: \({M_{{C_2}{H_4}{O_2}}}\)= 12.2 + 4 + 16.2 = 60 \( = > \% {m_C} = \frac{{12.2}}{{60}}.100\% = 40\% \)
Câu 2 :
Công thức đơn giản nhất của hợp chất hữu cơ A là CH2Cl. Biết MA = 99. CTPT của A là
Đáp án : B Phương pháp giải :
+) CTĐGN là CH2Cl => CTPT: (CH2Cl)n +) MA = 99 => n Lời giải chi tiết :
+) CTĐGN là CH2Cl => CTPT: (CH2Cl)n +) Vì MA = 99 => (12 + 2 + 35,5).n = 99 => n = 2 => CTPT: C2H4Cl2
Câu 3 :
Hợp chất hữu cơ A gồm 3 nguyên tố C, H, O trong đó %mC = 48,65% và %mH = 8,11%. Biết khối lượng mol phân tử của A là 74. Xác định CTPT của A
Đáp án : D Phương pháp giải :
+) %mO = 100% - %mC - %mH = 43,24% 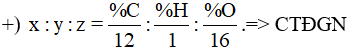 +) MA => CTPT Lời giải chi tiết :
Gọi công thức đơn giản nhất là CxHyOz %mO = 100% - %mC - %mH = 43,24% Ta có: 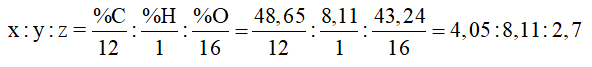 => x : y : z = 1,5 : 3 : 1 = 3 : 6 : 2 => CTĐGN của A là C3H6O2 => CTPT của A dạng (C3H6O2)n MA = 74 = (12.3 + 6 + 16.2).n => n = 1 => CTPT: C3H6O2
Câu 4 :
Một hợp chất X chứa 3 nguyên tố C, H, O có tỉ lệ khối lượng mC : mH : mO = 21 : 2 : 4. Hợp chất X có công thức đơn giản nhất trùng với CTPT. CTPT X là:
Đáp án : A Phương pháp giải :
+) x : y : z = $\frac{{{m}_{C}}}{12}:\frac{{{m}_{H}}}{1}:\frac{{{m}_{O}}}{16}$ Lời giải chi tiết :
Gọi CTPT của X là CxHyOz => x : y : z = $\frac{{{m}_{C}}}{12}:\frac{{{m}_{H}}}{1}:\frac{{{m}_{O}}}{16}=\frac{21}{12}:\frac{2}{1}:\frac{4}{16}=1,75:2:0,25=7:8:1$ => CTPT của X là C7H8O (vì CTPT trùng với CTĐGN)
Câu 5 :
Hiđrocacbon X có 83,33% khối lượng Cacbon. Số đồng phân cấu tạo của X là:
Đáp án : B Phương pháp giải :
Gọi CTPT của X có dạng CxHy (y ≤ 2x + 2) +) %mH = 100% - %mC +) x : y =$\frac{{{m_C}}}{{12}}:\frac{{{m_H}}}{1} = \frac{{83,33}}{{12}}:\frac{{16,67}}{1}$ +) Xét điều kiện: y ≤ 2x + 2 => n +) \(\Delta = \frac{{2.5 + 2 - 12}}{2} = 0\) => C5H12 là hiđrocacbon no, mạch hở => CTCT Lời giải chi tiết :
X là hiđrocacbon => X chỉ chứa C và H Gọi CTPT của X có dạng CxHy (y ≤ 2x + 2) => %mH = 100% - %mC = 100% - 83,33% = 16,67% => x : y = \[\frac{{{m_C}}}{{12}}:\frac{{{m_H}}}{1} = \frac{{83,33}}{{12}}:\frac{{16,67}}{1} = 6,944:16,67 = 1:2,4 = 5:12\] => CTPT của X có dạng: (C5H12)n hay C5nH12n Vì y ≤ 2x + 2 => 12n ≤ 5n + 7 => n ≤ 1 => n = 1 => CTPT của X là C5H12 Ta có: \(\Delta = \frac{{2.5 + 2 - 12}}{2} = 0\) => C5H12 là hiđrocacbon no, mạch hở Các CTCT của X là: 
Câu 6 :
Phân tử hợp chất hữu cơ A có 2 nguyên tố. Đốt cháy hoàn toàn 3 gam chất A thu được 5,4 gam nước. Biết khối lượng mol của A là 30 gam. Công thức phân tử của A là
Đáp án : A Phương pháp giải :
+) Hợp chất hữu có A có 2 nguyên tố, khi đốt cháy thu được nước => A chứa C và H +) \({{n}_{H}}~=2.{{n}_{{{H}_{2}}O}}~\) +) mA = mC + mH => nC : nH => Công thức đơn giản nhất của A +) M = 30 => n => CTPT Lời giải chi tiết :
\({n_{{H_2}O}} = \frac{{5,4}}{{18}} = 0,3\,mol\) Hợp chất hữu có A có 2 nguyên tố, khi đốt cháy thu được nước => A chứa C và H ${{n}_{H}}~=2.{{n}_{{{H}_{2}}O}}~=0,6\,mol$ Vì A chỉ chứa C và H => mA = mC + mH = 3 - 0,6 = 2,4 gam => nC = \(\frac{{2,4}}{{12}}\) = 0,2 mol => nC : nH = 0,2 : 0,6 = 1 : 3 => Công thức đơn giản nhất của A là (CH3)n M = 30 => n = 2 => CTPT của A là C2H6
Câu 7 :
Vitamin A là một chất dinh dưỡng thiết yếu cho con người. Trong thực phẩm, vitamin A tồn tại ở dạng chính là retinol (chứa C, H, O) trong đó thành phần % khối lượng H và O tương ứng là 10,49% và 5,594%. Biết CTPT của retinol là:
Đáp án : D Phương pháp giải :
+) %mC = 100% - %mH - %mO +) x : y : z = $\frac{{{m_C}}}{{12}}:\frac{{{m_H}}}{1}:\frac{{{m_O}}}{{16}} = \frac{{83,916}}{{12}}:\frac{{10,49}}{1}:\frac{{5,594}}{{16}}$ +) Vì renitol chứa một nguyên tử O => z = 1 Lời giải chi tiết :
Vì A chỉ chứa C, H và O => %mC = 100% - %mH - %mO = 100% - 10,49% - 5,594% = 83,916% => x : y : z = $\frac{{{m_C}}}{{12}}:\frac{{{m_H}}}{1}:\frac{{{m_O}}}{{16}} = \frac{{83,916}}{{12}}:\frac{{10,49}}{1}:\frac{{5,594}}{{16}}$ = 6,993 : 10,49 : 0,349 = 20 : 30 : 1 Vì renitol chứa một nguyên tử O => z = 1 => x = 20 và y = 30 => CTPT của retinol là C20H30O
Câu 8 :
Một hợp chất hữu cơ Y khi đốt cháy hoàn toàn thu được CO2 và H2O có số mol bằng nhau. Đồng thời số mol oxi tối thiểu cần dùng bằng 4 lần số mol của Y. Biết trong Y chỉ chứa 1 nguyên tử O. Công thức phân tử của Y là
Đáp án : C Phương pháp giải :
CxHyO + \(\frac{{2{\rm{x + 0,5y - 1}}}}{2}\)O2 $\xrightarrow{{{t}^{o}}}$ xCO2 + \(\frac{y}{2}\)H2O 1 mol → \(\frac{{2{\rm{x + 0,5y - 1}}}}{2}\)mol → x mol → \(\frac{y}{2}\) mol Phản ứng thu được số mol CO2 và H2O bằng nhau => x = \(\frac{y}{2}\) (1) Số mol oxi cần dùng bằng 4 lần số mol của Y => \(\frac{{2{\rm{x + 0,5y - 1}}}}{2}\)= 4 (2) Từ (1) vào (2) => x và y Lời giải chi tiết :
Gọi CTPT của Y có dạng CxHyO Vì đầu bài chỉ cho các tỉ lệ, không cho số mol cụ thể => giả sử đốt cháy 1 mol Y CxHyO + \(\frac{{2{\rm{x + 0,5y - 1}}}}{2}\)O2 $\xrightarrow{{{t}^{o}}}$ xCO2 + \(\frac{y}{2}\)H2O 1 mol → \(\frac{{2{\rm{x + 0,5y - 1}}}}{2}\)mol → x mol → \(\frac{y}{2}\) mol Phản ứng thu được số mol CO2 và H2O bằng nhau => x = \(\frac{y}{2}\) (1) Số mol oxi cần dùng bằng 4 lần số mol của Y => \(\frac{{2{\rm{x + 0,5y - 1}}}}{2}\)= 4 (2) Thay (1) vào (2) ta có: \(\frac{{2.\frac{y}{2}{\rm{ + 0,5y - 1}}}}{2}\)= 4 => 1,5y – 1 = 8 => y = 6 Thay y = 6 vào (1) => x = 3 => CTPT của Y là C3H6O
Câu 9 :
Đốt cháy hoàn toàn 0,42 gam hợp chất hữu cơ X rồi dẫn toàn bộ sản phẩm cháy (chỉ gồm CO2 và H2O) lần lượt qua bình (1) đựng H2SO4 đặc dư, bình (2) đựng dung dịch KOH dư. Kết thúc thí nghiệm thấy khối lượng bình (1) và bình (2) tăng lần lượt là 0,54 gam và 1,32 gam. Biết rằng 0,42 gam X chiếm thể tích hơi bằng thể tích của 0,192 gam O2 ở cùng điều kiện nhiệt độ và áp suất. Công thức phân tử của X là
Đáp án : B Phương pháp giải :
+) \({m_{{H_2}O}} = 0,54\,gam = > {n_{{H_2}O}} = 0,03\,mol = > {n_{H\,(trong\,X)}} = 2.{n_{{H_2}O}} = 0,06\) \( + ){m_{C{O_2}}} = 1,32\,gam = > {n_{C{O_2}}} = 0,03\,mol\, = > {n_C} = {n_{C{O_2}}} = 0,03\) +) mC + mH = mX => trong X không chứa O +) nC : nH => CTĐGN 0,42 gam X chiếm thể tích hơi bằng thể tích của 0,192 gam O2 => nX => MX = \(\frac{{{m_X}}}{{{n_X}}}\) => n => CTPT Lời giải chi tiết :
Cho hỗn hợp sản phẩm qua bình (1) đựng H2SO4 đặc, dư => H2O bị giữ lại => \({m_{{H_2}O}} = 0,54\,gam = > {n_{{H_2}O}} = 0,03\,mol = > {n_{H\,(trong\,X)}} = 2.{n_{{H_2}O}} = 0,06\) Cho qua bình (2) đựng KOH dư => CO2 bị giữ lại \( = > {m_{C{O_2}}} = 1,32\,gam = > {n_{C{O_2}}} = 0,03\,mol\, = > {n_C} = {n_{C{O_2}}} = 0,03\) Vì đốt cháy X chỉ thu được CO2 và H2O => X gồm C, H và có thể có O Ta có: mC + mH = 0,03.12 + 0,06 = 0,42 = mX => trong X không chứa O => nC : nH = 0,03 : 0,06 = 1 : 2 => CTĐGN của X là CH2 => CTPT của X có dạng (CH2)n 0,42 gam X chiếm thể tích hơi bằng thể tích của 0,192 gam O2 => nX = \(\frac{{0,192}}{{32}} = 0,006\,mol\) => MX = \(\frac{{0,42}}{{0,006}} = \,70\) => 14n = 70 => n = 5 => CTPT X là C5H10
Câu 10 :
Có bao nhiêu CTPT hợp chất hữu cơ X (chứa C, H, O) có tỉ khối hơi so với H2 bằng 30?
Đáp án : C Phương pháp giải :
Biện luận nghiệm của phương trình: 12x + y + 16z = 60 Lời giải chi tiết :
Tỉ khối hơi so với H2 bằng 30 => M = 30.2 = 60 Gọi CTPT của X có dạng CxHyOz => M = 12x + y + 16z = 60 (1) \( = > 16{\rm{z < 60 = > z < }}\frac{{60}}{{16}}\, < 3,75\) TH1: z = 1, thay vào (1) => 12x + y = 44 (2) \( = > x < \frac{{44}}{{12}} = > x < 3,66\) +) x = 1, thay vào (2) => y = 44 – 12 = 32 (loại) +) x = 2, thay vào (2) => y = 44 – 12.2 = 20 (loại) +) x = 3, thay vào (2) => y = 8 (thỏa mãn X là C3H8O) TH2: z = 2, thay vào (1) => 12x + y = 28 (3) \( = > x < \frac{{28}}{{12}} = > x < 2,33\) +) x = 1 => y = 28 – 12 = 16 (loại) +) x = 2 => y = 28 – 12.2 = 4 (thỏa mãn X là C2H4O2) TH3: z = 3, thay vào (1) => 12x + y = 12 => loại vì x và y đều ≥ 1 Vậy có 2 CTPT thỏa mãn đầu bài
|



















Danh sách bình luận