Trắc nghiệm Bài 4. Một số axit quan trọng - Hóa học 9Đề bài
Câu 1 :
Các dung dịch đều làm quỳ tím chuyển đỏ là
Câu 2 :
Để an toàn khi pha loãng H2SO4 đặc cần thực hiện theo cách:
Câu 3 :
Dãy kim loại phản ứng được với dung dịch H2SO4 loãng là
Câu 4 :
Để nhận biết dung dịch H2SO4, người ta thường dùng
Câu 5 :
Hoà tan hết 25,2 gam kim loại R trong dung dịch axit HCl, sau phản ứng thu được 10,08 lít H2 (đktc). Kim loại R là
Câu 6 :
Hoà tan hoàn toàn 6,5 gam một kim loại A chưa rõ hoá trị vào dung dịch axit H2SO4, thì thu được 2,24 lít H2 (đktc). Kim loại A là
Câu 7 :
Cho hỗn hợp X gồm Al và Ag phản ứng với dung dịch axit H2SO4 thu được 5,6 lít H2 (đktc). Sau phản ứng còn 3 gam một chất rắn không tan. Thành phần phần trăm theo khối lượng của Ag trong hỗn hợp X ban đầu là
Câu 8 :
Để hoà tan vừa hết 4,48 gam Fe phải dùng bao nhiêu ml dung dịch hỗn hợp HCl 0,5M và H2SO4 0,75M?
Câu 9 :
Hòa tan 50,54 gam hỗn hợp X gồm (Fe, Al) trong dung dịch H2SO4 loãng dư thu được V lít khí H2 (đktc) và dung dịch A, cô cạn dung dịch A thu được 178,22 gam hỗn hợp muối. Giá trị của V là
Câu 10 :
Hòa tan hoàn toàn hỗn hợp (Fe, Mg) bằng dung dịch HCl 20% (vừa đủ) thu được dung dịch A. Trong dung dịch A nồng độ của MgCl2 = 11,787%. Tính C% của FeCl2 trong dung dịch A
Câu 11 :
Cho 69,75 gam hỗn hợp A gồm CaCO3 và Na2CO3 tác dụng vừa đủ với 337,5 gam dung dịch HCl 14,6% thu được dung dịch X và V lit CO2 (đktc). Giá trị của V là
Câu 12 :
Cho 50,9 gam hỗn hợp rắn A gồm BaCl2 và BaCO3 tác dụng vừa đủ với dung dịch H2SO4 thu được V lít CO2 (đktc), 58,25 gam kết tủa và dung dịch X. Giá trị của V là
Câu 13 :
Cho các dãy chất dưới đây, dãy chất nào tác dụng được với dung dịch axit sunfuric loãng?
Câu 14 :
Dung dịch HCl không tác dụng với chất nào sau đây?
Câu 15 :
Trong công nghiệp, sản xuất axitsunfuric qua mấy công đoạn
Câu 16 :
Công thức hóa học của axit sunfuric là:
Câu 17 :
Dung dịch axit loãng H2SO4 khi phản ứng với chất nào dưới đây mà khí H2 không giải phóng ra (không được sinh ra)?
Câu 18 :
Sự khác biệt nhất trong tính chất hóa học của H2SO4 đặc so với H2SO4 loãng là
Câu 19 :
Khả năng tan của H2SO4 trong nước là
Câu 20 :
Chất tác dụng được với dung dịch axit HCl là
Câu 21 :
Cho các chất sau: KOH, Cu, CaO, Mg, NaCl. Chất nào phản ứng được với dung dịch axit clohiđric ?
Câu 22 :
Chất nào sau đây có thể dùng làm thuốc thử để phân biệt dung dịch Na2SO4 và Na2CO3?
Câu 23 :
Nhóm chất tác dụng với nước và với dung dịch HCl là:
Câu 24 :
Chất nào dùng làm thuốc thử để phân biệt hai dung dịch axit clohidric và axit sunfuric?
Câu 25 :
Khi cho kim loại Fe tác dụng với axit H2SO4 đặc, nóng, dư không tạo thành sản phẩm nào trong các sản phẩm sau đây?
Câu 26 :
Hiện tượng khi cho vài giọt axit H2SO4 đặc vào cốc nghiệm chứa 1 ít đường là:
Câu 27 :
Axit clohiđric có công thức hóa học là:
Câu 28 :
Chất tác dụng với dung dịch HCl loãng tạo thành chất khí nặng hơn không khí là:
Câu 29 :
Để phân biệt ba dung dịch HCl, H2SO4, HNO3 , nên dùng
Câu 30 :
Dãy các oxit nào dưới đây tác dụng được với H2SO4 loãng?
Câu 31 :
Cặp chất nào sau đây tác dụng với nhau sinh ra chất khí cháy trong không khí với ngọn lửa màu xanh?
Câu 32 :
Chất nào có thể dùng để nhận biết axit sunfuric và muối sunfat ?
Câu 33 :
Cặp chất tác dụng với nhau tạo thành sản phẩm có chất khí:
Câu 34 :
Cho 4,8 gam kim loại magie tác dụng vừa đủ với dung dịch axit clohidric. Thể tích khí Hiđro thu được ở đktc là:
Câu 35 :
Cho 0,1mol kim loại kẽm vào dung dịch HCl dư. Khối lượng muối thu được là:
Câu 36 :
Khi cho 500ml dung dịch NaOH 1M tác dụng vừa đủ với dung dịch H2SO4 2M tạo thành muối trung hòa. Thể tích dung dịch H2SO4 2M là:
Câu 37 :
Cho 10,5 gam hỗn hợp hai kim loại Zn, Cu vào dung dịch H2SO4 loãng dư, người ta thu được 2,24 lít khí (đktc). Thành phần phần trăm theo khối lượng mỗi kim loại trong hỗn hợp ban đầu là:
Câu 38 :
Hòa tan vừa hết 20 gam hỗn hợp CuO và Fe2O3 trong 200 ml dung dịch HCl 3,5M . Khối lượng mỗi oxit trong hỗn hợp là:
Câu 39 :
Hòa tan 7,74 gam hỗn hợp 2 kim loại Mg, Al trong 500ml dung dịch hỗn hợp chứa HCl 1M và H2SO4 0,38M loãng. Thu được dung dịch A và 8,736 lít khí H2 (đktc). Khối lượng muối có trong dung dịch A là
Câu 40 :
Thể tích khí sinh ra ở đktc khi cho hỗn hợp gồm 9 (g) Al và 6,5 (g) Zn vào 100 ml dung dịch HCl 1M và H2SO4 1M là:
Câu 41 :
Cho 8 gam Mg, Fe vào dung dịch HCl vừa đủ. Sau phản ứng thu được m gam muối. Hỏi m nằm trong khoảng nào?
Câu 42 :
Cho 8,4 gam Mg, Zn vào dung dịch H2SO4 vừa đủ. Sau phản ứng thu được dung dịch X, 3,6 (g) chất rắn và 4,48 (l) khí ở đktc. Phần trăm khối lượng kim loại Zn có trong hỗn hợp là:
Câu 43 :
Cho 8 gam Mg, Al vào dung dịch \(HCl\) vừa đủ. Sau phản ứng thu được dung dịch X, 2,36 (g) chất rắn và 6,272 (l) khí ở đktc. Phần trăm khối lượng mỗi kim loại có trong hỗn hợp lần lượt là.
Câu 44 :
Hòa tan hoàn toàn hỗn hợp gồm 16 gam CuO và 4 gam MgO trong dung dịch H2SO4 20% vừa đủ. Tính khối lượng dung dịch H2SO4 đã dùng.
Câu 45 :
Hỗn hợp X gồm Fe và Al (với tỉ lệ mol 1 : 1). Hòa tan hoàn toàn m gam X bằng dung dịch HCl dư, sau phản ứng thu được 5,6 lít H2 (đktc). Giá trị của m là:
Câu 46 :
Hòa tan hoàn toàn 14,4 gam FeO cần vừa đủ V ml dung dịch HCl 2M. Giá trị của V là:
Câu 47 :
Hòa tan m gam oxit sắt cần 150 ml dd HCl 3M . Mặt khác, khử toàn bộ m gam oxit sắt bằng CO nóng, dư thu được 8,4 gam sắt. Công thức oxit sắt là
Câu 48 :
Cho hỗn hợp Al và 1 kim loại hóa trị II tan trong dung dịch H2SO4 loãng vừa đủ thu được dung dịch A và có H2 thoát ra. Cho A tác dụng với dung dịch BaCl2 vừa đủ thấy tách ra 93,2 gam kết tủa trắng. Lọc kết tủa rồi cô cạn nước lọc thu được 36,2 gam muối khan. Khối lượng kim loại ban đầu là
Câu 49 :
Cho hỗn hợp A gồm Fe và FeS tác dụng với dung dịch HCl dư thu được 2,24 lít hỗn hợp khí X ở điều kiện tiêu chuẩn. Hỗn hợp khí này có tỉ khối so với hiđro là 9. Thành phần phần trăm theo khối lượng của hỗn hợp Fe và FeS ban đầu lần lượt là
Câu 50 :
Hòa tan hết muối cacbonat trung hòa của kim loại A bằng dung dịch H2SO4 vừa đủ nồng độ 19,6% thì thu được dung dịch chứa muối sunfat nồng độ 26,57%. Xác định kim loại A
Câu 51 :
Một hỗn hợp kim loại gồm Al, Cu, Fe . Nếu cho hỗn hợp này tác dụng với dung dịch HCl dư thì thu được 8,96 lít khí (đktc) và 9 gam chất rắn. Nếu cho hỗn hợp này tác dụng vừa đủ với dung dịch NaOH thì phải dùng 100 ml dung dịch NaOH 2M. % khối lượng của Fe trong hỗn hợp là
Câu 52 :
Cho 122,4g hỗn hợp X gồm Cu, Fe3O4 vào dung dịch H2SO4 đặc, nóng thu được 10,08 lít SO2 (đktc), dung dịch Y và còn lại 4,8g kim loại. Cô cạn dung dịch Y thu được m gam muối khan. Tính m.
Lời giải và đáp án
Câu 1 :
Các dung dịch đều làm quỳ tím chuyển đỏ là
Đáp án : B Phương pháp giải :
Xem lại tính chất hóa học của axit Lời giải chi tiết :
Các dung dịch đều làm quỳ tím chuyển đỏ là HCl, H2SO4.
Câu 2 :
Để an toàn khi pha loãng H2SO4 đặc cần thực hiện theo cách:
Đáp án : B Lời giải chi tiết :
Để an toàn khi pha loãng H2SO4 đặc cần thực hiện theo cách: rót từng giọt axit vào nước.
Câu 3 :
Dãy kim loại phản ứng được với dung dịch H2SO4 loãng là
Đáp án : D Lời giải chi tiết :
Dãy kim loại phản ứng được với dung dịch H2SO4 loãng là Mg, Fe, Zn. H2SO4 không phản ứng với Cu, Ag, Pt.
Câu 4 :
Để nhận biết dung dịch H2SO4, người ta thường dùng
Đáp án : C Lời giải chi tiết :
Để nhận biết dung dịch H2SO4, người ta thường dùng dung dịch BaCl2 vì tạo kết tủa trắng BaSO4
Câu 5 :
Hoà tan hết 25,2 gam kim loại R trong dung dịch axit HCl, sau phản ứng thu được 10,08 lít H2 (đktc). Kim loại R là
Đáp án : A Phương pháp giải :
+) Gọi hóa trị của kim loại R là a (a = 1, 2, 3, 4) +) Viết PTHH, tính số mol R theo số mol H2 +) Áp dụng công thức: $m = M.{\text{ }}n$ Lời giải chi tiết :
${n_{{H_2}}}$= 0,45 mol Gọi hóa trị của kim loại R là a (a = 1, 2, 3, 4) 2R + 2aHCl → 2RCla + aH2 $\dfrac{{0,9}}{a}$ ← 0,45 Áp dụng công thức: $m = M.{\text{ }}n{\text{ }} = > {\text{ }}25,5 = \dfrac{{R.0,45.2}}{a} < = > R = 28a$  Vậy kim loại cần tìm là sắt (Fe)
Câu 6 :
Hoà tan hoàn toàn 6,5 gam một kim loại A chưa rõ hoá trị vào dung dịch axit H2SO4, thì thu được 2,24 lít H2 (đktc). Kim loại A là
Đáp án : A Phương pháp giải :
+) Gọi kim loại A có hóa trị n (n = 1, 2, 3, 4) +) Từ PTHH, tính số mol A theo số mol H2 +) Áp dụng công thức: $m = M.n{\text{ }} = > A = \frac{m}{n}$ Lời giải chi tiết :
${n_{{H_2}}} = 0,1\,\,mol$ Gọi kim loại A có hóa trị n (n = 1, 2, 3, 4) 2A + nH2SO4 → A2(SO4)n + nH2 $\frac{{0,2}}{n}$ ← 0,1 mol Áp dụng công thức: $m = M.n{\text{ }} = > A = \frac{m}{n} = \frac{{6,5}}{{\frac{{0,2}}{n}}} = > A = 32,5n$
Kim loại A là Zn
Câu 7 :
Cho hỗn hợp X gồm Al và Ag phản ứng với dung dịch axit H2SO4 thu được 5,6 lít H2 (đktc). Sau phản ứng còn 3 gam một chất rắn không tan. Thành phần phần trăm theo khối lượng của Ag trong hỗn hợp X ban đầu là
Đáp án : C Phương pháp giải :
+) Ag không phản ứng với H2SO4 => 3 gam chất rắn không tan là Ag +) từ PTHH, tính số mol Al theo số mol H2 +) mhỗn hợp X = mAl + mAg $ = > \% {m_{Ag}} = \frac{{{m_{Ag}}}}{{{m_X}}}.100\% $ Lời giải chi tiết :
${n_{{H_2}}} = 0,25\,\,mol$ Ag không phản ứng với H2SO4 => 3 gam chất rắn không tan là Ag 2Al + 3H2SO4 → Al2(SO4)3 + 3H2 $\frac{{0,5}}{3}$ mol ← 0,25 mol $ = > {\text{ }}{m_{Al}} = 27.\frac{{0,5}}{3} = 4,5\,\,gam$ => mhỗn hợp X = mAl + mAg = 4,5 + 3 = 7,5 gam $ = > \% {m_{Ag}} = \frac{3}{{7,5}}.100\% = 40\% $
Câu 8 :
Để hoà tan vừa hết 4,48 gam Fe phải dùng bao nhiêu ml dung dịch hỗn hợp HCl 0,5M và H2SO4 0,75M?
Đáp án : B Phương pháp giải :
Gọi thể tích dung dịch hỗn hợp axit cần dùng là V (lít) $ = > {n_{HCl}} = 0,5V\,\,mol;\,\,n{_{{H_2}S{O_4}}} = 0,75V\,\,mol$ +) Từ số mol HCl và H2SO4 => lập PT tính số mol Fe theo V => tính V Lời giải chi tiết :
nFe = 0,08 mol Gọi thể tích dung dịch hỗn hợp axit cần dùng là V (lít) $ = > {n_{HCl}} = 0,5V\,\,mol;\,\,n{ _{{H_2}S{O_4}}} = 0,75V\,\,mol$ Fe + 2HCl → FeCl2 + H2 0,25V ← 0,5V Fe + H2SO4 → FeSO4 + H2 0,75V ← 0,75V => nFe = 0,25V + 0,75V = 0,08 => V = 0,08 lít = 80 ml
Câu 9 :
Hòa tan 50,54 gam hỗn hợp X gồm (Fe, Al) trong dung dịch H2SO4 loãng dư thu được V lít khí H2 (đktc) và dung dịch A, cô cạn dung dịch A thu được 178,22 gam hỗn hợp muối. Giá trị của V là
Đáp án : C Phương pháp giải :
Gọi số mol của Fe và Al lần lượt là x và y mol => mhỗn hợp X = PT(1) +) Từ PTHH => muối trong dung dịch A gồm x mol FeSO4 và 0,5y mol Al2(SO4)3 => mhỗn hợp muối = ${m_{F{\text{e}}S{O_4}}} + {m_{A{l_2}{{(S{O_4})}_3}}}$ => PT(2) +) Từ PTHH => $\sum {{n_{{H_2}}}} = x + 1,5y$ Lời giải chi tiết :
Gọi số mol của Fe và Al lần lượt là x và y mol => mhỗn hợp X = 56x + 27y = 50,54 (1) Fe + H2SO4 → FeSO4 + H2 x mol → x mol → x mol 2Al + 3H2SO4 → Al2(SO4)3 + 3H2 y mol → 0,5y mol → 1,5y mol Muối trong dung dịch A gồm x mol FeSO4 và 0,5y mol Al2(SO4)3 => mhỗn hợp muối = ${m_{F{\text{e}}S{O_4}}} + {m_{A{l_2}{{(S{O_4})}_3}}}$ => 152x + 0,5y.342 = 178,22 (2) Từ (1) và (2) ta có hệ phương trình: $\left\{ \begin{gathered}56{\text{x}} + 27y = 50,54 \hfill \\152{\text{x}} + 0,5y.342 = 178,22 \hfill \\ \end{gathered} \right. = > \left\{ \begin{gathered}x = 0,7 \hfill \\y = 0,42 \hfill \\ \end{gathered} \right.$ => $\sum {{n_{{H_2}}}} = x + 1,5y = 0,7 + 1,5.0,42 = 1,33\,\,mol$ => V = 1,33.22,4 = 29,792 lít
Câu 10 :
Hòa tan hoàn toàn hỗn hợp (Fe, Mg) bằng dung dịch HCl 20% (vừa đủ) thu được dung dịch A. Trong dung dịch A nồng độ của MgCl2 = 11,787%. Tính C% của FeCl2 trong dung dịch A
Đáp án : D Phương pháp giải :
+) Tự chọn nMg = 1 mol và nFe = a mol => tính số mol MgCl2 và FeCl2 +) Tính ${m_{dd{\text{ }}HCl}} = \dfrac{{36,5.(2 + 2a)}}{{20\% }} $ +) mdd Y = mX + mdd HCl – mH2 +) Từ $ {\text{ }}C{\% _{MgC{l_2}}} = 11,787\% $ => tính a => tính số mol FeCl2 => C% Lời giải chi tiết :
Tự chọn nMg = 1 mol và nFe = a mol Mg + 2HCl → MgCl2 + H2 1 → 2 → 1 → 1 Fe + 2HCl → FeCl2 + H2 a → 2a → a → a \( \to {n_{HCl}} = 2 + 2{\text{a}}\,\,(mol) \to {m_{HCl}} = 36,5.(2 + 2{\text{a}})\,\,gam\) \( \to \) ${m_{dd{\text{ }}HCl}} = \dfrac{{36,5.(2 + 2a)}}{{20\% }} = 365a + 365$ Mà \({n_{{H_2}}} = 1 + a\,\,(mol) \to {m_{{H_2}}} = 2.(1 + a)\,\,gam\) \( \to {m_{dd\,Y}} = {m_X} + {m_{dd\,\,HCl}} - {m_{{H_2}}} = {m_{Mg}} + {m_{F{\text{e}}}} + {m_{dd\,\,HCl}} - {m_{{H_2}}}\) \( \to {m_{dd\,Y}} = 24.1 + 56.a + 365{\text{a}} + 365 - 2.(1 + a) = 419{\text{a}} + 387\) gam $ = > {\text{ }}C{\% _{MgC{l_2}}} = \dfrac{{95}}{{419{\text{a}} + 387}}.100\% = 11,787\% \,\, = > \,\,a = 1$ \( \to C{\% _{F{\text{e}}C{l_2}}} = \dfrac{{127.1}}{{419.1 + 387}}.100 = 15,76\% \)
Câu 11 :
Cho 69,75 gam hỗn hợp A gồm CaCO3 và Na2CO3 tác dụng vừa đủ với 337,5 gam dung dịch HCl 14,6% thu được dung dịch X và V lit CO2 (đktc). Giá trị của V là
Đáp án : A Phương pháp giải :
+) mhỗn hợp A = ${{m}_{CaC{{\text{O}}_{3}}}}+{{m}_{N{{a}_{2}}C{{O}_{3}}}}$ => PT (1) +) từ PTHH => tính số mol HCl theo x và y => PT (2) +) Từ PTHH $ = > \sum {{n_{C{O_2}}} = } x + y$ Lời giải chi tiết :
Gọi số mol của CaCO3 và Na2CO3 lần lượt là x và y mol => mhỗn hợp A = ${{m}_{CaC{{\text{O}}_{3}}}}+{{m}_{N{{a}_{2}}C{{O}_{3}}}}$ => 100x + 106y = 69,75 (1) CaCO3 + 2HCl → CaCl2 + CO2 + H2O x → 2x → x Na2CO3 + 2HCl → 2NaCl + CO2 + H2O y → 2y → y ${m_{HCl}} = \frac{{337,5.14,6\% }}{{100\% }} = 49,275\,\,gam\,\, = > {n_{HCl}} = 1,35\,\,mol$ Từ 2 PT => nHCl = 2x + 2y = 1,35 (2) Từ (1) và (2) ta có hệ : $\left\{ \begin{gathered}100{\text{x}} + 106y = 69,75 \hfill \\2{\text{x}} + 2y = 1,35 \hfill \\ \end{gathered} \right. = > \left\{ \begin{gathered}x = 0,3 \hfill \\y = 0,375 \hfill \\ \end{gathered} \right.$ $ = > \sum {{n_{C{O_2}}} = } x + y = 0,3 + 0,375 = 0,675\,\,mol$ => V = 0,675.22,4 = 15,12 lít
Câu 12 :
Cho 50,9 gam hỗn hợp rắn A gồm BaCl2 và BaCO3 tác dụng vừa đủ với dung dịch H2SO4 thu được V lít CO2 (đktc), 58,25 gam kết tủa và dung dịch X. Giá trị của V là
Đáp án : C Phương pháp giải :
+) Gọi số mol BaCl2 và BaCO3 lần lượt là x và y => mhh A = PT(1) +) Kết tủa thu được là BaSO4 $ = > {n_{BaS{O_4}}} => PT(4)$ +) Từ PTHH => nCO2 = y Lời giải chi tiết :
Gọi số mol BaCl2 và BaCO3 lần lượt là x và y => mhh A = 208x + 197y = 50,9 (1) BaCl2 + H2SO4 → BaSO4 ↓ + 2HCl (2) x → x BaCO3 + H2SO4 → BaSO4 ↓ + H2O + CO2 (3) y → y → y kết tủa thu được là BaSO4 $ = > {n_{BaS{O_4}}} = \frac{{58,25}}{{233}} = 0,25\,\,mol$ Từ PT (2) và (3) $ = > {n_{BaS{O_4}}} = x + y = 0,25\,\,\,(4)$ Từ (1) và (4) ta có hệ : $\left\{ \begin{gathered}208{\text{x}} + 197y = 50,9 \hfill \\x + y = 0,25 \hfill \\ \end{gathered} \right. = > \left\{ \begin{gathered}x = 0,15 \hfill \\y = 0,1 \hfill \\ \end{gathered} \right.$ Theo PT (3) => nCO2 = y = 0,1 mol => V = 2,24 lít
Câu 13 :
Cho các dãy chất dưới đây, dãy chất nào tác dụng được với dung dịch axit sunfuric loãng?
Đáp án : C Phương pháp giải :
Dựa vào tính chất hóa học của axit H2SO4 loãng + Tác dụng với oxit bazo, bazo + Tác dụng với kim loại đứng trước H trong dãy điện hóa + Tác dụng với muối Lời giải chi tiết :
A. Loại Cu và CO không phản ứng B. Loại CO2 không phản ứng C. Thỏa mãn D. Loại CO2 không phản ứng
Câu 14 :
Dung dịch HCl không tác dụng với chất nào sau đây?
Đáp án : B Lời giải chi tiết :
Ag là kim loại đứng sau H trong dãy điện hóa nên không tác dụng được với HCl
Câu 15 :
Trong công nghiệp, sản xuất axitsunfuric qua mấy công đoạn
Đáp án : C Lời giải chi tiết :
Sản xuất axit sunfuric gồm 3 giai đoạn: Giai đoạn 1: Đốt lưu huỳnh cháy trong không khí S + O2 \(\xrightarrow{{{t^0}}}\) SO2 Giai đoạn 2: sản xuất SO3 bằng cách oxi hóa SO2 2SO2 + O2 \(\xrightarrow[{{{450}^0}C}]{{{V_2}{O_5}}}\) 2SO3 Giai đoạn 3: Cho SO3 tác dụng với nước để điều chế H2SO4 SO3 + H2O → H2SO4
Câu 16 :
Công thức hóa học của axit sunfuric là:
Đáp án : C Phương pháp giải :
Học thuộc tên và kí hiệu hóa học tương ứng của axit Lời giải chi tiết :
CTHH của axit sunfuric là: H2SO4
Câu 17 :
Dung dịch axit loãng H2SO4 khi phản ứng với chất nào dưới đây mà khí H2 không giải phóng ra (không được sinh ra)?
Đáp án : B Phương pháp giải :
Các kim loại đứng trước H trong dãy điện hóa mới phản ứng được với dd H2SO4 Lời giải chi tiết :
Cu là kim loại đứng sau H trong dãy điện hóa nên không phản ứng được với dd H2SO4 loãng, do vậy không sinh ra được khí H2
Câu 18 :
Sự khác biệt nhất trong tính chất hóa học của H2SO4 đặc so với H2SO4 loãng là
Đáp án : D Lời giải chi tiết :
Axit sunfuric đặc có những tính chất hóa học riêng so với H2SO4 loãng + Tác dụng với hầu hết kim loại (trừ Au và Pt) + Tính háo nước
Câu 19 :
Khả năng tan của H2SO4 trong nước là
Đáp án : D Lời giải chi tiết :
Axit sunfuric là chất lỏng sánh, không màu, nặng gấp đôi nước, không bay hơi, dễ tan trong nước, tỏa rất nhiều nhiệt.
Câu 20 :
Chất tác dụng được với dung dịch axit HCl là
Đáp án : C Phương pháp giải :
Kim loại đứng trước H trong dãy hoạt động hóa học của kim loại có pư với dd HCl. Lời giải chi tiết :
Fe là kim loại đứng trước H trong dãy hoạt động hóa học của kim loại nên có pư với dd HCl PTHH: Fe + 2HCl → FeCl2 + H2↑
Câu 21 :
Cho các chất sau: KOH, Cu, CaO, Mg, NaCl. Chất nào phản ứng được với dung dịch axit clohiđric ?
Đáp án : A Phương pháp giải :
Tính chất hóa học của axit + Làm quỳ tím chuyển sang màu đỏ. + Tác dụng với kim loại đứng trước H trong dãy hoạt động hóa học, tạo ra muối và khí H2. + Tác dụng với oxit bazơ tạo ra muối và nước. + Tác dụng với bazơ tạo ra muối và nước. + Tác dụng với muối tạo ra muối mới và axit mới. Lời giải chi tiết :
- Các chất tác dụng được với axit HCl là KOH, CaO, Mg. - PTHH: \(K{\rm{O}}H + HCl \to KCl + {H_2}O\) \(CaO + 2HCl \to CaC{l_2} + {H_2}O\) \(Mg + 2HCl \to MgC{l_2} + {H_2}\)
Câu 22 :
Chất nào sau đây có thể dùng làm thuốc thử để phân biệt dung dịch Na2SO4 và Na2CO3?
Đáp án : B Phương pháp giải :
2 muối này có cùng gốc kim loại là Na khác gốc axit → chọn thuốc thử đặc trưng phân biệt ra 2 gốc axit Lời giải chi tiết :
A. Loại vì cả 2 cùng có hiện tượng thu được kết tủa trắng B. Chọn vì khi cho dd HCl lần lượt vào 2 dd trên, dd nào có khí thoát ra ngoài là Na2CO3 còn không có hiện tượng gì là Na2SO4 PTHH: 2HCl + Na2CO3 → 2NaCl + CO2↑ + H2O C. Loại vì cho dd NaOH vào cả 2 dd đều không có hiện tượng gì D. Loại vì cả 2 cùng có hiện tượng thu được kết tủa trắng
Câu 23 :
Nhóm chất tác dụng với nước và với dung dịch HCl là:
Đáp án : B Phương pháp giải :
Các oxit bazơ tan sẽ có phản ứng với nước và dd HCl Lời giải chi tiết :
A. Loại P2O5 không tác dụng được với dd HCl B. Thỏa mãn PTHH: CaO + H2O → Ca(OH)2 BaO + H2O → Ba(OH)2 Na2O + H2O → 2NaOH CaO + 2HCl → CaCl2 + H2O BaO + 2HCl → BaCl2 + H2O Na2O + 2HCl → 2NaCl + H2O C. Loại SO3, P2O5 không tác dụng được với dd HCl D. Loại SO3 không có pư với dd HCl
Câu 24 :
Chất nào dùng làm thuốc thử để phân biệt hai dung dịch axit clohidric và axit sunfuric?
Đáp án : B Phương pháp giải :
Chọn thuốc thử đặc trưng để nhận ra gốc sunfat Lời giải chi tiết :
Dùng BaCl2 để phân biệt dd HCl và dd H2SO4 Cho dd BaCl2 lần lượt vào 2 dung dịch trên + Dung dịch xuất hiện kết tủa trắng là H2SO4, còn lại không có hiện tượng gì là HCl PTHH: BaCl2 + H2SO4 → BaSO4↓ + 2HCl
Câu 25 :
Khi cho kim loại Fe tác dụng với axit H2SO4 đặc, nóng, dư không tạo thành sản phẩm nào trong các sản phẩm sau đây?
Đáp án : A Lời giải chi tiết :
2Fe + 6H2SO4 (đặc) \(\xrightarrow{{{t^0}}}\) Fe2(SO4)3 + 3SO2↑ + 6H2O → pư không tạo FeSO4
Câu 26 :
Hiện tượng khi cho vài giọt axit H2SO4 đặc vào cốc nghiệm chứa 1 ít đường là:
Đáp án : B Lời giải chi tiết :
Khi cho vài giọt axit H2SO4 đặc vào cốc nghiệm chứa 1 ít đường thì đường bị hóa đen, cột chất rắn dâng cao, có khói trắng thoát ra C6H12O6 \(\xrightarrow{{{H_2}S{O_{4\,}}dac}}\) 6C + 6H2O
Câu 27 :
Axit clohiđric có công thức hóa học là:
Đáp án : B Lời giải chi tiết :
Axit clohiđric có công thức hóa học là: HCl
Câu 28 :
Chất tác dụng với dung dịch HCl loãng tạo thành chất khí nặng hơn không khí là:
Đáp án : D Lời giải chi tiết :
A. Tạo ra khí H2 nhẹ hơn không khí B không tạo ra khí C tạo ra khí H2 nhẹ hơn không khí D tạo ra khí SO2 nặng hơn không khí
Câu 29 :
Để phân biệt ba dung dịch HCl, H2SO4, HNO3 , nên dùng
Đáp án : D Lời giải chi tiết :
Để nhận biết 3 axit HCl, HNO3, H2SO4 ta dùng BaCl2 và AgNO3 vì BaCl2 giúp nhận ra H2SO4 do chỉ tạo kết tủa trắng với chất này AgNO3 nhận ra HCl sau khi nhận ra H2SO4 do tạo kết tủa trắng với HCl còn HNO3 thì không có hiện tượng
Câu 30 :
Dãy các oxit nào dưới đây tác dụng được với H2SO4 loãng?
Đáp án : C Lời giải chi tiết :
A sai vì NO2 không tác dụng với H2SO4 loãng B sai vì P2O5 không tác dụng với H2SO4 loãng C đúng D sai vì SO2 không phản ứng với H2SO4 loãng
Câu 31 :
Cặp chất nào sau đây tác dụng với nhau sinh ra chất khí cháy trong không khí với ngọn lửa màu xanh?
Đáp án : A Lời giải chi tiết :
A đúng vì Zn + HCl → ZnCl2 + H2. H2 cháy dưới ngọn lửa màu xanh B sai vì phản ứng không tạo ra khí C sai vì phản ứng không tạo ra khí D sai vì phản ứng không tạo ra khí
Câu 32 :
Chất nào có thể dùng để nhận biết axit sunfuric và muối sunfat ?
Đáp án : C Lời giải chi tiết :
A sai vì NaCl không phản ứng với cả 2 chất nên không có hiện tượng B sai vì BaCl2 tạo kết tủa trắng với cả 2 chất nên không phân biệt được C đúng vì BaCO3 chỉ pư với H2SO4 tạo khí còn muối sunfat không pư D sai vì có BaCO3 nhận biết được
Câu 33 :
Cặp chất tác dụng với nhau tạo thành sản phẩm có chất khí:
Đáp án : C Lời giải chi tiết :
PTHH: BaCO3 + H2SO4 → BaSO4↓ + H2O + CO2↑
Câu 34 :
Cho 4,8 gam kim loại magie tác dụng vừa đủ với dung dịch axit clohidric. Thể tích khí Hiđro thu được ở đktc là:
Đáp án : B Phương pháp giải :
Đổi số mol của Mg: nMg = mMg : MMg = ? (mol) Viết PTHH xảy ra: Mg + 2HCl → MgCl2 + H2 Tính số mol của H2 theo số mol của Mg: nH2 = nMg = ? (mol) => VH2(đktc) = nH2×22,4 = ? (lít) Lời giải chi tiết :
nMg = mMg : MMg = 4,8 : 24 = 0,2mol PTHH: Mg + 2HCl → MgCl2 + H2 1mol 2mol 1mol 0,2mol ? mol VH2 = nH2 . 22,4 = 0,2 . 22,4 = 4,48l
Câu 35 :
Cho 0,1mol kim loại kẽm vào dung dịch HCl dư. Khối lượng muối thu được là:
Đáp án : A Phương pháp giải :
PTHH: Zn + 2HCl → ZnCl2 + H2 Theo PTHH: nZnCl2 = nZn = 0,1 (mol) => mZnCl2 = nZnCl2 . MZnCl2 = ? (g) Lời giải chi tiết :
PTHH: Zn + 2HCl → ZnCl2 + H2 1mol 2mol 1mol 0,1mol ? mol \({n_{ZnC{l_2}}} = \frac{{0,1.1}}{1} = 0,1mol.\) m ZnCl2 = n ZnCl2 . M ZnCl2 = 0,1 . (65 + 35,5 . 2) = 13,6
Câu 36 :
Khi cho 500ml dung dịch NaOH 1M tác dụng vừa đủ với dung dịch H2SO4 2M tạo thành muối trung hòa. Thể tích dung dịch H2SO4 2M là:
Đáp án : D Lời giải chi tiết :
nNaOH = VNaOH . CM NaOH= 0,5 . 1 = 0,5mol PTHH: 2NaOH + H2SO4 → Na2SO4 + H2O 2 mol 1 mol 0, 5mol ? mol V H2SO4 = n H2SO4 : CM H2SO4 = 0,25 : 2 = 0,125l = 125ml
Câu 37 :
Cho 10,5 gam hỗn hợp hai kim loại Zn, Cu vào dung dịch H2SO4 loãng dư, người ta thu được 2,24 lít khí (đktc). Thành phần phần trăm theo khối lượng mỗi kim loại trong hỗn hợp ban đầu là:
Đáp án : A Phương pháp giải :
Đối số mol: nH2 = VH2 : 22,4 = 2,24 : 22,4 = 0,1 mol PTHH: Zn + H2SO4 → ZnSO4 + H2 Tính số mol Zn theo số mol H2: nZn = nH2 = ? (mol) => mZn = nZn . MZn = ? (mol) %Zn = (mZn : mhh).100% = ? %Cu = 100% - %Zn = ? Lời giải chi tiết :
nH2 = VH2 : 22,4 = 2,24 : 22,4 = 0,1 mol PTHH: Zn + H2SO4 → Zn SO4 + H2 1mol 1mol ? mol 0,1 mol \({n_{Zn}} = \frac{{0,1.1}}{1} = 0,1mol.\) => mZn = MZn . nZn = 0,1 . 65 = 6,5g => %mZn = (6,5 : 10,5) . 100% = 61,90% => % mCu = 38,10%
Câu 38 :
Hòa tan vừa hết 20 gam hỗn hợp CuO và Fe2O3 trong 200 ml dung dịch HCl 3,5M . Khối lượng mỗi oxit trong hỗn hợp là:
Đáp án : A Phương pháp giải :
Gọi x, y lần lượt là số mol của CuO và Fe2O3 CuO + 2HCl → CuCl2 + H2O (1) x → 2x Fe2O3 + 6HCl → 2FeCl3 + 3H2O (2) y → 6y ta có mhh = mCuO + mFe2O3 = 80x + 160y = 20 (I) nHCl = nHCl (1) + nHCl(2) = 2x + 6y = 0,7 (II) Giải hệ (I) và (II) ta có x = ? và y = ? => mCuO = 80x = ? g mFe2O3 =160y = ? g Lời giải chi tiết :
gọi x, y lần lượt là số mol của CuO và Fe2O3 CuO + 2HCl → CuCl2 + H2O (1) x → 2x Fe2O3 + 6HCl → 2FeCl3 + 3H2O (2) y → 6y ta có mhh = mCuO + mFe2O3 = 80x + 160y = 20 (I) nHCl = VHCl . CM HCl = 0,2 . 3,5 = 0,7 mol nHCl = nHCl (1) + nHCl(2) = 2x + 6y = 0,7 (II) Giải hệ (I) và (II) ta có x = 0,05 và y = 0,1 => mCuO = 0,05 . 80 = 4g mFe2O3 = 0,1 . 160 = 16g
Câu 39 :
Hòa tan 7,74 gam hỗn hợp 2 kim loại Mg, Al trong 500ml dung dịch hỗn hợp chứa HCl 1M và H2SO4 0,38M loãng. Thu được dung dịch A và 8,736 lít khí H2 (đktc). Khối lượng muối có trong dung dịch A là
Đáp án : B Phương pháp giải :
So sánh số mol H có trong tổng HCl và H2SO4 với số mol H có trong H2 từ đó rút được axit pư dư, kim loại phản ứng hết TH1: giả sử HCl phản ứng hết, H2SO4 dư Tính được: mmuối 1 = mKL + mHCl + mH2SO4 pư - mH2 = ? TH2: giả sử H2SO4 phản ứng hết, HCl dư Tính được mmuối 2 = mKL + mHCl pư + mH2SO4 - mH2 = ? Vì thực tế phản ứng xảy ra đồng thời nên cả 2 axit đều dư Vì thực tế phản ứng xảy ra đồng thời nên 2 axit cùng dư sau phản ứng ⟹ mmuối 1 < mmuối A < mmuối 2 Lời giải chi tiết :
PTHH: Mg + 2HCl → MgCl2 + H2↑ (1) 2Al + 6HCl → 2AlCl3 + 3H2↑ (2) Mg + H2SO4 → MgSO4 + H2↑ (3) 2Al + 3H2SO4 → Al2(SO4)3 + 3H2↑ (4) 500 ml = 0,5 (lít) \(\left. \begin{array}{l} \Rightarrow {n_{HCl}} = 0,5.1 = 0,5\,(mol)\\ \Rightarrow {n_{{H_2}S{O_4}}} = 0,5.0,38 = 0,19\,(mol)\end{array} \right\} \Rightarrow {n_H} = {n_{HCl}} + 2{n_{H2SO4}} = 0,5 + 2.0,19 = 0,88\,(mol)\) nH2(đktc) = 8,736/22,4 = 0,39 (mol) ⟹ nH = 2nH2 = 2.0,39 = 0,78 (mol) Ta thấy: 0,88 > 0,78 nên axit dư, kim loại phản ứng hết. TH1: giả sử HCl phản ứng hết, H2SO4 dư nHCl = 0,5 (mol) ⟹ nH2 (1)+(2) = 1/2nHCl = 1/2.0,5 = 0,25 (mol) ⟹ nH2 (3)+(4) = 0,39 - 0,25 = 0,14 (mol) ⟹ nH2SO4 pư = 0,14 (mol) Theo ĐL BTKL ta có: mmuối = mKL + mHCl + mH2SO4 pư - mH2 = 7,74 + 0,5.36,5 + 0,14.98 - 0,39.2 = 38,93 (g) TH2: giả sử H2SO4 phản ứng hết, HCl dư nH2SO4 = 0,19 (mol) ⟹ nH2(3)+(4) = 0,19 (mol) ⟹ nH2(1)+(2) = 0,39 - 0,19 = 0,2 (mol) ⟹ nHCl pư = 2.0,2 = 0,4 (mol) Theo ĐLBTKL ta có: mmuối = mKL + mHCl pư + mH2SO4 - mH2 = 7,74 + 0,4.36,5 + 0,19.98 - 0,39.2 = 40,18 (g) Vì thực tế phản ứng xảy ra đồng thời nên cả 2 axit đều dư Suy ra tổng khối lượng muối A thu được là: 38,93 (g) < mmuối A < 40,18 (g)
Câu 40 :
Thể tích khí sinh ra ở đktc khi cho hỗn hợp gồm 9 (g) Al và 6,5 (g) Zn vào 100 ml dung dịch HCl 1M và H2SO4 1M là:
Đáp án : B Phương pháp giải :
Bước 1: viết PTHH xảy ra Bước 2: Nhận thấy: ∑nH2 = 3/2 nAl + nZn ⟹ Số mol nguyên tử H cần dùng để phản ứng hết với kim loại là:nH = 2nH2 = ?2a (mol) Mặt khác, số mol nguyên tử H trong axit có: nH = nHCl + 2nH2SO4 = ?b (mol) Bước 3: So sánh giá trị 2a với b từ đó rút ra kết luận axit hay kim loại phản ứng hết. Mọi tính toán theo chất pư hết. Lời giải chi tiết :
\(\begin{array}{l}{n_{Al}} = \frac{9}{{27}} = \frac{1}{3}\,(mol)\\{n_{Zn}} = \frac{{6,5}}{{65}} = 0,1\,(mol)\\{n_{HCl}} = 0,1 \cdot 1 = 0,1(mol)\\{n_{{H_2}S{O_4}}} = 0,1 \cdot 1 = 0,1(mol)\end{array}\) Các pthh xảy ra là: 2Al + 6HCl → 2AlCl3 + 3H2 (1) 2Al + 3H2SO4 → Al2(SO4)3 + 3H2 (2) Zn + 2HCl → ZnCl2 + H2 (3) Zn + H2SO4 → ZnSO4 + H2 (4) Nhận thấy: ∑nH2 = \(\frac{3}{2}{n_{Al}} + {n_{Zn}} = \frac{3}{2}.\frac{1}{3} + 0,1 = 0,6\,(mol)\) ⟹ Số mol nguyên tử H cần dùng để phản ứng hết với kim loại là: nH = 2nH2 = 2.0,6 = 1,2 (mol) Mặt khác, số mol nguyên tử H trong axit có: nH = nHCl + 2nH2SO4 = 0,1 + 2.0,1 = 0,3 (mol) Ta thấy 1,2 > 0,3 do đó kim loại phản ứng dư, axit hết. Mọi tính toán theo số mol của axit ⟹ nH2 = 1/2nH = 1/2. 0,3 = 0,15 (mol) ⟹ VH2(đktc) = 0,15.22,4 = 3,36 (lít)
Câu 41 :
Cho 8 gam Mg, Fe vào dung dịch HCl vừa đủ. Sau phản ứng thu được m gam muối. Hỏi m nằm trong khoảng nào?
Đáp án : A Phương pháp giải :
* Giả sử hỗn hợp chỉ có Mg * Giả sử hỗn hợp chỉ có Fe Tính lượng muối thu được mỗi trường hợp. Vì hh ban đầu chứa cả Mg và Fe nên: lượng muối do Fe tạo ra < lượng muối thực tế < lượng muối do Mg tạo ra Lời giải chi tiết :
PTHH: Mg + 2HCl → MgCl2 + H2 (1) Fe + 2HCl → FeCl2 + H2 (2) * Giả sử hỗn hợp chỉ có Mg ⟹ mMg = 8 (g) ⟹ \({n_{Mg}} = \frac{{{m_{Mg}}}}{{{M_{Mg}}}} = \frac{8}{{24}} = \frac{1}{3}\,\,(mol)\) Theo PTHH (1): nMgCl2 = nMg = \(\frac{1}{3}\) (mol) ⟹ mMgCl2 = nMgCl2×MMgCl2 = \(\frac{1}{3} \times 95 \approx 31,67\,(g)\) * Giả sử hỗn hợp chỉ có \(Fe\)\( \Rightarrow {n_{Fe}} = \frac{8}{{56}} = \frac{1}{7}(mol)\) Theo PTHH (2): nFeCl2 = nFe = \(\frac{1}{7}(mol)\) ⟹ mFeCl2 = nFeCl2 × MFeCl2 = \(\frac{1}{7} \times 127 \approx 18,14\,(g)\) Vì ban đầu chứa hỗn hợp kim loại nên: mFeCl2 < mmuối thu được < mMgCl2 ⟹ 18,14 < mmuối thu được < 31, 67 (g)
Câu 42 :
Cho 8,4 gam Mg, Zn vào dung dịch H2SO4 vừa đủ. Sau phản ứng thu được dung dịch X, 3,6 (g) chất rắn và 4,48 (l) khí ở đktc. Phần trăm khối lượng kim loại Zn có trong hỗn hợp là:
Đáp án : A Phương pháp giải :
TH1: Giả sử chỉ có phản ứng, Zn chưa phản ứng TH2: Giả sử có cả Mg và Zn đều phản ứng. Biện luận chất rắn thu được theo tính toán với theo đề bài cho mỗi trường hợp để xem trường hợp nào thỏa mãn. Lời giải chi tiết :
- Khí tạo thành sau phản ứng là \({H_2}\) \({n_{{H_2}}} = \frac{{4,48}}{{22,4}} = 0,2(mol)\) - Giả sử chỉ có Mg phản ứng, Zn chưa phản ứng PTHH: Mg + H2SO4 → MgSO4 + H2↑ ⟹ nMg = nH2 = 0,2 (mol) ⟹ mMg = 0,2.24 = 4,8 (g) ⟹ Khối lượng kim loại còn lại là: mKL = 8,4 - 4,8 = 3,6 (g) = 3,6 (g) chất rắn đề bài cho ⟹ 3,6 gam chất rắn thu được sau phản ứng chứa Zn và có thể có Mg dư Suy ra trong hh ban đầu: mMg ≥ mMg pư => mMg bđ ≥ 4,8 (g) \(\begin{array}{l} \Rightarrow \% {m_{Mg}} \ge \frac{{4,8}}{{8,4}}.100\% \\ \Rightarrow \% {m_{Mg}} \ge 57,14\% \end{array}\) ⟹ Phần trăm khối lượng Zn ≤ 100% - 57,14 ⟹ % mZn ≤ 42,86% Dựa vào đáp án ta thấy chỉ có đáp án A thỏa mãn
Câu 43 :
Cho 8 gam Mg, Al vào dung dịch \(HCl\) vừa đủ. Sau phản ứng thu được dung dịch X, 2,36 (g) chất rắn và 6,272 (l) khí ở đktc. Phần trăm khối lượng mỗi kim loại có trong hỗn hợp lần lượt là.
Đáp án : C Phương pháp giải :
TH1: Giả sử chỉ có phản ứng, Al chưa phản ứng TH2: Giả sử có cả Mg và Al đều phản ứng. Biện luận chất rắn thu được theo tính toán với theo đề bài cho mỗi trường hợp để xem trường hợp nào thỏa mãn. Lời giải chi tiết :
- Khí tạo thành sau phản ứng là \({H_2}\) \({n_{{H_2}}} = \frac{{6,272}}{{22,4}} = 0,28(mol)\) - Giả sử chỉ có \(Mg\)phản ứng, Al chưa phản ứng PTHH: Mg + 2HCl → MgCl2 + H2↑ ⟹ nMg = nH2 = 0,28 (mol) ⟹ mMg = 0,28.24 = 6,72 (g) ⟹ Khối lượng kim loại còn lại là: mKL = 8 - 6,72 = 1,28 (g) # 2,36 (g) ⟹ loại. - Giả sử có cả Mg và Al đều phản ứng. Do Mg là kim loại hoạt động mạnh hơn Al nên Mg pư hết trước, sau đó mới đến Al pư. ⟹ Chất rắn còn dư là Al mMg + mAl pu = 8 - 2,36 = 5,64 (g) Đặt nMg = x (mol); nAl pư = y (mol) PTHH: Mg + 2HCl → MgCl2 + H2↑ (mol) x → x 2Al + 6HCl → AlCl3 + 3H2↑ (mol) y → 1,5y Theo bài ra ta có hệ phương trình sau: \(\left\{ \begin{array}{l}\sum {{n_{{H_2}}} = \,} x + 1,5y = 0,28\\\sum {m{\,_{hh}} = \,} 24x + 27y = 5,64\end{array} \right. \Leftrightarrow \left\{ \begin{array}{l}x = 0,1(mol) = {n_{Mg}}\\y = 0,12(mol) = {n_{Al\,pu}}\end{array} \right.\) Phần trăm khối lượng mỗi kim loại có trong hỗn hợp là: \(\left\{ \begin{array}{l}\% {m_{Mg}} = \frac{{{m_{Mg}}}}{{{m_{hh}}}}.100\% = \frac{{0,1.24}}{8}.100\% = 30\% \\\% {m_{Al}} = 100\% - 30\% = 70\% \end{array} \right.\)
Câu 44 :
Hòa tan hoàn toàn hỗn hợp gồm 16 gam CuO và 4 gam MgO trong dung dịch H2SO4 20% vừa đủ. Tính khối lượng dung dịch H2SO4 đã dùng.
Đáp án : B Phương pháp giải :
- Tính số mol CuO và MgO. - Viết các PTHH xảy ra, tính số mol H2SO4 theo CuO và MgO. - Tính khối lượng H2SO4, tính khối lượng dung dịch H2SO4 dựa vào C%: \({m_{{\rm{dd}}}} = \frac{{{m_{ct}}.100}}{{C\% }}\) PTHH: CuO + H2SO4 → CuSO4 + H2O MgO + H2SO4 → MgSO4 + H2O Lời giải chi tiết :
Ta có: \({n_{CuO}} = \frac{{16}}{{80}} = 0,2(mol);{n_{MgO}} = \frac{4}{{40}} = 0,1(mol)\) CuO + H2SO4 → CuSO4 + H2O (mol) 0,2 → 0,2 MgO + H2SO4 → MgSO4 + H2O (mol) 0,1 → 0,1 \( \Rightarrow {\sum n _{{H_2}S{O_4}}} = 0,2 + 0,1 = 0,3(mol) \Rightarrow {m_{{H_2}S{O_4}}} = 0,3.98 = 29,4(g) \Rightarrow {m_{{\rm{dd}}}} = \frac{{29,4.100}}{{20}} = 147(g)\)
Câu 45 :
Hỗn hợp X gồm Fe và Al (với tỉ lệ mol 1 : 1). Hòa tan hoàn toàn m gam X bằng dung dịch HCl dư, sau phản ứng thu được 5,6 lít H2 (đktc). Giá trị của m là:
Đáp án : B Phương pháp giải :
\({n_{{H_2}}}(dktc) = {{5,6} \over {22,4}} = 0,25\,\,(mol)\) Đặt số mol Al = số mol Fe = x (mol) PTHH: 2Al + 6HCl → 2AlCl3 + 3H2↑ x → 1,5x (mol) Fe + 2HCl → FeCl2 + H2↑ x → x (mol) Tổng số mol H2 là: 1,5x + x = 0,25 => x = ? (mol) => mhh = mAl + mFe = 27x + 56x = ? (g) Lời giải chi tiết :
\({n_{{H_2}}}(dktc) = {{5,6} \over {22,4}} = 0,25\,\,(mol)\) Đặt số mol Al = số mol Fe = x (mol) PTHH: 2Al + 6HCl → 2AlCl3 + 3H2↑ x → 1,5x (mol) Fe + 2HCl → FeCl2 + H2↑ x → x (mol) Tổng số mol H2 là: 1,5x + x = 0,25 => x = 0,1 (mol) => mhh = mAl + mFe = 0,1.27 + 0,1.56 = 8,3
Câu 46 :
Hòa tan hoàn toàn 14,4 gam FeO cần vừa đủ V ml dung dịch HCl 2M. Giá trị của V là:
Đáp án : B Phương pháp giải :
Bước 1: Đổi số mol Fe: \({n_{FeO}} = {{{m_{FeO}}} \over {{M_{FeO}}}} = ?\,\,(mol)\) Bước 2: Viết phương trình phản ứng xảy ra, tính mol HCl theo mol FeO Bước 3: Tính VHCl = nHCl : CM = ? Lời giải chi tiết :
\({n_{Fe}} = {{14,4} \over {72}} = 0,2\,\,(mol)\) PTPƯ: FeO + 2HCl → FeCl2 + H2O 0,2 → 0,4 (mol) VHCl = nHCl : CM = 0,4 : 2 = 0,2 (lít) = 200 (ml)
Câu 47 :
Hòa tan m gam oxit sắt cần 150 ml dd HCl 3M . Mặt khác, khử toàn bộ m gam oxit sắt bằng CO nóng, dư thu được 8,4 gam sắt. Công thức oxit sắt là
Đáp án : B Phương pháp giải :
nFe = 8,4/56= 0,15 mol nHCl = 0,15.3=0,45 mol FexOy + 2yHCl→x FeCl2y/x +y H2O nO(oxit) = nHCl/2 = 0,45/2= 0,225mol => Fe:O Lời giải chi tiết :
nFe = 8,4/56= 0,15 mol nHCl = 0,15.3=0,45 mol FexOy + 2yHCl→x FeCl2y/x +y H2O nO(oxit) = nHCl/2 = 0,45/2= 0,225mol => Fe:O = 2:3 => Fe2O3
Câu 48 :
Cho hỗn hợp Al và 1 kim loại hóa trị II tan trong dung dịch H2SO4 loãng vừa đủ thu được dung dịch A và có H2 thoát ra. Cho A tác dụng với dung dịch BaCl2 vừa đủ thấy tách ra 93,2 gam kết tủa trắng. Lọc kết tủa rồi cô cạn nước lọc thu được 36,2 gam muối khan. Khối lượng kim loại ban đầu là
Đáp án : A Phương pháp giải :
nBaSO4 = 93,2/233= 0,4 mol = nBaCl2 => nCl (muối khan) = 2 nBaCl2 = 0,8 mol m muối khan = mKl + mClo = mKl + 0,8.35,5 = 36,2 => mKL Lời giải chi tiết :
nBaSO4 = 93,2/233= 0,4 mol = nBaCl2 => nCl (muối khan) = 2 nBaCl2 = 0,8 mol m muối khan = mKl + mClo = mKl + 0,8.35,5 = 36,2 => mKL= 7,8 g
Câu 49 :
Cho hỗn hợp A gồm Fe và FeS tác dụng với dung dịch HCl dư thu được 2,24 lít hỗn hợp khí X ở điều kiện tiêu chuẩn. Hỗn hợp khí này có tỉ khối so với hiđro là 9. Thành phần phần trăm theo khối lượng của hỗn hợp Fe và FeS ban đầu lần lượt là
Đáp án : A Phương pháp giải :
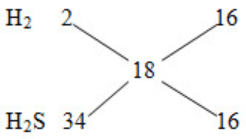
Mhh khí = 9.2=18 (g/mol) nhh khí = V/22,4= 0,1 mol Dùng quy tắc đường chéo, tính được từng mol H2, H2S PTHH: Fe + 2HCl→FeCl2 +H2 FeS +2HCl →FeCl2 + H2S Tính số mol Fe, FeS theo số mol H2 ; H2S => mA = mFe + mFeS => %mFe, %mFeS Lời giải chi tiết :
Mhh khí = 9.2=18 (g/mol) nhh khí = V/22,4= 0,1 mol
=> nH2= nH2S = 0,05 mol Fe + 2HCl→FeCl2 +H2 0,05 0,05 FeS +2HCl →FeCl2 + H2S 0,05 0,05 => mA = mFe + mFeS = 0,05.56 + 0,05.88=7,2 g \(\% {m_{Fe}} = \frac{{{m_{Fe}}}}{{{m_A}}}.100\% = \frac{{0,05.56}}{{7,2}}.100\% = 38,89\% \) %mFeS = 100%- %mFe= 61,11%
Câu 50 :
Hòa tan hết muối cacbonat trung hòa của kim loại A bằng dung dịch H2SO4 vừa đủ nồng độ 19,6% thì thu được dung dịch chứa muối sunfat nồng độ 26,57%. Xác định kim loại A
Đáp án : C Phương pháp giải :
Giả sử dùng 1 mol A2 (CO3)n A2 (CO3)n + nH2SO4 →A2(SO4)n + nH2O + nCO2 1 n 1 n mdd = mA2(CO3)n + mdd H2SO4 -mCO2 \(\frac{{2{\text{A}} + 96n}}{{2{\text{A}} + 60n + \frac{{98n.100}}{{19,6}} - 44n}}.100 = 26,57\) Lời giải chi tiết :
Giả sử dùng 1 mol A2 (CO3)n A2 (CO3)n + nH2SO4 →A2(SO4)n + nH2O + nCO2 1 n 1 n mdd = mA2(CO3)n + mdd H2SO4 -mCO2 \(\frac{{2{\text{A}} + 96n}}{{2{\text{A}} + 60n + \frac{{98n.100}}{{19,6}} - 44n}}.100 = 26,57\) => A= 28n => n=2, A=56 (Fe)
Câu 51 :
Một hỗn hợp kim loại gồm Al, Cu, Fe . Nếu cho hỗn hợp này tác dụng với dung dịch HCl dư thì thu được 8,96 lít khí (đktc) và 9 gam chất rắn. Nếu cho hỗn hợp này tác dụng vừa đủ với dung dịch NaOH thì phải dùng 100 ml dung dịch NaOH 2M. % khối lượng của Fe trong hỗn hợp là
Đáp án : C Phương pháp giải :
mchất rắn = mCu = 9 gam nNaOH= 0,1.2=0,2 mol nH2= V/22,4= 0,4 mol Al + NaOH +H2O →NaAlO2 + \(\frac{3}{2}\)H2 2Al +6HCl →2AlCl3 + 3H2 Fe + 2HCl→FeCl2 + H2 Đặt số mol các chất vào PTHH, tính toán theo PTHH => mhh = mAl + mFe + mCu => %mFe Lời giải chi tiết :
mchất rắn = mCu = 9 gam nNaOH= 0,1.2=0,2 mol nH2= V/22,4= 0,4 mol Al + NaOH +H2O →NaAlO2 + \(\frac{3}{2}\)H2 0,2 0,2 2Al +6HCl →2AlCl3 + 3H2 0,2 0,3 Fe + 2HCl→FeCl2 + H2 0,1 0,1 => mhh = mAl + mFe + mCu = 0,2.27+0,1.56+ 9= 20 gam => \(\% {m_{Fe}} = \frac{{{m_{Fe}}}}{{{m_{hh}}}}.100\% = \frac{{0,1.56}}{{20}}.100\% = 28\% \)
Câu 52 :
Cho 122,4g hỗn hợp X gồm Cu, Fe3O4 vào dung dịch H2SO4 đặc, nóng thu được 10,08 lít SO2 (đktc), dung dịch Y và còn lại 4,8g kim loại. Cô cạn dung dịch Y thu được m gam muối khan. Tính m.
Đáp án : C Phương pháp giải :
2Fe3O4 + 10H2SO4(đ) \(\xrightarrow{{{t^0}}}\) 3Fe2(SO4)3 + SO2 + 10H2O (1) x (mol) → Cu + 2H2SO4 (đ) \(\xrightarrow{{{t^0}}}\) CuSO4 + SO2 + 2H2O (2) y (mol) → y Cu + Fe2(SO4)3 \(\xrightarrow{{}}\) CuSO4 + 2FeSO4 (3) 1,5x ←1,5x Do sau phản ứng còn 4,8 gam kim loại dư nên dd Y là FeSO4, CuSO4. Kim loại dư là Cu. Lời giải chi tiết :
2Fe3O4 + 10H2SO4(đ) \(\xrightarrow{{{t^0}}}\) 3Fe2(SO4)3 + SO2 + 10H2O (1) x (mol) → Cu + 2H2SO4 (đ) \(\xrightarrow{{{t^0}}}\) CuSO4 + SO2 + 2H2O (2) y (mol) → y Cu + Fe2(SO4)3 \(\xrightarrow{{}}\) CuSO4 + 2FeSO4 (3) 1,5x ←1,5x Do sau phản ứng còn 4,8 gam kim loại dư nên dd Y là FeSO4, CuSO4. Kim loại dư là Cu. Gọi số mol Fe3O4 là x; số mol Cu pư ở (2) là y (x, y>0) Theo (1), (3): \({n_{Cu}} = \frac{3}{2}{n_{F{e_3}{O_4}}} = 1,5x\) Khối lượng Fe3O4 và Cu phản ứng: 232x + 64(y+1,5x) = 122,4 - 4,8 →328x + 64y = 117,6 (I) Theo (1), (2): \({n_{S{O_2}}} = \frac{x}{2} + y = \frac{{10,08}}{{22,4}} = 0,45\) Giải hệ: \(\left\{ \begin{gathered} Theo (2), (3): \({n_{C{\text{uS}}{O_4}}} = y + 1,5x = 0,75(mol)\) Theo (1), (3): \0({n_{{\text{FeS}}{O_4}}} = 3x = 0,9(mol)\) Khối lượng muối: m = 0,75.160 + 0,9.152=256,8(g)
|



















Danh sách bình luận