Trắc nghiệm Bài 10. Một số muối quan trọng - Hóa học 9Đề bài
Câu 1 :
Trong tự nhiên muối natri clorua có nhiều trong:
Có những muối sau: CaCO3, CaSO4, Pb(NO3)2, NaCl. Muối nào nói trên: Câu 2
Không được phép có trong nước ăn vì tính độc hại của nó?
Câu 3
Không độc nhưng cũng không được có trong nước ăn vì vị mặn của nó?
Câu 4
Không tan trong nước, nhưng bị phân hủy ở nhiệt độ cao?
Câu 5
Rất ít tan trong nước và khó bị phân hủy ở nhiệt độ cao?
Câu 6 :
Nung kali nitrat (KNO3) ở nhiệt độ cao, ta thu được chất khí là:
Câu 7 :
Muối kali nitrat (KNO3):
Câu 8 :
Để làm sạch dung dịch NaCl có lẫn Na2SO4 ta dùng:
Câu 9 :
Trộn những cặp chất nào sau đây ta thu được NaCl ?
Câu 10 :
Hai dung dịch tác dụng với nhau, sản phẩm thu được có NaCl. Hãy cho biết hai cặp dung dịch các chất đã dùng ban đầu là
Câu 11 :
Điện phân dung dịch NaCl bão hoà, có màng ngăn giữa hai điện cực, sản phẩm thu được là:
Câu 12 :
Trường hợp nào tạo ra chất kết tủa khi trộn hai dung dịch sau ?
Câu 13 :
Cho phương trình phản ứng: Na2CO3 + 2HCl → 2NaCl + X + H2O. X là:
Câu 14 :
Hoà tan 50 gam muối ăn vào 200 gam nước thu được dung dịch có nồng độ là:
Câu 15 :
Để có được dung dịch NaCl 32%, thì khối lượng NaCl cần lấy hoà tan vào 200 gam nước là:
Câu 16 :
Hoà tan 10,95 gam KNO3 vào 150 gam nước thì được dung dịch bão hoà ở 200C, độ tan của KNO3 ở nhiệt độ này là
Câu 17 :
Cho 500 ml dung dịch NaCl 2M tác dụng với 600 ml dung dịch AgNO3 2M. Khối lượng kết tủa thu được là
Câu 18 :
Trong phòng thí nghiệm, người ta thường dùng muối KNO3 để điều chế khí oxi bằng phản ứng phân hủy. Để điều chế 1,12 lít khí O2 (đktc) thì khối lượng muối cần dùng là
Câu 19 :
Có thể phân biệt BaCl2 và NaCl bằng dung dịch:
Câu 20 :
Có những muối sau: NaCl, Pb(NO3)2, KNO3, CaCO3. Muối nào trong các muối trên dùng làm thuốc nổ đen
Câu 21 :
Dung dịch muối NaHSO4 phản ứng được với tất cả các chất nào trong dãy sau:
Câu 22 :
Có 2 dung dịch muối mất nhãn là dung dịch NaCl và KNO3. Thuốc thử để nhận biết hai dung dịch trên là
Câu 23 :
Muối nào sau đây dễ bị nhiệt phân hủy sinh ra khí CO2
Câu 24 :
Dung dịch NaOH có thể dùng để phân biệt cặp muối nào sau đây
Câu 25 :
Cặp chất nào sau đây phản ứng với nhau thu được sản phẩm là NaCl
Câu 26 :
Điện phân nóng chảy NaCl thu được sản phẩm gồm:
Câu 27 :
Dung dịch muối nào sau đây làm quỳ tím chuyển sang màu đỏ
Câu 28 :
Cho dung dịch Na2SO4 vào dung dịch BaCl2 thấy
Câu 29 :
Hiện tượng khi thêm vài giọt dung dịch H2SO4 vào dung dịch BaCl2 là:
Câu 30 :
Dãy hợp chất nào sau đây gồm các muối?
Câu 31 :
CaCO3 có thể tham gia phản ứng với
Câu 32 :
Để phân biệt hai dung dịch Na2CO3 và NaCl ta có thể dùng chất có công thức
Câu 33 :
Để phân biệt các chất đựng trong lọ riêng biệt sau: NaNO3, Cu(NO3)2, Fe(NO3)3, Ba(NO3)2 người ta cần sử dụng hóa chất nào?
Câu 34 :
Dung dịch muối FeCl2 tác dụng được với tất cả các chất nào trong dãy chất sau:
Câu 35 :
Nung sắt(II)nitorat (Fe(NO3)2) ở nhiệt độ cao, ta thu được sản phẩm là:
Câu 36 :
Để nhận biết 3 dung dịch bị mất nhãn : Na2SO4 , HCl , H2SO4 loãng , người ta dùng :
Câu 37 :
Cho 200ml dung dịch KOH 1M tác dụng vừa đủ dung dịch MgSO4 2M. Tính thể tích dung dịch MgSO4 2M cần dùng
Câu 38 :
Cho V (lít) CO2 (đktc) hấp thụ hết vào 200 ml dung dịch Ca(OH)2 1M thu được 15 gam kết tủa. Giá trị của V là
Câu 39 :
Nung nóng muối A (công thức tổng quát nCaX2.H2O) trong điều kiện không có không khí ở 5000C thu được CaCO3 và hỗn hợp hơi B. Khối lượng CaCO3 thu được chỉ bằng 59,9% so với khối lượng muối A đem nung ban đầu. Tỷ khối hơi của B so với CO2 là 1,015. Toàn bộ B được cho vào CaO(rắn, dư) và làm lạnh để ngưng tụ toàn bộ hệ, thu được hỗn hợp C. Phân tích C cho thấy ngoài CaO dư còn có một chất vô cơ D và một chất hữu cơ E có tỷ lệ mol D:E là 1:2. Đốt cháy hoàn toàn 5,8 g E, cho toàn bộ sản phẩm vào dung dịch nước vôi trong dư, thu được 30 gam kết tủa. Xác định n và X trong công thức của A.
Câu 40 :
Nhiệt phân hoàn toàn 25 g hỗn hợp MgCO3, CaCO3 , BaCO3 thu được khí B. Cho khí B hấp thụ hết vào nước vôi trong thu được 15 gam kết tủa và dung dịch C. Đun nóng dung dịch C tới phản ứng hoàn toàn thấy tạo thành thêm 6 gam kết tủa. Hỏi % khối lượng của MgCO3 nằm trong khoảng nào?
Câu 41 :
Hoà tan hoàn toàn 25,2 g một muối cacbonat của kim loại hóa trị II bằng dung dịch HCl 7,3% (D = 1,038 g/ml). Cho toàn bộ khí CO2 thu được vào 500 ml dung dịch NaOH 2M, sau phản ứng đem cô cạn thì thu được 47,8 gam chất rắn. Biết các phản ứng xảy ra hoàn toàn. a/ Xác định CTHH của muối cacbonat
Câu 42 :
Trộn 30ml dd có chứa 1,04 g BaCl2 với 170ml dd có chứa 3,4g AgNO3. Tính CM của chất còn lại trong dd sau phản ứng. Biết thể tích dd thay đổi không đáng kể.
Câu 43 :
Hòa tan 10 gam hỗn hợp muối XCO3 và Y2(CO3)3 bằng dd HCl dư thư được dd A và 0,672 lít khí ở đktc.Khối lượng muối khan thu được sau phản ứng là
Câu 44 :
Cho dung dịch AgNO3 dư tác dụng với hỗn hợp có hòa tan 12,5 gam hai muối KCl và KBr thu được 20,78 gam hỗn hợp AgCl và AgBr. Thành phần % của muối AgCl trong hỗn hợp thu được sau phản ứng là.
Câu 45 :
Cho 8,4 gam Fe vào dung dịch chứa 0,4 mol AgNO3. Kết thúc phản ứng khối lượng muối thu được là.
Câu 46 :
Cho 0,1 mol Ba(OH)2 vào dung dịch NH4NO3 dư thì thể tích thoát ra ở đktc là :
Lời giải và đáp án
Câu 1 :
Trong tự nhiên muối natri clorua có nhiều trong:
Đáp án : A Lời giải chi tiết :
Trong tự nhiên muối natri clorua có nhiều trong: nước biển Có những muối sau: CaCO3, CaSO4, Pb(NO3)2, NaCl. Muối nào nói trên: Câu 2
Không được phép có trong nước ăn vì tính độc hại của nó?
Đáp án : C Phương pháp giải :
Xem lại lí thuyết một số muối quan trọng Lời giải chi tiết :
Muối không được phép có trong nước ăn vì tính độc hại của nó là Pb(NO3)2. Câu 3
Không độc nhưng cũng không được có trong nước ăn vì vị mặn của nó?
Đáp án : D Phương pháp giải :
Xem lại lí thuyết một số muối quan trọng Lời giải chi tiết :
Muối không độc nhưng cũng không được có trong nước ăn vì vị mặn của nó là NaCl. Câu 4
Không tan trong nước, nhưng bị phân hủy ở nhiệt độ cao?
Đáp án : A Phương pháp giải :
Xem lại lí thuyết một số muối quan trọng Lời giải chi tiết :
Muối không tan trong nước, nhưng bị phân hủy ở nhiệt độ cao là CaCO3. Câu 5
Rất ít tan trong nước và khó bị phân hủy ở nhiệt độ cao?
Đáp án : B Phương pháp giải :
Xem lại lí thuyết một số muối quan trọng Lời giải chi tiết :
Muối rất ít tan trong nước và khó bị phân hủy ở nhiệt độ cao là CaSO4.
Câu 6 :
Nung kali nitrat (KNO3) ở nhiệt độ cao, ta thu được chất khí là:
Đáp án : D Lời giải chi tiết :
KNO3 bị nhiệt phân: 2KNO3 $\xrightarrow{{{t^o}}}$2KNO2 + O2 => chất khí thu được là O2
Câu 7 :
Muối kali nitrat (KNO3):
Đáp án : C Lời giải chi tiết :
Muối kali nitrat (KNO3) là chất rắn, tan nhiều trong nước, khi tan thu nhiệt.
Câu 8 :
Để làm sạch dung dịch NaCl có lẫn Na2SO4 ta dùng:
Đáp án : C Phương pháp giải :
Cần nắm được tính chất hóa học của muối Na2SO4 và NaCl Lời giải chi tiết :
Để làm sạch dung dịch NaCl có lẫn Na2SO4 ta dùng dung dịch BaCl2 vì tạo kết tủa với Na2SO4 và chỉ còn lại dung dịch NaCl Na2SO4 + BaCl2 → BaSO4 + 2NaCl
Câu 9 :
Trộn những cặp chất nào sau đây ta thu được NaCl ?
Đáp án : A Phương pháp giải :
Cần nắm được tính chất hóa học của muối tác dụng với muối Lời giải chi tiết :
Thu được NaCl bằng cách trộn dung dich Na2CO3 và dung dịch BaCl2 vì xảy ra phản ứng: Na2CO3 + BaCl2 → BaCO3 ↓ + 2NaCl
Câu 10 :
Hai dung dịch tác dụng với nhau, sản phẩm thu được có NaCl. Hãy cho biết hai cặp dung dịch các chất đã dùng ban đầu là
Đáp án : B Phương pháp giải :
Để thu được sản phẩm là NaCl => 2 chất ban đầu tác dụng với nhau, ngoài sản phẩm là NaCl thì chất còn lại là kết tủa hoặc chất khí hoặc H2O Lời giải chi tiết :
Để thu được sản phẩm là NaCl => 2 chất ban đầu tác dụng với nhau, ngoài sản phẩm là NaCl thì chất còn lại là kết tủa hoặc chất khí hoặc H2O => 2 chất là MgCl2 và NaOH PTHH: MgCl2 + 2NaOH → Mg(OH)2 + 2NaCl
Câu 11 :
Điện phân dung dịch NaCl bão hoà, có màng ngăn giữa hai điện cực, sản phẩm thu được là:
Đáp án : A Phương pháp giải :
Xem lại phản ứng điện phân NaCl Lời giải chi tiết :
PT điện phân: 2NaCl + 2H2O $\xrightarrow[{có\,\,màng\,\,ngăn}]{{đpdd}}$ 2NaOH + H2 + Cl2
Câu 12 :
Trường hợp nào tạo ra chất kết tủa khi trộn hai dung dịch sau ?
Đáp án : A Phương pháp giải :
Cần nắm được tính chất hóa học của muối tác dụng với muối Lời giải chi tiết :
Trường hợp tạo ra chất kết tủa là : NaCl phản ứng với AgNO3 NaCl + AgNO3 → AgCl↓ + NaNO3
Câu 13 :
Cho phương trình phản ứng: Na2CO3 + 2HCl → 2NaCl + X + H2O. X là:
Đáp án : B Phương pháp giải :
Cần nắm được tính chất của muối tác dụng với dung dịch axit Lời giải chi tiết :
PTHH: Na2CO3 + 2HCl → 2NaCl + CO2 ↑ + H2O => khí X là CO2
Câu 14 :
Hoà tan 50 gam muối ăn vào 200 gam nước thu được dung dịch có nồng độ là:
Đáp án : B Phương pháp giải :
Áp dụng công thức: $C\% = \frac{{{m_{ct}}}}{{{m_{dd}}}}.100\% $ Lời giải chi tiết :
$C\% = \frac{{{m_{ct}}}}{{{m_{dd}}}}.100\% = \frac{{50}}{{50 + 200}}.100\% = 20\% $
Câu 15 :
Để có được dung dịch NaCl 32%, thì khối lượng NaCl cần lấy hoà tan vào 200 gam nước là:
Đáp án : B Phương pháp giải :
Áp dụng công thức: $C\% = \frac{{{m_{ct}}}}{{{m_{dd}}}}.100\% $ Lời giải chi tiết :
Gọi khối lượng NaCl cần dùng là m (gam) => mdung dịch = mNaCl + mH2O = m + 200 $C\% = \frac{{{m_{ct}}}}{{{m_{dd}}}}.100\% = > \frac{m}{{m + 200}}.100\% = 32\% = > m = 94,12\,\,gam$
Câu 16 :
Hoà tan 10,95 gam KNO3 vào 150 gam nước thì được dung dịch bão hoà ở 200C, độ tan của KNO3 ở nhiệt độ này là
Đáp án : C Phương pháp giải :
150 gam nước hòa tan được 10,95 gam KNO3 100 gam nước hòa tan được S gam KNO3 => áp dung tích chéo Lời giải chi tiết :
- Độ tan (S) của một chất trong nước là số gam chất đó hòa tan trong 100 gam nước để tạo thành dung dịch bão hòa ở một nhiệt độ xác định. 150 gam nước hòa tan được 10,95 gam KNO3 100 gam nước hòa tan được S gam KNO3 => độ tan $S = \frac{{100.10,95}}{{150}} = 7,3\,\,gam$
Câu 17 :
Cho 500 ml dung dịch NaCl 2M tác dụng với 600 ml dung dịch AgNO3 2M. Khối lượng kết tủa thu được là
Đáp án : A Phương pháp giải :
Xét dư thừa => tính số mol AgCl theo chất hết Lời giải chi tiết :
${n_{NaCl}} = 0,5.2 = 1\,\,mol;\,\,{n_{AgN{O_3}}} = 0,6.2 = 1,2\,\,mol$ NaCl + AgNO3 → AgCl↓ + NaNO3 Xét tỉ lệ: $\frac{{{n_{NaCl}}}}{1} = 1\,\, < \,\,\frac{{{n_{AgN{O_3}}}}}{1} = 1,2$ => NaCl hết, AgNO3 dư => phản ứng tính theo NaCl Theo phương trình: ${n_{AgCl}} = {n_{NaCl}} = 1\,\,mol\,\, = > \,\,{m_{AgCl}} = 143,5\,\,gam$
Câu 18 :
Trong phòng thí nghiệm, người ta thường dùng muối KNO3 để điều chế khí oxi bằng phản ứng phân hủy. Để điều chế 1,12 lít khí O2 (đktc) thì khối lượng muối cần dùng là
Đáp án : B Phương pháp giải :
+) 2KNO3 $\xrightarrow{{{t^o}}}$ 2KNO2 + O2 +) ${n_{KN{O_3}}} = 2.{n_{{O_2}}}\, = > {m_{KN{O_3}}}$ Lời giải chi tiết :
${n_{{O_2}}} = \frac{{1,12}}{{22,4}} = 0,05\,\,mol$ PTHH: 2KNO3 $\xrightarrow{{{t^o}}}$ 2KNO2 + O2 Theo phương trình: ${n_{KN{O_3}}} = 2.{n_{{O_2}}} = 0,1\,\,mol\, = > {m_{KN{O_3}}} = 0,1.101 = 10,1\,\,gam$
Câu 19 :
Có thể phân biệt BaCl2 và NaCl bằng dung dịch:
Đáp án : A Phương pháp giải :
Ta thấy đây là 2 muối của Cl- => chọn thuốc thử dựa vào dấu hiệu nhận biết cation Ba2+ và Na+. Mà ion Na+ thì không có thuốc thử đặc trưng để nhận biết => chọn thuốc thử đặc trưng nhận biết Ba2+ Lời giải chi tiết :
Dùng H2SO4 để phân biệt BaCl2 và NaCl + BaCl2 tạo kết tủa trắng, còn NaCl thì không có hiện tượng gì H2SO4 + BaCl2 → BaSO4↓ trắng + 2HCl
Câu 20 :
Có những muối sau: NaCl, Pb(NO3)2, KNO3, CaCO3. Muối nào trong các muối trên dùng làm thuốc nổ đen
Đáp án : B Phương pháp giải :
Dựa vào ứng dụng của một số muối trong sgk hóa 9 - trang 35. Lời giải chi tiết :
KNO3 là muối dùng làm thuốc nổ đen
Câu 21 :
Dung dịch muối NaHSO4 phản ứng được với tất cả các chất nào trong dãy sau:
Đáp án : A Lời giải chi tiết :
A. Thỏa mãn pư được với tất cả các chất. PTHH: Na2O + 2NaHSO4 → 2Na2SO4 + H2O NaOH + NaHSO4 → Na2SO4 + H2O Fe + 2NaHSO4 → Na2SO4 + Fe2SO4 + H2↑ Ca(HCO3)2 + 2NaHSO4 → CaSO4 + Na2SO4 + 2CO2↑ + 2H2O B. Loại Cu không phản ứng vì là kim loại đứng sau H trong dãy điện hóa học của kim loại. C. Loại NaCl không phản ứng do không thỏa mãn điều kiện sản phẩm sinh ra chất kết tủa hoặc bay hơi. D. Loại NaCl và Cu không phản ứng
Câu 22 :
Có 2 dung dịch muối mất nhãn là dung dịch NaCl và KNO3. Thuốc thử để nhận biết hai dung dịch trên là
Đáp án : D Lời giải chi tiết :
Dùng dung dịch AgNO3 để phân biệt 2 dd trên vì khi cho vào ta thấy: + Xuất hiện kết tủa trắng là dd NaCl PTHH: NaCl + AgNO3 → AgCl↓(trắng) + NaNO3 + Không có hiện tượng gì là KNO3
Câu 23 :
Muối nào sau đây dễ bị nhiệt phân hủy sinh ra khí CO2
Đáp án : B Lời giải chi tiết :
A,C không bị phân hủy B. PTHH: Ca(HCO3)2\(\xrightarrow{{{t^0}}}\) CaCO3↓ + CO2↑ + H2O ⟹ thỏa mãn thu được CO2 D. PTHH: KNO3 \(\xrightarrow{{{t^0}}}\) KNO2 + 1/2O2↑ ⟹ loại vì không thu được O2
Câu 24 :
Dung dịch NaOH có thể dùng để phân biệt cặp muối nào sau đây
Đáp án : B Lời giải chi tiết :
A,C,D Loại vì NaOH không có phản ứng với cả 2 chất B. Thỏa mãn vì khi cho dd NaOH vào ta có hiện tượng: + không có hiện tượng gì là dd NaHSO4 PTHH: NaHSO4 + NaOH → Na2SO4 + H2O + xuất hiện kết tủa trắng là Ba(HCO3)2 PTHH: Ba(HCO3)2 + 2NaOH → BaCO3↓ + Na2CO3 + 2H2O
Câu 25 :
Cặp chất nào sau đây phản ứng với nhau thu được sản phẩm là NaCl
Đáp án : B Lời giải chi tiết :
A,C,D không có phản ứng hóa học xảy ra B. PTHH: NaOH + HCl → NaCl + H2O
Câu 26 :
Điện phân nóng chảy NaCl thu được sản phẩm gồm:
Đáp án : C Lời giải chi tiết :
PTHH: \(2NaCl\xrightarrow{{dpnc}}2Na + C{l_2}\)
Câu 27 :
Dung dịch muối nào sau đây làm quỳ tím chuyển sang màu đỏ
Đáp án : B Lời giải chi tiết :
NaHSO4 là muối axit, có tính chất như một axit mạnh nên làm quỳ tím chuyển sang màu đỏ
Câu 28 :
Cho dung dịch Na2SO4 vào dung dịch BaCl2 thấy
Đáp án : B Lời giải chi tiết :
Phản ứng sinh ra kết tủa trắng BaSO4. PTHH: Na2SO4 + BaCl2 → BaSO4↓ + 2HCl
Câu 29 :
Hiện tượng khi thêm vài giọt dung dịch H2SO4 vào dung dịch BaCl2 là:
Đáp án : B Lời giải chi tiết :
Hiện tượng: xuất hiện kết tủa trắng H2SO4 + BaCl2 → BaSO4↓ trắng + 2HCl
Câu 30 :
Dãy hợp chất nào sau đây gồm các muối?
Đáp án : B Phương pháp giải :
Dựa vào khái niệm về muối: Phân tử muối gồm có một hay nhiều nguyên tử kim loại liên kết với một hay nhiều gốc axit Lời giải chi tiết :
A. Loại HCl là axit B. Thỏa mãn tất cả đều là muối C. Loại H2SO4 là axit còn NaOH là bazo D. Loại CaO là oxit bazo, Ba(OH)2 là bazo
Câu 31 :
CaCO3 có thể tham gia phản ứng với
Đáp án : A Lời giải chi tiết :
CaCO3 có thể phản ứng với HCl CaCO3 + 2HCl → CaCl2 + H2O + CO2↑
Câu 32 :
Để phân biệt hai dung dịch Na2CO3 và NaCl ta có thể dùng chất có công thức
Đáp án : B Lời giải chi tiết :
Để phân biệt hai dung dịch Na2CO3 và NaCl ta có thể dùng chất HCl vì Na2CO3 + 2HCl → 2NaCl + H2O + CO2 còn NaCl không tác dụng nên không có hiện tượng
Câu 33 :
Để phân biệt các chất đựng trong lọ riêng biệt sau: NaNO3, Cu(NO3)2, Fe(NO3)3, Ba(NO3)2 người ta cần sử dụng hóa chất nào?
Đáp án : A Lời giải chi tiết :
Trích mẫu thử của từng chất vào các ống nghiệm riêng biệt và đánh dấu tương ứng - Cho dung dịch NaOH dư vào 4 ống nghiệm trên +ống nghiệm nào xuất hiện kết tủa màu xanh thì ống nghiệm đó chứ Cu(NO3)2 3NaOH + Cu(NO3)2 → Cu(OH)2↓ + 2NaNO3 + ống nghiệm nào xuất hiện kết tủa màu nâu đỏ thì ống nghiệm đó chứa Fe(NO3)3 3NaOH + Fe(NO3)3 → Fe(OH)3↓ + 3NaNO3 + ống nghiệm nào không có hiện tượng hig chứa NaNO3 và Ba(NO3)2 - Cho H2SO4 dư vào 2 dung dịch chưa phân biệt được NaNO3 và Ba(NO3)2 + ống nghiệm xuất hiện kết tủa màu trắng là Ba(NO3)2 H2SO4 + Ba(NO3)2 → BaSO4↓ + 2HNO3
Câu 34 :
Dung dịch muối FeCl2 tác dụng được với tất cả các chất nào trong dãy chất sau:
Đáp án : D Lời giải chi tiết :
FeCl2 + Mg → MgCl2 + Fe↓ FeCl2 + KOH → Fe(OH)2↓ + 2KCl FeCl2 + NaOH → Fe(OH)2↓ + 2NaCl FeCl2 + 2AgNO3 → 2AgCl↓ + Fe(NO3)2
Câu 35 :
Nung sắt(II)nitorat (Fe(NO3)2) ở nhiệt độ cao, ta thu được sản phẩm là:
Đáp án : D Lời giải chi tiết :
Đây là trường hợp đặc biệt: 4Fe(NO3)2 → 2Fe2O3 + 4NO2 + 5O2
Câu 36 :
Để nhận biết 3 dung dịch bị mất nhãn : Na2SO4 , HCl , H2SO4 loãng , người ta dùng :
Đáp án : B Lời giải chi tiết :
Lấy mẫu thử của 3 dung dịch Dùng quì tím + Na2SO4 không làm quì đổi màu + HCl và H2SO4 làm quì hóa đỏ Dùng BaCl2 nhận biết HCl và H2SO4 + không có hiện tượng là HCl + Xuất hiện kết tủa trắng là H2SO4 BaCl2 + H2SO4 → BaSO4+ 2HCl
Câu 37 :
Cho 200ml dung dịch KOH 1M tác dụng vừa đủ dung dịch MgSO4 2M. Tính thể tích dung dịch MgSO4 2M cần dùng
Đáp án : A Lời giải chi tiết :
Đổi 200 ml = 0,2 (lít) nKOH = VKOH. CM KOH = 0,2.1 = 0,2 (mol) PTHH: 2KOH + MgSO4→ Mg(OH)2↓ + K2SO4 Theo PTHH: nMgSO4 = 1/2 nKOH = 1/2. 0,2 = 0,1 (mol) → VMgSO4 = 0,1 : 2 = 0,05 lít
Câu 38 :
Cho V (lít) CO2 (đktc) hấp thụ hết vào 200 ml dung dịch Ca(OH)2 1M thu được 15 gam kết tủa. Giá trị của V là
Đáp án : D Phương pháp giải :
Ta thấy nCaCO3 < nCa(OH)2 nên có 2 trường hợp xảy ra TH1: Phản ứng chỉ tạo ra muối CaCO3. Khi đó CO2 pư hết, dd Ca(OH)2 dư. Mọi tính toán theo số mol CO2 và CaCO3 TH2: Phản ứng tạo cả muối CaCO3 và Ca(HCO3)2. Khi đó cả CO2 và Ca(OH)2 cùng phản ứng hết. Mọi tính toán theo số mol của Ca(OH)2, CO2 và CaCO3. Lời giải chi tiết :
200 ml = 0,2 (lít) nCa(OH)2 = V. CM = 0,2.1 = 0,2 (mol) nCaCO3 = mCaCO3 : MCaCO3 = 15 : 100 = 0,15 (mol) Ta thấy nCaCO3 < nCa(OH)2 nên có 2 trường hợp xảy ra TH1: Phản ứng chỉ tạo ra muối CaCO3. Khi đó CO2 pư hết, dd Ca(OH)2 dư. Mọi tính toán theo số mol CO2 và CaCO3 PTHH: CO2 + Ca(OH)2 → CaCO3↓ + H2O (1) (mol) 0,15 ← 0,15 Theo PTHH (1): nCO2 = nCaCO3 = 0,15 (mol) ⟹ VCO2(đktc) = 0,15.22,4 = 3,36 (lít) TH2: Phản ứng tạo cả muối CaCO3 và Ca(HCO3)2. Khi đó cả CO2 và Ca(OH)2 cùng phản ứng hết. Mọi tính toán theo số mol của Ca(OH)2, CO2 và CaCO3. PTHH: CO2 + Ca(OH)2 → CaCO3↓ + H2O (2) (mol) 0,15 0,15 ← 0,15 2CO2 + 2Ca(OH)2 → Ca(HCO3)2 (3) Theo PTHH (2): nCa(OH)2(2) = nCaCO3 =0,15 (mol) ⟹ nCa(OH)2(3) = nCa(OH)2 ban đầu - nCa(OH)2(2) = 0,2 - 0,15 = 0,05 (mol) Theo PTHH (3): nCO2 = 2nCa(OH)2(3) = 2.0,05 = 0,1 (mol) Theo PTHH (2): nCO2(2) = nCaCO3 = 0,15 (mol) ⟹ ∑nCO2 (2)+(3) = 0,15 + 0,1 = 0,25 (mol) ⟹ VCO2(đktc) = 0,25.22,4 = 5,6 (lít)
Câu 39 :
Nung nóng muối A (công thức tổng quát nCaX2.H2O) trong điều kiện không có không khí ở 5000C thu được CaCO3 và hỗn hợp hơi B. Khối lượng CaCO3 thu được chỉ bằng 59,9% so với khối lượng muối A đem nung ban đầu. Tỷ khối hơi của B so với CO2 là 1,015. Toàn bộ B được cho vào CaO(rắn, dư) và làm lạnh để ngưng tụ toàn bộ hệ, thu được hỗn hợp C. Phân tích C cho thấy ngoài CaO dư còn có một chất vô cơ D và một chất hữu cơ E có tỷ lệ mol D:E là 1:2. Đốt cháy hoàn toàn 5,8 g E, cho toàn bộ sản phẩm vào dung dịch nước vôi trong dư, thu được 30 gam kết tủa. Xác định n và X trong công thức của A.
Đáp án : A Lời giải chi tiết :
Nhiệt phân A tạo ra chất hữu cơ E => A là muối ngậm nước của axit hữu cơ Khi nhiệt phân muối canxi của axit hữu cơ ta thu được anđehit/xeton (E) và CaCO3 Như vậy B gồm: H2O và anđehit/xeton (E) Khi cho hỗn hợp B qua CaO thì chỉ có H2O bị hấp thụ: CaO + H2O → Ca(OH)2 (D) Giả sử nCa(OH)2 = 1 mol; nE = 2 mol => nH2O = nCa(OH)2 = 1 mol - Xét hỗn hợp B: MB = 1,015.44 = 44,66 Áp dụng phương pháp đường chéo ta có:
- Xét phản ứng đốt cháy 5,8 gam E: nE = 5,8 : 58 = 0,1 mol; nCO2 = nCaCO3 = 30 : 100 = 0,3 mol => Số C trong E = nCO2 : nE = 0,3 : 0,1 = 3 Vậy suy ra E có CTPT là C3H6O - Xét phản ứng nhiệt phân 1mol muối A: nCaX2.H2O \(\xrightarrow{{{t^o}}}\) nCaCO3 + 2C3H6O + H2O BTKL: mA = m sản phẩm = 100n + 2.58 + 18 = 100n + 134 (g) Mà CaCO3 bằng 59,9% khối lượng của A nên ta có phương trình: \(\frac{{100n}}{{100n + 134}}.100\% = 59,9\% \) => n = 2 => A có dạng là 2CaX2.H2O Ta thấy 1 mol muối A nặng 100.2 + 134 = 334 gam => MA = 334 (g/mol) => 2(40 + 2MX) + 18 = 334 => MX = 59 => X là CH3COO- Vậy suy ra A là 2(CH3COO)2Ca.H2O; E là CH3-CO-CH3 (axeton)
Câu 40 :
Nhiệt phân hoàn toàn 25 g hỗn hợp MgCO3, CaCO3 , BaCO3 thu được khí B. Cho khí B hấp thụ hết vào nước vôi trong thu được 15 gam kết tủa và dung dịch C. Đun nóng dung dịch C tới phản ứng hoàn toàn thấy tạo thành thêm 6 gam kết tủa. Hỏi % khối lượng của MgCO3 nằm trong khoảng nào?
Đáp án : A Lời giải chi tiết :
\(\begin{array}{l}\overline M C{O_3} \to MO + C{O_2}\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,(1)\\C{O_2} + Ca{(OH)_2} \to CaC{O_3} \downarrow + {H_2}O\,\,\,(2)\\0,15\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\, \leftarrow 0,15\\2CO2 + Ca{(OH)_2} \to Ca{(HC{O_3})_2} + {H_2}O\,(3)\end{array}\) Ca(HCO3)2 \(\xrightarrow{{{t^0}}}\) CaCO3↓ + CO2↑ + H2O (4) 0,06 ← 0,06 \({n_{CaC{O_3}(2)}} = \frac{{15}}{{100}} = 0,15\,(mol);\,{n_{CaC{O_3}\,(4)}} = \frac{6}{{100}} = 0,06\,(mol)\) Ta có: \(\sum {{n_{C{O_2}(1)}} = {n_{C{O_2}(2)}} + {n_{C{O_2}(3)}} = {n_{C{O_2}(2)}} + 2{n_{CaC{O_3}(4)}} = 0,15 + 2.0,06 = 0,27\,(mol)} \) \( \Rightarrow {n_{MC{O_3}}} = {n_{C{O_2}(1)}} = 0,27\,(mol)\) Gọi x, y, z lần lượt là số mol của MgCO3; CaCO3; BaCO3 trong 100 g hỗn hợp \( \Rightarrow x + y + z = \frac{{100.0,27}}{{25}} = 1,08 \Rightarrow y + z = 108 - x\,\,(*)\) Có: 84x + 100x + 197z = 100 → 100y + 197z = 100 – 84x (**) \({M_{CaC{O_3}}} < {\overline M _{CaC{O_3},BaC{O_3}}} < {M_{BaC{O_3}}}\) \( \Rightarrow 100 < \frac{{100y + 197z}}{{y + z}} < 197\) Thế (*) và (**) vào ta có: \( \Rightarrow 100 < \frac{{100 - 84x}}{{1,08 - x}} < 197\) \( \Rightarrow \left\{ \begin{array}{l}100.(1,08 - x) < 100 - 84x\\100 - 84x < 197.(1,08 - x)\end{array} \right. \Rightarrow \left\{ \begin{array}{l}108 - 100x < 100 - 84x\\100 - 84x < 212,76 - 197x\end{array} \right. \Rightarrow \left\{ \begin{array}{l}8 < 16x\\113x < 112,76\end{array} \right. \Rightarrow \left\{ \begin{array}{l}0,5 < x\\x < 0,9979\end{array} \right.\) → 0,5 < x < 0,9979 Nhân cả các vế với 84 → 42 < 84x < 83,82 Phần trăm khối lượng của MgCO3 trong hh là: \(\% {m_{MgC{O_3}}} = \frac{{{m_{MgC{O_3}}}}}{{{m_{hh}}}}.100\% \Rightarrow \frac{{42}}{{100}}.100\% < \frac{{84x}}{{100}}.100\% < \frac{{83,82}}{{100}}.100\% \) \( \Rightarrow 42\% < \% {m_{MgC{O_3}}} < 82,83\% \)
Câu 41 :
Hoà tan hoàn toàn 25,2 g một muối cacbonat của kim loại hóa trị II bằng dung dịch HCl 7,3% (D = 1,038 g/ml). Cho toàn bộ khí CO2 thu được vào 500 ml dung dịch NaOH 2M, sau phản ứng đem cô cạn thì thu được 47,8 gam chất rắn. Biết các phản ứng xảy ra hoàn toàn. a/ Xác định CTHH của muối cacbonat
Đáp án : A Lời giải chi tiết :
Đặt công thức của muối cacbonat là MCO3. Các PTHH: MCO3 + 2 HCl →MCl2 + CO2↑ + H2O (1) NaOH + CO2 → NaHCO3. (2) a a a 2NaOH + CO2 → Na2CO3 + H2O. (3) 2b b b Số mol NaOH: nNaOH = 0,5. 2 = 1 mol Cho CO2 vào dung dịch NaOH có thể xảy ra các trường hợp sau: TH1: chỉ xảy ra pư (2). NaOHPƯ hết, CO2 có thể hết hoặc dư. Mọi tính toán theo NaOH Theo(3): nNaHCO3 = nNaOH = 1(mol) => mNaHCO3 = 1 . 84 = 84(g) ≠ 47,8(g)=> loại TH2: xảy ra cả (2) và (3). CO2 và NaOH đều hết. rắn thu được là 2 muối Gọi a, b lần lượt là số mol CO2 tham gia ở phản ứng (2) và (3). Theo phương trình và bài ta có: \(\left\{ \begin{array}{l}{n_{NaOH}} = a + 2b = 1\\{m_{muoi}} = 84a + 106b = 47,8\end{array} \right.\) => vô nghiệm => loại TH3: xảy ra (3). CO2 hết, rắn sau pư là NaOHdư và Na2CO3 Gọi nCO2(3)= x(mol); nNaOHdư = y(mol) Theo (3) nNaOHpư = 2nCO2(4)=2x(mol) ; nNa2CO3 = nCO2(4) = x(mol) \(\left\{ \begin{array}{l}{n_{NaOH}} = 2x + y = 1\\\sum {m{\,_{ran}}\, = m{\,_{N{a_2}C{O_3}}} + {m_{NaO{H_{\,du}}}} = 106x + 40y = 47,8} \end{array} \right. \Rightarrow \left\{ \begin{array}{l}x = 0,3\\y = 0,4\end{array} \right.\) → nMCO3 = nCO2(3) = 0,3 (mol) \({M_{MC{O_3}}} = \frac{{{m_{MC{O_3}}}}}{{{n_{MC{O_3}}}}} = \frac{{25,2}}{{0,3}} = 84 \Rightarrow {m_M} = 84 - 60 = 24\,(Mg)\) → Công thức muối: MgCO3
Câu 42 :
Trộn 30ml dd có chứa 1,04 g BaCl2 với 170ml dd có chứa 3,4g AgNO3. Tính CM của chất còn lại trong dd sau phản ứng. Biết thể tích dd thay đổi không đáng kể.
Đáp án : A Lời giải chi tiết :
n BaCl2 = mBaCl2 : MBaCl2 = 1,04 : (137 + 35,5 . 2) = 0,005 mol nAgNO3 = mAgNO3 : MAgNO3 = 3,4 : (108 + 14 + 3 . 16) = 0,02 mol PTHH: BaCl2 + 2AgNO3 → 2AgCl↓ + Ba(NO3)2 Tỉ lệ: 1 2 2 1 Pứ: 0,005 0,02 ?mol ?mol Ta có => BaCl2 phản ứng hết, AgNO3 dư nAgNO3phản ứng = 2nBaCl2 = 0,01 mol => nAgNO3 dư = nAgNO3 – nAgNO3 phản ứng = 0,02 – 0,01 = 0,01 mol nBa(NO3)2 = nBaCl2 = 0,005 mol Vdd sau phản ứng = VBaCl2 + VAgNO3 = 30 + 170 = 200ml = 0,2 lít => CM AgNO3 = nAgNO3 : Vdd = 0,01 : 0,2 = 0,05M CM Ba(NO3)2 = n Ba(NO3)2 : Vdd = 0,005 : 0,2 = 0,025M
Câu 43 :
Hòa tan 10 gam hỗn hợp muối XCO3 và Y2(CO3)3 bằng dd HCl dư thư được dd A và 0,672 lít khí ở đktc.Khối lượng muối khan thu được sau phản ứng là
Đáp án : B Lời giải chi tiết :
=> m Muối = 10,33 gam
Câu 44 :
Cho dung dịch AgNO3 dư tác dụng với hỗn hợp có hòa tan 12,5 gam hai muối KCl và KBr thu được 20,78 gam hỗn hợp AgCl và AgBr. Thành phần % của muối AgCl trong hỗn hợp thu được sau phản ứng là.
Đáp án : D Lời giải chi tiết :
Câu 45 :
Cho 8,4 gam Fe vào dung dịch chứa 0,4 mol AgNO3. Kết thúc phản ứng khối lượng muối thu được là.
Đáp án : B Lời giải chi tiết :
Câu 46 :
Cho 0,1 mol Ba(OH)2 vào dung dịch NH4NO3 dư thì thể tích thoát ra ở đktc là :
Đáp án : B Lời giải chi tiết :
PTHH: Ba(OH)2 + 2NH4NO3 → Ba(NO3)2 + 2NH3 + 2H2O Tỉ lê: 1 2 Pứ: 0,1 ? mol Từ PTHH ta có n NH3 = 2 n Ba(OH)2 = 0,2 mol => V NH3 = n NH3 . 22,4 = 0,2 . 22,4 = 44,8 lít
|














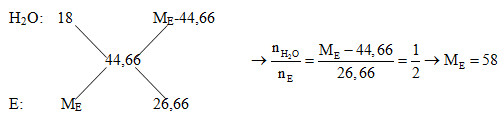











Danh sách bình luận