Trắc nghiệm Bài 20. Tỉ khối của chất khí - Hóa học 8Đề bài
Câu 1 :
Khí N2 nhẹ hơn khí nào sau đây?
Câu 2 :
Chất nào sau đây nặng hơn không khí?
Câu 3 :
Tỉ khối của A đối với H2 là 22. A là khí nào sau đây?
Câu 4 :
Tỉ khối của khí B đối với oxi là 0,5 và tỉ khối của khí A đối với khí B là 2,125. Khối lượng mol của khí A là
Câu 5 :
Một khí X2 có tỉ khối hơi đối với khí axetilen (C2H2) bằng 2,731. Khí X2 là
Câu 6 :
Khí A có công thức dạng RO2. Biết dA/KK = 1,5862. Hãy xác định công thức của khí A.
Câu 7 :
Tỉ khối của hỗn hợp X chứa 3,36 lít khí H2 và 6,72 lít khí N2 (đều đo ở đktc) so với khí heli là:
Câu 8 :
Tỉ khối của hỗn hợp chứa 4 gam metan (CH4) và 7 gam khí etilen (C2H4) so với không khí là:
Câu 9 :
Tỉ khối của hỗn hợp chứa N2 và O2 theo tỉ lệ về thể tích là 1 : 2 so với không khí là:
Câu 10 :
Tỉ khối của hỗn hợp chứa N2 và O3 theo tỉ lệ 1 : 2 so với không khí là:
Ở đktc 0,5 lít khí X có khối lượng là 1,25 gam Câu 11
Khối lượng mol phân tử của khí X là:
Câu 12
Tỉ khối hơi của X đối với không khí, với CO2 và với CH4 lần lượt là:
Câu 13 :
Một hỗn hợp X gồm H2 và O2 (không có phản ứng xảy ra) có tỉ khối so với không khí là 0,3276. Phần trăm theo số mol của khí H2 trong hỗn hợp là
Câu 14 :
Khí N2 nặng hơn khí H2 bằng bao nhiêu lần? (N = 14, H = 1)
Câu 15 :
Khí nào có thể thu được bằng cách đặt ngược bình (hình vẽ):
Câu 16 :
A là oxit của lưu huỳnh có tỉ khối hơi so với Ne là 3,2. Vậy A có công thức phân tử là:
Câu 17 :
Hỗn hợp khí CO và CO2 có tỉ khối so với O2 là 1. Thể tích khí CO2 cần thêm vào 8,96 lít hỗn hợp trên (đktc) để có tỉ khối so với O2 tăng lên bằng 1,075 là:
Câu 18 :
Cho các khí sau: Cl2; H2; O2; SO3; CH4; CO2. Số lượng khí có thể thu được bằng cách đẩy nước trong phòng thí nghiệm là:
Lời giải và đáp án
Câu 1 :
Khí N2 nhẹ hơn khí nào sau đây?
Đáp án : D Phương pháp giải :
Xem lại công thức tính tỉ khối Lời giải chi tiết :
Ta có: ${d_{{N_2}/{H_2}}} = \frac{{{M_{{N_2}}}}}{{{M_{{H_2}}}}} = \frac{{28}}{2} = 14 > 1$ => khí N2 nặng hơn khí H2 ${d_{{N_2}/N{H_3}}} = \frac{{{M_{{N_2}}}}}{{{M_{N{H_3}}}}} = \frac{{28}}{{17}} = 1,647 > 1$ => khí N2 nặng hơn NH3 ${d_{{N_2}/{C_2}{H_2}}} = \frac{{{M_{{N_2}}}}}{{{M_{{C_2}{H_2}}}}} = \frac{{28}}{{26}} = 1,07 > 1$ => khí N2 nặng hơn khí C2H2 ${d_{{N_2}/{O_2}}} = \frac{{{M_{{N_2}}}}}{{{M_{{O_2}}}}} = \frac{{28}}{{32}} = 0,875 < 1$ => khí N2 nhẹ hơn khí O2
Câu 2 :
Chất nào sau đây nặng hơn không khí?
Đáp án : A Phương pháp giải :
Xem lại công thức tính tỉ khối của khí A so với không khí Lời giải chi tiết :
Không khí có M = 29 g/mol => chất nặng hơn không khí là chất có M > 29 g/mol +) ${M_{S{O_2}}} = 32 + 16.2 = 64$ > 29 => khí SO2 nặng hơn không khí +) ${M_{{H_2}}} = 2.1 = 2$ < 29 => khí H2 nhẹ hơn không khí +) ${M_{C{H_4}}} = 12 + 1.4 = 16$ < 29 => khí CH4 nhẹ hơn không khí +) ${M_{{N_2}}} = 2.14 = 28$ < 29 => khí N2 nhẹ hơn không khí
Câu 3 :
Tỉ khối của A đối với H2 là 22. A là khí nào sau đây?
Đáp án : C Phương pháp giải :
Tỉ khối của A đối với H2 : ${d_{A/{H_2}}} = \dfrac{{{M_A}}}{{{M_{{H_2}}}}} = 22 = > {M_A} = 22.{M_{{H_2}}}$ Lời giải chi tiết :
Tỉ khối của A đối với H2 : ${d_{A/{H_2}}} = \dfrac{{{M_A}}}{{{M_{{H_2}}}}} = 22 = > {M_A} = 22.{M_{{H_2}}} = 22.2 = 44$ g/mol Loại A vì NO2 có M = 14 + 16.2 = 46 Loại B vì N2 có M = 2.14 = 28 Chọn C vì CO2 có M = 12 + 16.2 = 44 Loại D vì Cl2 có M = 2.35,5 = 71
Câu 4 :
Tỉ khối của khí B đối với oxi là 0,5 và tỉ khối của khí A đối với khí B là 2,125. Khối lượng mol của khí A là
Đáp án : B Phương pháp giải :
+) ${d_{B/{O_2}}} = \frac{{{M_B}}}{{{M_{{O_2}}}}} = 0,5 = > {M_B}$ +) ${d_{A/B}} = \frac{{{M_A}}}{{{M_B}}} = 2,125 = > {M_A}$ Lời giải chi tiết :
Ta có: ${d_{B/{O_2}}} = \frac{{{M_B}}}{{{M_{{O_2}}}}} = 0,5 = > {M_B} = 32.0,5 = 16$ Mặt khác: ${d_{A/B}} = \frac{{{M_A}}}{{{M_B}}} = 2,125 = > {M_A} = 2,125.16 = 34$ Vậy khối lượng mol của A là 34 g/mol
Câu 5 :
Một khí X2 có tỉ khối hơi đối với khí axetilen (C2H2) bằng 2,731. Khí X2 là
Đáp án : C Phương pháp giải :
Áp dụng công thức tính tỉ khối: ${d_{{X_2}/{C_2}{H_2}}} = \frac{{{M_{{X_2}}}}}{{{M_{{C_2}{H_2}}}}} = 2,731 = > {M_{{X_2}}}$ Lời giải chi tiết :
Áp dụng công thức tính tỉ khối: ${d_{{X_2}/{C_2}{H_2}}} = \frac{{{M_{{X_2}}}}}{{{M_{{C_2}{H_2}}}}} = 2,731 = > {M_{{X_2}}} = (12.2 + 2).2,731 \approx 71$ Mà = 2.MX = 71 => MX = 35,5 Vậy khí cần tìm là Cl2
Câu 6 :
Khí A có công thức dạng RO2. Biết dA/KK = 1,5862. Hãy xác định công thức của khí A.
Đáp án : B Phương pháp giải :
+) Tỉ khối của A so với không khí là 1,5862 => MA = 29 . dA/KK +) Khối lượng mol của khí A là: ${M_{R{O_2}}} = {M_R} + 2.{M_O}$ => MR Lời giải chi tiết :
Tỉ khối của A so với không khí là 1,5862 => MA = 29 . dA/KK = 29.1,5862 = 46 g/mol Khối lượng mol của khí A là: ${M_{R{O_2}}} = {M_R} + 2.{M_O}$ => MR = 46 – 2.16 = 14 gam => R là N => Công thức của A là NO2
Câu 7 :
Tỉ khối của hỗn hợp X chứa 3,36 lít khí H2 và 6,72 lít khí N2 (đều đo ở đktc) so với khí heli là:
Đáp án : A Phương pháp giải :
+) Tính số mol khí H2 và N2 theo công thức: $n = \dfrac{V}{{22,4}}$ +) ${\bar M_X} = \dfrac{{{a_{{H_2}}}.{M_{{H_2}}} + {a_{{N_2}}}.{M_{{N_2}}}}}{{{a_{{H_2}}} + {a_{{N_2}}}}}$ +) tỉ khối của X so với He: ${d_{X/He}} = \dfrac{{{M_X}}}{{{M_{He}}}}$ Lời giải chi tiết :
Số mol khí H2 là: ${n_{{H_2}}} = \frac{V}{{22,4}} = \frac{{3,36}}{{22,4}} = 0,15\,mol$ Số mol khí N2 là: ${n_{{N_2}}} = \frac{V}{{22,4}} = \frac{{6,72}}{{22,4}} = 0,3\,mol$ => khối lượng trung bình của hỗn hợp X là: ${\bar M_X} = \frac{{2.0,15 + 28.0,3}}{{0,15 + 0,3}} = 19,33$ Khí He có M = 4 => tỉ khối của X so với He là: ${d_{X/He}} = \frac{{{M_X}}}{{{M_{He}}}} = \frac{{19,33}}{4} = 4,83$
Câu 8 :
Tỉ khối của hỗn hợp chứa 4 gam metan (CH4) và 7 gam khí etilen (C2H4) so với không khí là:
Đáp án : B Phương pháp giải :
+) Tính số mol của CH4 và C2H4 theo CT: $n = \frac{m}{M}$ +) Tính khối lượng trung bình của hỗn hợp khí: $\bar M = \frac{{{n_{C{H_4}}}.{M_{C{H_4}}} + {n_{{C_2}{H_4}}}.{M_{{C_2}{H_4}}}}}{{{n_{C{H_4}}} + {n_{{C_2}{H_4}}}}}$ +) tỉ khối của hỗn hợp so với không khí là: ${d_{X/kk}} = \frac{{\bar M}}{{{M_{kk}}}}$ Lời giải chi tiết :
Số mol của CH4 là: ${n_{C{H_4}}} = \frac{4}{{16}} = 0,25\,mol$ Số mol của C2H4 là: ${n_{{C_2}{H_4}}} = \frac{7}{{28}} = 0,25\,mol$ => khối lượng trung bình của hỗn hợp khí là: $\bar M = \frac{{{n_{C{H_4}}}.{M_{C{H_4}}} + {n_{{C_2}{H_4}}}.{M_{{C_2}{H_4}}}}}{{{n_{C{H_4}}} + {n_{{C_2}{H_4}}}}} = \frac{{{m_{C{H_4}}} + {m_{{C_2}{H_4}}}}}{{{n_{C{H_4}}} + {n_{{C_2}{H_4}}}}} = \frac{{4 + 7}}{{0,25 + 0,25}} = 22$ => tỉ khối của hỗn hợp so với không khí là: ${d_{hh/kk}} = \frac{{\bar M}}{{{M_{kk}}}} = \frac{{22}}{{29}}$
Câu 9 :
Tỉ khối của hỗn hợp chứa N2 và O2 theo tỉ lệ về thể tích là 1 : 2 so với không khí là:
Đáp án : A Phương pháp giải :
+) Gọi số mol của N2 là a mol thì số mol của O2 là 2a mol +) $\bar M = \frac{{{n_{{N_2}}}.{M_{{N_2}}} + {n_{{O_2}}}.{M_{{O_2}}}}}{{{n_{{N_2}}} + {n_{{O_2}}}}}$ +) tỉ khối của hỗn hợp so với không khí: ${d_{hh/kk}} = \frac{{\bar M}}{{{M_{kk}}}}$ Lời giải chi tiết :
Hỗn hợp chứa N2 và O2 theo tỉ lệ vê thể tích là 1 : 2 => Gọi số mol của N2 là a mol thì số mol của O2 là 2a mol Khối lượng trung bình của hỗn hợp khí là: $\bar M = \frac{{{n_{{N_2}}}.{M_{{N_2}}} + {n_{{O_2}}}.{M_{{O_2}}}}}{{{n_{{N_2}}} + {n_{{O_2}}}}} = \frac{{a.28 + 2{\text{a}}.32}}{{a + 2{\text{a}}}} = \frac{{92}}{3}$ => tỉ khối của hỗn hợp so với không khí là: ${d_{hh/kk}} = \frac{{\bar M}}{{{M_{kk}}}} = \frac{{92}}{{3.29}} = \frac{{92}}{{87}}$
Câu 10 :
Tỉ khối của hỗn hợp chứa N2 và O3 theo tỉ lệ 1 : 2 so với không khí là:
Đáp án : C Phương pháp giải :
Khối lượng trung bình của hỗn hợp khí là: $\bar M = \frac{{{n_{{N_2}}}.{M_{{N_2}}} + {n_{{O_3}}}.{M_{{O_3}}}}}{{{n_{{N_2}}} + {n_{{O_3}}}}} $ => tỉ khối của hỗn hợp so với không khí là: ${d_{hh/kk}} = \frac{{\bar M}}{{{M_{kk}}}}$ Lời giải chi tiết :
Gọi số mol của N2 là a mol => số mol của O3 là 2a mol Khối lượng trung bình của hỗn hợp khí là: $\bar M = \frac{{{n_{{N_2}}}.{M_{{N_2}}} + {n_{{O_3}}}.{M_{{O_3}}}}}{{{n_{{N_2}}} + {n_{{O_3}}}}} = \frac{{a.28 + 2{\text{a}}.48}}{{a + 2{\text{a}}}} = \frac{{124}}{3}$ => tỉ khối của hỗn hợp so với không khí là: ${d_{hh/kk}} = \frac{{\bar M}}{{{M_{kk}}}} = \frac{{124}}{{3.29}} = \frac{{124}}{{87}}$ Ở đktc 0,5 lít khí X có khối lượng là 1,25 gam Câu 11
Khối lượng mol phân tử của khí X là:
Đáp án : C Phương pháp giải :
Tính số mol khí X theo CT: ${n_X} = \dfrac{V}{{22,4}}$ +) ${M_X} = \dfrac{m}{n}$ Lời giải chi tiết :
Số mol khí X là: ${n_X} = \dfrac{V}{{22,4}} = \dfrac{{0,5}}{{22,4}}$ mol => khối lượng mol phân tử của khí X là: ${M_X} = \dfrac{m}{n} = \dfrac{{1,25}}{{\dfrac{{0,5}}{{22,4}}}} = 56$ Câu 12
Tỉ khối hơi của X đối với không khí, với CO2 và với CH4 lần lượt là:
Đáp án : D Phương pháp giải :
Tỉ khối của X so với không khí là: ${d_{X/kk}} = \dfrac{{{M_X}}}{{{M_{kk}}}}$ Tỉ khối của X so với CO2 là: ${d_{X/C{O_2}}} = \dfrac{{{M_X}}}{{{M_{C{O_2}}}}}$ Tỉ khối của X so với CH4 là: ${d_{X/C{O_2}}} = \dfrac{{{M_X}}}{{{M_{C{H_4}}}}}$ Lời giải chi tiết :
Tỉ khối của X so với không khí là: ${d_{X/kk}} = \dfrac{{{M_X}}}{{{M_{kk}}}} = \dfrac{{56}}{{29}} = 1,93$ Tỉ khối của X so với CO2 là: ${d_{X/C{O_2}}} = \dfrac{{{M_X}}}{{{M_{C{O_2}}}}} = \dfrac{{56}}{{44}} = 1,27$ Tỉ khối của X so với CH4 là: ${d_{X/C{O_2}}} = \dfrac{{{M_X}}}{{{M_{C{H_4}}}}} = \dfrac{{56}}{{16}} = 3,5$
Câu 13 :
Một hỗn hợp X gồm H2 và O2 (không có phản ứng xảy ra) có tỉ khối so với không khí là 0,3276. Phần trăm theo số mol của khí H2 trong hỗn hợp là
Đáp án : B Phương pháp giải :
+) Tỉ khối của X so với không khí : ${d_{X/kk}} = \dfrac{{{{\bar M}_X}}}{{29}} = > {\bar M_X}$ Công thức tính khối lượng trung bình của hỗn hợp X là ${M_X} = \dfrac{{{n_{{H_2}}}.{M_{{H_2}}} + {n_{{O_2}}}.{M_{{O_2}}}}}{{{n_{{H_2}}} + {n_{{O_2}}}}}$ +) phần trăm số mol khí H2 là: $\% {n_{{H_2}}} = \dfrac{{{n_{{H_2}}}}}{{{n_{{H_2}}} + {n_{{O_2}}}}}.100\% $ Lời giải chi tiết :
Gọi số mol của H2 và O2 trong hỗn hợp lần lượt là x và y mol Tỉ khối của X so với không khí : ${d_{X/kk}} = \dfrac{{{{\bar M}_X}}}{{29}} = > {\bar M_X} = 29.0,3276 = 9,5$ Công thức tính khối lượng trung bình của hỗn hợp X là ${M_X} = \dfrac{{{n_{{H_2}}}.{M_{{H_2}}} + {n_{{O_2}}}.{M_{{O_2}}}}}{{{n_{{H_2}}} + {n_{{O_2}}}}} = \dfrac{{2{\text{x}} + 32y}}{{x + y}} = 9,5$ => 2x + 32y = 9,5x + 9,5y => 7,5x = 22,5 => x = 3y => phần trăm số mol khí H2 là: $\% {n_{{H_2}}} = \dfrac{{{n_{{H_2}}}}}{{{n_{{H_2}}} + {n_{{O_2}}}}}.100\% = \dfrac{{3y}}{{3y + y}}.100\% = 75\% $
Câu 14 :
Khí N2 nặng hơn khí H2 bằng bao nhiêu lần? (N = 14, H = 1)
Đáp án : D Phương pháp giải :
Lấy phân tử khối của N2 chia cho phân tử khối của H2 Lời giải chi tiết :
Phân tử khối của N2 = 14×2 = 28 (gam/mol) Phân tử khối của H2 = 2×1 = 2 (gam/mol) Suy ra \({d_{{N_2}/{H_2}}} =\dfrac{{28}}{2}= 14\) Vậy N2 nặng hơn H2 14 lần
Câu 15 :
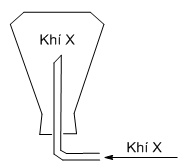
Khí nào có thể thu được bằng cách đặt ngược bình (hình vẽ):
Đáp án : D Phương pháp giải :
Khí thu được bằng cách đặt úp bình \( \to\) khí này có phân tử khối nhẹ hơn không khí (Mkk≈ 29 g/mol) Lời giải chi tiết :
Khí thu được bằng cách đặt úp bình \( \to\) khí này có phân tử khối nhẹ hơn không khí \( \to\) khí X là khí H2 (\({M_{{H_2}}} = 2\,\,g/mol\))
Câu 16 :
A là oxit của lưu huỳnh có tỉ khối hơi so với Ne là 3,2. Vậy A có công thức phân tử là:
Đáp án : A Lời giải chi tiết :
Câu 17 :
Hỗn hợp khí CO và CO2 có tỉ khối so với O2 là 1. Thể tích khí CO2 cần thêm vào 8,96 lít hỗn hợp trên (đktc) để có tỉ khối so với O2 tăng lên bằng 1,075 là:
Đáp án : A Lời giải chi tiết :
Gọi số mol của CO và CO2 lần lượt là a, b (mol) Áp dụng công thức tính tỉ khối ta có: \(\dfrac{{28a + 44b}}{{\left( {a + b} \right)}} = {\text{ }}1\,.\,32 < = > {\text{ }}a{\text{ }} = {\text{ }}3b{\text{ }}\left( 1 \right)\) Mặt khác có: a + b = (8,96 : 22,4) = 0,4 (2) Lấy (1) thay vào (2) ta được b = 0,1 mol và a=0,3 mol Gọi số mol CO2 cần thêm vào là x mol Ta có:\(\dfrac{{28.0,3 + 44\left( {0,1 + x} \right)}}{{\left( {0,4 + x} \right)}} = {\text{ }}1,075.32{\text{ }} < = > {\text{ }}x{\text{ }} = {\text{ }}0,1{\text{ }}mol\) => V = 0,1. 22,4 = 2,24 lít.
Câu 18 :
Cho các khí sau: Cl2; H2; O2; SO3; CH4; CO2. Số lượng khí có thể thu được bằng cách đẩy nước trong phòng thí nghiệm là:
Đáp án : A Lời giải chi tiết :
Khí thu bằng phương pháp đẩy nước phải chọn những khí ít hoặc không tan trong nước Khí có thể thu được bằng cách đẩy nước trong phòng thí nghiệm là: H2; O2; CH4; CO2.
|














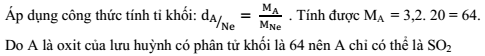





Danh sách bình luận