Trắc nghiệm Bài 22. Tính theo phương trình hóa học - Hóa học 8Đề bài
Câu 1 :
Để đốt cháy hoàn toàn a gam Al cần dùng hết 19,2 gam oxi. Phản ứng kết thúc thu được sản phẩm là Al2O3. Giá trị của a là
Câu 2 :
Lưu huỳnh S cháy trong không khí sinh ra chất khí mùi hắc, gây ho, đó là khí lưu huỳnh đioxit có công thức hóa học là SO2. Biết khối lượng lưu huỳnh tham gia phản ứng là 1,6 gam. Tính khối lượng khí lưu huỳnh đioxit sinh ra.
Câu 3 :
Tính thể tích của oxygen (đkc) cần dùng để đốt cháy hết 3,1 gam P, biết phản ứng sinh ra chất rắn P2O5.
Câu 4 :
Đốt cháy hoàn toàn 1,12 lít khí CH4 (đktc) cần dùng V lít khí O2 (đktc), sau phản ứng thu được sản phẩm là khí cacbonic (CO2) và nước (H2O). Giá trị của V là
Câu 5 :
Đốt cháy hoàn toàn 13 gam Zn trong oxi thu được ZnO. Thể tích khí oxi đã dùng (đktc) là
Câu 6 :
Hãy tìm thể tích khí oxi đủ để đốt cháy hết 11,2 lít khí A. Biết rằng: – Khí A có tỉ lệ khối đối với không khí là 0,552 – Thành phần theo khối lượng của khí A là: 75% C và 25% H Các thể tích khí đo ở đktc
Biết rằng 2,3 gam một kim loại R (có hoá trị I) tác dụng vừa đủ với 1,12 lít khí clo (ở đktc) theo sơ đồ phản ứng: R + Cl2 $\xrightarrow{{{t^o}}}$ RCl Câu 7
Kim loại R là
Câu 8
Khối lượng sản phẩm tạo thành là
Trong phòng thí nghiệm người ta có thể điều chế oxi bằng cách nhiệt phân kali clorat theo sơ đồ phản ứng: KClO3 $\xrightarrow{{{t^o}}}$ KCl + O2 Câu 9
Khối lượng KClO3 cần thiết để điều chế được 9,6 gam oxi là
Câu 10
Khối lượng KCl tạo thành là
Cho phương trình hóa học sau: CaCO3 $\xrightarrow{{{t^o}}}$ CaO + CO2 Câu 11
Cần dùng bao nhiêu mol CaCO3 để điều chế được 11,2 gam CaO ?
Câu 12
Muốn điều chế được 7 gam CaO cần dùng bao nhiêu gam CaCO3?
Câu 13
Nếu có 3,5 mol CaCO3 tham gia phản ứng sẽ sinh ra bao nhiêu lít CO2 (đktc) ?
Câu 14
Nếu thu được 13,44 lít khí CO2 ở đktc thì có bao nhiêu gam chất rắn tham gia và tạo thành sau phản ứng ?
Câu 15 :
Khử 48 gam đồng (II) oxit bằng hiđro được 36,48 gam đồng sau phản ứng. Hiệu suất của phản ứng trên là:
Câu 16 :
Cho dung dịch chứa 0,2 mol NaOH phản ứng với dung dịch chứa 0,3 mol HCl thu được dung dịch A. Tính tổng khối lượng chất tan trong dung dịch A. Biết PTHH: NaOH + HCl → NaCl + H2O.
Câu 17 :
Hòa tan 23,2 gam hỗn hợp Zn và Al2O3 trong V lít dung dịch HCl 2M thu được dung dịch muối và 4,48 lít khí H2 (đktc). Giá trị V là
Câu 18 :
): Hòa tan 28,8 gam hỗn hợp Mg và CuO trong m gam dung dịch H2SO4 20% thu được dung dịch muối và 4,48 lít khí H2 (đktc). Giá trị m là
Câu 19 :
Hòa tan 31,2 gam hỗn hợp Ca(NO3)2 và Mg(NO3)2 trong dung dịch Na2CO3 thu được 18,4 gam kết tủa và dung dịch muối. Phần trăm khối muối Mg(NO3)2 là
Câu 20 :
Hòa tan 44,8 gam hỗn hợp NH4NO3, (NH4)2CO3 trong dung dịch Ba(OH)2 thu được 59,1 gam kết tủa và V lít khí NH3 (đktc). Giá trị V là:
Câu 21 :
Dẫn 6,72 lít (đktc) hỗn hợp khí CO, CO2 qua dung dịch Ca(OH)2 dư. Sau khi phản ứng hoàn toàn thấy xuất hiện 20 gam kết tủa. Phần trăm thể tích khí CO là
Câu 22 :
Dẫn V lít khí CO2 (đktc) qua bình đựng dung dịch nước vôi trong dư. Sau khi phản ứng kết thúc thấy khối lượng dung dịch Ca(OH)2 giảm 14 gam. Giá trị V là
Câu 23 :
Nhúng thanh Fe trong 150 ml dung dịch AgNO3 xM sau khi phản ứng kết thúc thấy khối lượng thanh kim loại tăng 24 gam. Biết phản ứng xảy ra hoàn toàn. Giá trị của x là
Câu 24 :
Hòa tan m gam Mg trong bình đựng dung dịch H2SO4, sau khi phản ứng hết thấy khối lượng bình tăng 4,4 gam. Giá trị m là
Câu 25 :
Đốt cháy hết 5,6 lít hỗn hợp CH4 và C2H4 (đktc) cần dùng 13,44 lít khí O2 (đktc) thu được hỗn hợp khí và hơi. Phần trăm thể tích CH4 là
Câu 26 :
Hòa tan hết 21,6 gam hỗn hợp Mg và Fe trong dung dịch HCl thu được dung dịch muối và 11,2 lít khí H2 (đktc). Phần trăm khối lượng Mg là
Câu 27 :
Hòa tan hết 17,05 gam hỗn hợp Al và Zn cần vừa đủ 124,1 gam dung dịch HCl 25% thu được dung dịch muối và khí không màu. Phần trăm khối lượng Zn trong hỗn hợp đầu là
Câu 28 :
Hòa tan 18,4 gam Fe, Cu trong dung dịch HCl dư thu được 2,24 lít khí (đktc) thu được dung dịch muối và 1 chất rắn không tan. Phần trăm khối lượng Cu trong hỗn hợp đầu là
Câu 29 :
Cho 100 ml dung dịch chứa NaCl 2M, NaBr 1M vào V lít dung dịch AgNO3 2M thu được kết tủa bạc clorua và dung dịch muối natri nitrat. Giá trị V là
Câu 30 :
Để trung hòa hết hỗn hợp gồm 8 gam NaOH và 25,65 gam Ba(OH)2 cần dùng V lít dung dịch HCl 2M thu được dung dịch muối. Giá trị V là
Câu 31 :
Hòa tan hết hỗn hợp gồm 15,9 gam Na2CO3 và 34,5 gam K2CO3 cần dùng V dung dịch HCl 2M thu được dung dịch muối và khí cacbonic. Giá trị V là
Câu 32 :
Đốt cháy hỗn hợp chứa 4,48 lít CH4 và 2,24 lít C2H4 thì cần V lít O2 (đktc) thu được sản phẩm CO2 và nước. Giá trị của V là
Câu 33 :
Cần dùng V lít H2 (đktc) để khử hoàn toàn hỗn hợp gồm 10,8 gam FeO và 24 gam Fe2O3 thu được kim loại và H2O. Giá trị V là
Câu 34 :
Hòa tan hoàn toàn 11,2 gam sắt (Fe) trong axit clohiđric (HCl) thu được muối sắt clorua (FeCl2) và khí hiđro (H2). a. Viết phương trình hóa học xảy ra. b. Tính thể tích khí hiđro (H2) thu được ở điều kiện tiêu chuẩn. c. Tính khối lượng axit clohiđric (HCl) đã tham gia phản ứng.
Câu 35 :
Magie tác dụng với axit clohiđric: Mg + 2HCl → MgCl2 + H2↑ Nếu có 12g Mg tham gia phản ứng, em hãy tìm: a) Thể tích khí hiđro thu được ở đktc. b) Khối lượng axit clohiđric cần dùng.
Câu 36 :
Đốt cháy hoàn toàn 27 gam Al trong oxi thu được Al2O3. Tính khối lượng Al2O3 thu được và thể tích oxygen (đkc) đã dùng.
Lời giải và đáp án
Câu 1 :
Để đốt cháy hoàn toàn a gam Al cần dùng hết 19,2 gam oxi. Phản ứng kết thúc thu được sản phẩm là Al2O3. Giá trị của a là
Đáp án : A Phương pháp giải :
+) tính số mol O2 PTHH: 4Al + 3O2 $\xrightarrow{{{t^o}}}$ 2Al2O3 Tỉ lệ theo PT: 4mol 3mol ?mol 0,6mol => số mol Al phản ứng là: ${n_{Al}} = \dfrac{{0,6.4}}{3}$ => khối lượng Al Lời giải chi tiết :
${n_{{O_2}}} = \dfrac{{19,2}}{{32}} = 0,6\,mol$ PTHH: 4Al + 3O2 $\xrightarrow{{{t^o}}}$ 2Al2O3 Tỉ lệ theo PT: 4mol 3mol ?mol 0,6mol => số mol Al phản ứng là: ${n_{Al}} = \dfrac{{0,6.4}}{3}$ $ = 0,8\,mol$ => khối lượng Al phản ứng là: mAl = 0,8.27 = 21,6 gam
Câu 2 :
Lưu huỳnh S cháy trong không khí sinh ra chất khí mùi hắc, gây ho, đó là khí lưu huỳnh đioxit có công thức hóa học là SO2. Biết khối lượng lưu huỳnh tham gia phản ứng là 1,6 gam. Tính khối lượng khí lưu huỳnh đioxit sinh ra.
Đáp án : B Phương pháp giải :
+) Tính số mol của S tham gia phản ứng +) Viết PTHH và tính theo tỉ lệ mol S + O2 $\xrightarrow{{{t^o}}}$ SO2 Tỉ lệ theo PT: 1mol 1mol 0,05mol ?mol Theo phương trình hóa học, ta có: ${n_{S{O_2}}} = {n_S}$ => khối lượng Lời giải chi tiết :
Số mol của S tham gia phản ứng: ${n_S} = \frac{{16}}{{32}} = 0,05{\text{ }}mol$ Phương trình hóa học của S cháy trong không khí: S + O2 $\xrightarrow{{{t^o}}}$ SO2 Tỉ lệ theo PT: 1mol 1mol 0,05mol ?mol Theo phương trình hóa học, ta có: ${n_{S{O_2}}} = {n_S}$ $ = 0,05{\text{ }}mol$ => khối lượng khí lưu huỳnh đioxit sinh ra là ${m_{S{O_2}}} = n.M = 0,05.64 = 3,2\,gam$
Câu 3 :
Tính thể tích của oxygen (đkc) cần dùng để đốt cháy hết 3,1 gam P, biết phản ứng sinh ra chất rắn P2O5.
Đáp án : C Phương pháp giải :
+) Tính số mol P phản ứng PTHH: 4P + 5O2 $\xrightarrow{{{t^o}}}$ 2P2O5 Tỉ lệ theo PT: 4mol 5mol 2mol 1mol ?mol Từ PTHH, ta có: ${n_{{O_2}}} = \dfrac{{0,1.5}}{4}$ => Thể tích oxi cần dùng là: V = 24,79.n Lời giải chi tiết :
Số mol P phản ứng là: ${n_P} = \dfrac{{3,1}}{{31}} = 0,1\,mol$ PTHH: 4P + 5O2 $\xrightarrow{{{t^o}}}$ 2P2O5 Tỉ lệ theo PT: 4mol 5mol 1mol ? mol Nhân chéo chia ngang ta được: ${n_{{O_2}}} = \dfrac{{0,1.5}}{4}$ $ = 0,125\,mol$ => Thể tích oxi cần dùng là: V = 22,4.n = 24,79.0,125 = 3,1 lít
Câu 4 :
Đốt cháy hoàn toàn 1,12 lít khí CH4 (đktc) cần dùng V lít khí O2 (đktc), sau phản ứng thu được sản phẩm là khí cacbonic (CO2) và nước (H2O). Giá trị của V là
Đáp án : A Phương pháp giải :
+) Tính số mol khí CH4 phản ứng: ${n_{C{H_4}}} = \dfrac{{1,12}}{{22,4}}$ PTHH: CH4 + 2O2 $\xrightarrow{{{t^o}}}$ CO2 + 2H2O Tỉ lệ theo PT: 1mol 2mol 1mol 2mol 0,05mol ?mol Từ PTHH, ta có: ${n_{{O_2}}} = \dfrac{{0,05.2}}{1}$ => thể tích khí O2 : V = 22,4.n Lời giải chi tiết :
Số mol khí CH4 phản ứng là: ${n_{C{H_4}}} = \dfrac{{1,12}}{{22,4}} = 0,05\,mol$ PTHH: CH4 + 2O2 $\xrightarrow{{{t^o}}}$ CO2 + 2H2O Tỉ lệ theo PT: 1mol 2mol 1mol 2mol 0,05mol ?mol Từ PTHH, ta có: ${n_{{O_2}}} = \dfrac{{0,05.2}}{1} = 0,1\,mol$ => thể tích khí O2 cần dùng là: ${V_{{O_2}}} = 22,4.n = 22,4.0,1 = 2,24$ lít
Câu 5 :
Đốt cháy hoàn toàn 13 gam Zn trong oxi thu được ZnO. Thể tích khí oxi đã dùng (đktc) là
Đáp án : C Phương pháp giải :
+) Tính số mol Zn : ${n_{Zn}} = \dfrac{{13}}{{65}}$ PTHH: 2Zn + O2 $\xrightarrow{{{t^o}}}$ 2ZnO Tỉ lệ theo PT: 2mol 1mol 2mol 0,2mol ? mol Số mol khí O2 đã dùng là: ${n_{{O_2}}} = \dfrac{{0,2.1}}{2}$ => Thể tích O2 là: V = n.22,4 Lời giải chi tiết :
Số mol Zn là: ${n_{Zn}} = \dfrac{{13}}{{65}} = 0,2\,mol$ PTHH: 2Zn + O2 $\xrightarrow{{{t^o}}}$ 2ZnO Tỉ lệ theo PT: 2mol 1mol 2mol 0,2mol ? mol Số mol khí O2 đã dùng là: ${n_{{O_2}}} = \dfrac{{0,2.1}}{2} = 0,1\,mol$ => Thể tích O2 là: V = n.22,4 = 0,1.22,4 = 2,24 lít
Câu 6 :
Hãy tìm thể tích khí oxi đủ để đốt cháy hết 11,2 lít khí A. Biết rằng: – Khí A có tỉ lệ khối đối với không khí là 0,552 – Thành phần theo khối lượng của khí A là: 75% C và 25% H Các thể tích khí đo ở đktc
Đáp án : C Phương pháp giải :
+) dA/kk = 0,552 => MA = 29 . 0,552 +) mC = $\dfrac{{16.75}}{{100}}$ ; mH = $\dfrac{{16.25}}{{100}}$ +) Phương trình phản ứng : CH4 + 2O2 $\xrightarrow{{{t^o}}}$ CO2 + 2H2O +) ${V_{{O_2}}} = 2.{V_{C{H_4}}}$ Lời giải chi tiết :
Khối lượng mol khí A tham gia phản ứng là: dA/kk = 0,552 => MA = 29 . 0,552 = 16 gam mC = $\dfrac{{16.75}}{{100}}$ = 12 ; mH = $\dfrac{{16.25}}{{100}}$ = 4 Đặt công thức hóa học của khí A là CxHy, ta có: 12 . x = 12 => x = 1 1 . y = 4 => y = 4 Công thức hóa học của khí A là CH4 Phương trình phản ứng : CH4 + 2O2 $\xrightarrow{{{t^o}}}$ CO2 + 2H2O Theo phương trình phản ứng, thể tích oxi bằng hai lần thể tích khí CH4 nên thể tích khí oxi đủ để đốt cháy hết 11,2 lít khí A là: ${V_{{O_2}}} = 2.{V_{C{H_4}}}$ = 11,2 . 2 = 22,4 lít Biết rằng 2,3 gam một kim loại R (có hoá trị I) tác dụng vừa đủ với 1,12 lít khí clo (ở đktc) theo sơ đồ phản ứng: R + Cl2 $\xrightarrow{{{t^o}}}$ RCl Câu 7
Kim loại R là
Đáp án : D Phương pháp giải :
+) Tính số mol Cl2 cần dùng: ${n_{C{l_2}}} = \dfrac{V}{{22,4}}$ PTHH: 2R + Cl2 $\xrightarrow{{{t^o}}}$ 2RCl Tỉ lệ theo PT: 2mol 1mol 2 mol ?mol 0,05mol Từ PTHH, ta có: ${n_R} = 2.{n_{C{l_2}}}$ => ${M_R} = \dfrac{{{m_R}}}{{{n_R}}}$ Lời giải chi tiết :
Số mol Cl2 cần dùng là: ${n_{C{l_2}}} = \dfrac{V}{{22,4}} = \dfrac{{1,12}}{{22,4}} = 0,05{\text{ }}mol$ PTHH: 2R + Cl2 $\xrightarrow{{{t^o}}}$ 2RCl Tỉ lệ theo PT: 2mol 1mol 2 mol ?mol 0,05mol Từ PTHH, ta có: ${n_R} = 2.{n_{C{l_2}}} = 2.0,05 = 0,1{\text{ }}mol$ => Khối lượng mol nguyên tử của R là: ${M_R} = \dfrac{{{m_R}}}{{{n_R}}} = \dfrac{{2,3}}{{0,1}} = 23\,g/mol$ => R là natri (Na) Câu 8
Khối lượng sản phẩm tạo thành là
Đáp án : A Phương pháp giải :
Cách 1: PTHH: 2Na + Cl2 $\xrightarrow{{{t^o}}}$ 2NaCl Theo pt: 2mol 1mol 2mol 0,05mol ?mol Từ PTHH, ta có: ${n_{NaCl}} = 2{n_{C{l_2}}}$ => khối lượng của sản phẩm là: mNaCl = n.M Cách 2: Theo định luật bảo toàn khối lượng: ${m_{NaCl}} = {m_{Na}} + {m_{C{l_2}}}$ Lời giải chi tiết :
Cách 1: PTHH: 2Na + Cl2 $\xrightarrow{{{t^o}}}$ 2NaCl Theo pt: 2mol 1mol 2mol 0,05mol ?mol Từ PTHH, ta có: ${n_{NaCl}} = 2{n_{C{l_2}}} = 2.0,05 = 0,1{\text{ }}mol$ => khối lượng của sản phẩm là: mNaCl = n.M = 0,1.58,5 = 5,85 gam Cách 2: Theo định luật bảo toàn khối lượng: ${m_{NaCl}} = {m_{Na}} + {m_{C{l_2}}}{\text{ = 2}},3 + 0,05.71 = 5,85{\text{ }}gam$ Trong phòng thí nghiệm người ta có thể điều chế oxi bằng cách nhiệt phân kali clorat theo sơ đồ phản ứng: KClO3 $\xrightarrow{{{t^o}}}$ KCl + O2 Câu 9
Khối lượng KClO3 cần thiết để điều chế được 9,6 gam oxi là
Đáp án : A Phương pháp giải :
Tính số mol O2 thu được: ${n_{{O_2}}} = \dfrac{m}{M} = \dfrac{{9,6}}{{32}}$ PTHH: 2KClO3 $\xrightarrow{{{t^o}}}$ 2KCl + 3O2 Tỉ lệ theo PT: 2 mol 2 mol 3 mol ?mol ?mol 0,3 mol Từ PTHH, ta có: ${n_{KCl{O_3}}} = \dfrac{2}{3}.{\text{ }}{n_{{O_2}}}$ => ${m_{KCl{O_3}}}$ = n . M Lời giải chi tiết :
Số mol O2 thu được là: ${n_{{O_2}}} = \dfrac{m}{M} = \dfrac{{9,6}}{{32}} = 0,3{\text{ }}mol$ PTHH: 2KClO3 $\xrightarrow{{{t^o}}}$ 2KCl + 3O2 Tỉ lệ theo PT: 2 mol 2 mol 3 mol ?mol ?mol 0,3 mol Từ PTHH, ta có: ${n_{KCl{O_3}}} = \dfrac{2}{3}.{\text{ }}{n_{{O_2}}} = \dfrac{2}{3}.0,3 = 0,2{\text{ }}mol$ => Khối lượng của KClO3 cần dùng là: ${m_{KCl{O_3}}}$ = n . M = 0,2.122,5 = 24,5 gam Câu 10
Khối lượng KCl tạo thành là
Đáp án : C Phương pháp giải :
Cách 1: Từ PTHH, ta có: ${n_{KCl}} = \dfrac{2}{3}.{\text{ }}{n_{{O_2}}}$ => mKCl = n.M Cách 2: Theo định luật bảo toàn khối lượng: ${m_{KCl}} = {m_{KCl{O_3}}} - {m_{{O_2}}}$ Lời giải chi tiết :
Cách 1: Từ PTHH, ta có: ${n_{KCl}} = \dfrac{2}{3}.{\text{ }}{n_{{O_2}}} = \dfrac{2}{3}.0,3 = 0,2{\text{ }}mol$ => Khối lượng của KCl tạo thành là: mKCl = n.M = 0,2.74,5 = 14,9 gam Cách 2: Theo định luật bảo toàn khối lượng: ${m_{KCl}} = {m_{KCl{O_3}}} - {m_{{O_2}}}$ = 24,5 - 9,6 = 14,9 gam Cho phương trình hóa học sau: CaCO3 $\xrightarrow{{{t^o}}}$ CaO + CO2 Câu 11
Cần dùng bao nhiêu mol CaCO3 để điều chế được 11,2 gam CaO ?
Đáp án : C Phương pháp giải :
Tính số mol CaO PTHH: CaCO3 $\xrightarrow{{{t^o}}}$ CaO + CO2 Tỉ lệ theo PT: 1mol 1mol ?mol 0,2mol Từ PTHH, ta có: ${n_{CaC{O_3}}} = {n_{CaO}}$ Lời giải chi tiết :
Số mol CaO là : ${n_{Ca{\text{O}}}} = \dfrac{{11,2}}{{56}} = 0,2\,mol$ PTHH: CaCO3 $\xrightarrow{{{t^o}}}$ CaO + CO2 Tỉ lệ theo PT: 1mol 1mol ?mol 0,2mol Từ PTHH, ta có: ${n_{CaC{O_3}}} = {n_{CaO}} = 0,2{\text{ }}mol$ Vậy cần dùng 0,2 mol CaCO3 để điều chế CaO Câu 12
Muốn điều chế được 7 gam CaO cần dùng bao nhiêu gam CaCO3?
Đáp án : D Phương pháp giải :
Tính số mol CaO PTHH: CaCO3 $\xrightarrow{{{t^o}}}$ CaO + CO2 Tỉ lệ theo PT: 1mol 1mol ?mol 0,2mol Từ PTHH, ta có: ${n_{CaC{O_3}}} = {n_{CaO}}$ => khối lượng CaCO3 Lời giải chi tiết :
Số mol CaO là : ${n_{Ca{\text{O}}}} = \dfrac{7}{{56}} = 0,125\,mol$ PTHH: CaCO3 $\xrightarrow{{{t^o}}}$ CaO + CO2 Tỉ lệ theo PT: 1mol 1mol ?mol 0,2mol Từ PTHH, ta có: ${n_{CaC{O_3}}} = {n_{CaO}} = 0,125{\text{ }}mol$ => khối lượng CaCO3 cần dùng là: ${m_{CaC{O_3}}} = n.M = 0,125.100 = 12,5\,gam$ Câu 13
Nếu có 3,5 mol CaCO3 tham gia phản ứng sẽ sinh ra bao nhiêu lít CO2 (đktc) ?
Đáp án : B Phương pháp giải :
PTHH: CaCO3 $\xrightarrow{{{t^o}}}$ CaO + CO2 Tỉ lệ theo PT: 1mol 1mol 1mol ? mol 3,5 mol Theo PTHH, ta có: ${n_{C{O_2}}} = {n_{CaC{{\text{O}}_3}}}$ => Thể tích khí CO2 là: ${V_{C{O_2}}} = 22,4.n$ Lời giải chi tiết :
PTHH: CaCO3 $\xrightarrow{{{t^o}}}$ CaO + CO2 Tỉ lệ theo PT: 1mol 1mol 1mol ? mol 3,5 mol Theo PTHH, ta có: ${n_{C{O_2}}} = {n_{CaC{{\text{O}}_3}}} = 3,5\,mol$ => Thể tích khí CO2 là: ${V_{C{O_2}}} = 22,4.n = 22,4.3,5 = 78,4{\text{ }}lít$ Câu 14
Nếu thu được 13,44 lít khí CO2 ở đktc thì có bao nhiêu gam chất rắn tham gia và tạo thành sau phản ứng ?
Đáp án : B Phương pháp giải :
PTHH: CaCO3 $\xrightarrow{{{t^o}}}$ CaO + CO2 Tỉ lệ theo PT: 1mol 1mol 1mol ? mol ? mol 0,6 mol Theo PTHH, ta có: ${n_{C{O_2}}} = {n_{CaO}} = {n_{CaC{{\text{O}}_3}}}$ Khối lượng CaCO3 phản ứng là: ${m_{CaC{{\text{O}}_3}}} = n.M$ Khối lượng CaO tạo thành là: mCaO = n.M Lời giải chi tiết :
Số mol khí CO2 thu được là: ${n_{C{O_2}}} = \dfrac{{13,44}}{{22,4}} = 0,6\,mol$ PTHH: CaCO3 $\xrightarrow{{{t^o}}}$ CaO + CO2 Tỉ lệ theo PT: 1mol 1mol 1mol ? mol ? mol 0,6 mol Theo PTHH, ta có: ${n_{C{O_2}}} = {n_{CaO}} = {n_{CaC{{\text{O}}_3}}} = 0,6\,mol$ Khối lượng CaCO3 phản ứng là: ${m_{CaC{{\text{O}}_3}}} = n.M = 0,6.100 = 60\,gam$ Khối lượng CaO tạo thành là: mCaO = n.M = 0,6.56 = 33,6 gam
Câu 15 :
Khử 48 gam đồng (II) oxit bằng hiđro được 36,48 gam đồng sau phản ứng. Hiệu suất của phản ứng trên là:
Đáp án : A Phương pháp giải :
Đổi số mol Cu, CuO =? CuO + H2 \( \to\) Cu + H2O \(\% H = \dfrac{{{n_{Cu}}}}{{{n_{CuO}}}}.100\% = ?\% \) Lời giải chi tiết :
CuO + H2 \(\xrightarrow{{{t^0}}}\) Cu + H2O nCu = 36,48 /64 = 0,57 (mol) nCuO = 48/ 80 = 0,6 (mol) \(\% H = \dfrac{{{n_{Cu}}}}{{{n_{CuO}}}}.100\% = \dfrac{{0,57}}{{0,6}}.100\% = 95\% \)
Câu 16 :
Cho dung dịch chứa 0,2 mol NaOH phản ứng với dung dịch chứa 0,3 mol HCl thu được dung dịch A. Tính tổng khối lượng chất tan trong dung dịch A. Biết PTHH: NaOH + HCl → NaCl + H2O.
Đáp án : A Phương pháp giải :
PTHH: NaOH + HCl → NaCl + H2O Từ số mol ban đầu xác định chất hết, chất dư Tính theo PTHH suy ra thành phần của dung dịch A Tính tổng khối lượng các chất tan có trong A Lời giải chi tiết :
PTHH: NaOH + HCl → NaCl + H2O Bđầu: 0,2 0,3 (Vì \(\dfrac{{0,2}}{1} < \dfrac{{0,3}}{1}\) ⟹ NaOH hết) P.ứng: 0,2 → 0,2 → 0,2 Sau p.ư: 0 0,1 0,2 Dung dịch A có các chất tan: \(\left\{ \begin{array}{l}HCl:0,1\left( {mol} \right)\\NaCl:0,2\left( {mol} \right)\end{array} \right.\) ⟹ ∑mchất tan = mHCl + mNaCl = 0,1.36,5 + 0,2.58,5 = 15,35 gam.
Câu 17 :
Hòa tan 23,2 gam hỗn hợp Zn và Al2O3 trong V lít dung dịch HCl 2M thu được dung dịch muối và 4,48 lít khí H2 (đktc). Giá trị V là
Đáp án : D Phương pháp giải :
Viết các PTHH Từ số mol khí H2 tính được số mol Zn Từ khối lượng hh suy ra khối lượng Al2O3 Tính theo các PTHH được số mol HCl Lời giải chi tiết :
nH2 = 4,48/22,4 = 0,2 mol Zn + 2HCl → ZnCl2 + H2 0,2 ← 0,4 ← 0,2 (mol) ⟹ mAl2O3 = 23,2 - 0,2.65 = 10,2 gam ⟹ nAl2O3 = 10,2/102 = 0,1 mol Al2O3 + 6HCl → 2AlCl3 + 3H2O 0,1 → 0,6 ⟹ nHCl = 0,4 + 0,6 = 1 mol ⟹ Vdd HCl = n : CM = 1/2 = 0,5 lít
Câu 18 :
): Hòa tan 28,8 gam hỗn hợp Mg và CuO trong m gam dung dịch H2SO4 20% thu được dung dịch muối và 4,48 lít khí H2 (đktc). Giá trị m là
Đáp án : C Phương pháp giải :
Viết các PTHH Từ số mol khí H2 tính được số mol Mg Từ khối lượng hh suy ra khối lượng CuO Tính theo các PTHH được số mol H2SO4 Lời giải chi tiết :
nH2 = 4,48/22,4 = 0,2 mol Mg + H2SO4 → MgSO4 + H2 0,2 ← 0,2 ← 0,2 ⟹ mCuO = 28,8 - 4,8 = 24 gam ⟹ nCuO = 24/80 = 0,3 mol CuO + H2SO4 → CuSO4 + H2O 0,3 → 0,3 ⟹ ∑nH2SO4 = 0,2 + 0,3 = 0,5 mol ⟹ mH2SO4 = 0,5.98 = 49 gam ⟹ mdd H2SO4 = 49.100/20 = 245 gam
Câu 19 :
Hòa tan 31,2 gam hỗn hợp Ca(NO3)2 và Mg(NO3)2 trong dung dịch Na2CO3 thu được 18,4 gam kết tủa và dung dịch muối. Phần trăm khối muối Mg(NO3)2 là
Đáp án : D Phương pháp giải :
Đặt ẩn là số mol mỗi muối trong hh đầu Từ khối lượng hỗn hợp ⟹ PT (1) Viết PTHH; dựa vào PTHH tính được số mol mỗi kết tủa ⟹ PT (2) Từ (1) và (2) tính được số mol mỗi muối. Lời giải chi tiết :
Đặt nCa(NO3)2 = a mol; nMg(NO3)2 = b mol ⟹ mhh = 164a + 148b = 31,2 (1) Ca(NO3)2 + Na2CO3 → 2NaNO3 + CaCO3 ↓ a → a Mg(NO3)2 + Na2CO3 → 2NaNO3 + MgCO3 ↓ b → b ⟹ m ↓ = mCaCO3 + mMgCO3 ⟹ 100a + 84b = 18,4 (2) Từ (1) và (2) ⟹ a = 0,1; b = 0,1 ⟹ mMg(NO3)2 = 0,1.148 = 14,8 gam ⟹ %mMg(NO3)2 = \(\dfrac{{14,8}}{{31,2}}.100\% \) = 47,4%.
Câu 20 :
Hòa tan 44,8 gam hỗn hợp NH4NO3, (NH4)2CO3 trong dung dịch Ba(OH)2 thu được 59,1 gam kết tủa và V lít khí NH3 (đktc). Giá trị V là:
Đáp án : D Phương pháp giải :
Viết các PTHH; từ số mol kết tủa BaCO3 suy ra số mol (NH4)2CO3 Từ khối lượng hỗn hợp và (NH4)2CO3 suy ra khối lượng NH4NO3 Tính theo PTHH được số mol khí NH3 Lời giải chi tiết :
nBaCO3 = 59,1/197 = 0,3 mol (NH4)2CO3 + Ba(OH)2 → BaCO3 + 2NH3 ↑ + 2H2O 0,3 ← 0,3 → 0,6 ⟹ mNH4NO3 = 44,8 - m(NH4)2CO3 = 44,8 - 0,3.96 = 16 gam ⟹ nNH4NO3 = 16/80 = 0,2 mol 2NH4NO3 + Ba(OH)2 → 2NH3 + Ba(NO3)2 + 2H2O 0,2 → 0,2 ⟹ ∑VNH3 = (0,2+ 0,6).22,4 = 17,92 lít
Câu 21 :
Dẫn 6,72 lít (đktc) hỗn hợp khí CO, CO2 qua dung dịch Ca(OH)2 dư. Sau khi phản ứng hoàn toàn thấy xuất hiện 20 gam kết tủa. Phần trăm thể tích khí CO là
Đáp án : A Phương pháp giải :
Viết PTHH; từ số mol CaCO3 tính được số mol khí CO2 Tính thể tích CO2 suy ra thể tích khí CO Tính phần trăm thể tích khí CO Lời giải chi tiết :
nCaCO3 = 20/100 = 0,2 mol CO2 + Ca(OH)2 → CaCO3 + H2O 0,2 ← 0,2 ⟹ VCO2 = 0,2.22,4 = 4,48 lít ⟹ VCO = 6,72 - 4,48 = 2,24 lít ⟹ %VCO = \(\dfrac{{2,24}}{{6,72}}.100\% \) = 33,33%
Câu 22 :
Dẫn V lít khí CO2 (đktc) qua bình đựng dung dịch nước vôi trong dư. Sau khi phản ứng kết thúc thấy khối lượng dung dịch Ca(OH)2 giảm 14 gam. Giá trị V là
Đáp án : C Phương pháp giải :
Đặt ẩn là số mol CO2 Ta có mdd giảm = mCaCO3 - mCO2 Suy ra số mol CO2 Xác định giá trị của V Lời giải chi tiết :
Đặt số mol CO2 là x mol CO2 + Ca(OH)2 → CaCO3 ↓ + H2O x → x (mol) Ta có: m dd giảm = mCaCO3 - mCO2 ⟹ 100x - 44x = 14 ⟹ x = 0,25 mol ⟹ VCO2 = 0,25.22,4 = 5,6 lít.
Câu 23 :
Nhúng thanh Fe trong 150 ml dung dịch AgNO3 xM sau khi phản ứng kết thúc thấy khối lượng thanh kim loại tăng 24 gam. Biết phản ứng xảy ra hoàn toàn. Giá trị của x là
Đáp án : B Phương pháp giải :
Đặt ẩn là số mol AgNO3 Viết PTHH; đặt mol AgNO3 vào suy ra số mol Fe và Ag Ta có mthanh KL tăng = mAg - mFe pư Từ đó tính được số mol AgNO3 Tính nồng độ dung dịch AgNO3 Lời giải chi tiết :
Đặt số mol AgNO3 phản ứng là x mol Fe + 2AgNO3 → Fe(NO3)2 + 2Ag 0,5x ← x → x (mol) Ta có mthanh KL tăng = mAg - mFe pư ⇔ 108x - 56.0,5x = 24 ⇔ x = 0,3 mol ⟹ x = CM dd AgNO3 = 0,3 : 0,15 = 2M
Câu 24 :
Hòa tan m gam Mg trong bình đựng dung dịch H2SO4, sau khi phản ứng hết thấy khối lượng bình tăng 4,4 gam. Giá trị m là
Đáp án : B Phương pháp giải :
Đặt ẩn là số mol Mg Viết PTHH, đặt số mol Mg vào PTHH suy ra số mol H2 Khối lượng bình tăng: mbình tăng = mMg pư - mH2 Suy ra số mol Mg ⟹ khối lượng Mg Lời giải chi tiết :
Đặt nMg = x mol Mg + H2SO4 → MgSO4 + H2 ↑ x → x (mol) Khối lượng bình tăng: mbình tăng = mFe pư - mH2 ⟹ 4,4 = 24x - 2x ⟹ x = 0,2 mol ⟹ m = mMg = 4,8 gam
Câu 25 :
Đốt cháy hết 5,6 lít hỗn hợp CH4 và C2H4 (đktc) cần dùng 13,44 lít khí O2 (đktc) thu được hỗn hợp khí và hơi. Phần trăm thể tích CH4 là
Đáp án : C Phương pháp giải :
Đặt ẩn là số mol mỗi khí + Từ thể tích hỗn hợp ⟹ PT (1) + Viết PTHH; từ lượng O2 ⟹ PT (2) Từ (1) và (2) tính được số mol mỗi khí Lời giải chi tiết :
Đặt nCH4 = x mol; nC2H4 = y mol ⟹ nhh = x + y = 0,25 (1) CH4 + 2O2 → CO2 + 2H2O x → 2x C2H4 + 3O2 → 2H2O + 2CO2 y → 3y ⟹ nO2 = 2x + 3y = 0,6 (2) Từ (1) và (2) ⟹ x = 0,15; y = 0,1 mol ⟹ %VCH4 = \(\dfrac{{0,15}}{{0,25}}.100\% \) = 60%
Câu 26 :
Hòa tan hết 21,6 gam hỗn hợp Mg và Fe trong dung dịch HCl thu được dung dịch muối và 11,2 lít khí H2 (đktc). Phần trăm khối lượng Mg là
Đáp án : D Phương pháp giải :
Đặt ẩn là số mol mỗi kim loại + Từ khối lượng ⟹ PT (1) + Viết PTHH, từ số mol H2 ⟹ PT (2) Giải hệ (1) (2) được số mol mỗi kim loại. Lời giải chi tiết :
nH2 = 11,2/22,4 = 0,5 mol Đặt nMg = x mol; nFe = y mol ⟹ mhh = 24x + 56y = 21,6 (1) Mg + H2SO4 → MgSO4 + H2 x → x Fe + H2SO4 → FeSO4 + H2 y → y ⟹ nH2 = x + y = 0,5 (2) Từ (1) và (2) ⟹ x = 0,2; y = 0,3 ⟹ mMg = 24.0,2 = 4,8 gam ⟹ %mMg = \(\dfrac{{4,8}}{{21,6}}.100\% \) = 22,2%.
Câu 27 :
Hòa tan hết 17,05 gam hỗn hợp Al và Zn cần vừa đủ 124,1 gam dung dịch HCl 25% thu được dung dịch muối và khí không màu. Phần trăm khối lượng Zn trong hỗn hợp đầu là
Đáp án : C Phương pháp giải :
Đặt ẩn là số mol mỗi kim loại + Từ khối lượng ⟹ PT (1) + Viết PTHH, từ số mol HCl ⟹ PT (2) Giải hệ (1) (2) được số mol mỗi kim loại. Lời giải chi tiết :
mHCl = 124,1.25% = 31,025 gam ⟹ nHCl = 31,025 : 36,5 = 0,85 mol Đặt nZn = x mol; nAl = y mol mhh = 65x + 27y = 17,05 (1) Zn + 2HCl → ZnCl2 + H2 x → 2x (mol) 2Al + 6HCl → 2AlCl3 + 3H2. y → 3y (mol) ⟹ nHCl = 2x + 3y = 0,85 (2) Từ (1) và (2) ⟹ x = 0,2; y = 0,15 ⟹ mZn = 65.0,2 = 13 gam ⟹ %mZn = \(\dfrac{{13}}{{17,05}}.100\% \) = 76,2%
Câu 28 :
Hòa tan 18,4 gam Fe, Cu trong dung dịch HCl dư thu được 2,24 lít khí (đktc) thu được dung dịch muối và 1 chất rắn không tan. Phần trăm khối lượng Cu trong hỗn hợp đầu là
Đáp án : B Phương pháp giải :
Viết PTHH của phản ứng xảy ra; từ số mol H2 tính được số mol Fe phản ứng. Suy ra khối lượng Cu trong hỗn hợp ⟹ % khối lượng Cu trong hỗn hợp. Lời giải chi tiết :
nH2 = 2,24/22,4 = 0,1 mol Fe + 2HCl → FeCl2 + H2 0,1 ← 0,1 (mol) ⟹ mFe = 0,1.56 = 5,6 gam ⟹ mCu = 18,4 - 5,6 = 12,8 gam ⟹ %mCu = \(\dfrac{{12,8}}{{18,4}}.100\% \) = 69,6%
Câu 29 :
Cho 100 ml dung dịch chứa NaCl 2M, NaBr 1M vào V lít dung dịch AgNO3 2M thu được kết tủa bạc clorua và dung dịch muối natri nitrat. Giá trị V là
Đáp án : C Phương pháp giải :
Tính số mol NaCl, NaBr. Dựa vào phương trình hóa học tính được tổng số mol AgNO3 đã phản ứng. Lời giải chi tiết :
nNaCl = 0,1.2 = 0,2 mol; nNaBr = 0,1.1 = 0,1 mol NaCl + AgNO3 → NaNO3 + AgCl. 0,2 → 0,2 NaBr + AgNO3 → NaNO3 + AgBr. 0,1 → 0,1 ⟹ nAgNO3 = 0,3 mol ⟹ Vdd AgNO3 = 0,3/2 = 0,15 lít
Câu 30 :
Để trung hòa hết hỗn hợp gồm 8 gam NaOH và 25,65 gam Ba(OH)2 cần dùng V lít dung dịch HCl 2M thu được dung dịch muối. Giá trị V là
Đáp án : B Phương pháp giải :
Tính số mol NaOH, Ba(OH)2. Dựa vào phương trình hóa học tính được tổng số mol HCl đã phản ứng. Lời giải chi tiết :
nNaOH = 8/40 = 0,2 mol; nBa(OH)2 = 25,65/171 = 0,15 mol NaOH + HCl → NaCl + H2O 0,2 → 0,2 Ba(OH)2 + 2HCl → BaCl2 + 2H2O 0,15 → 0,3 ⟹ nHCl = 0,2 + 0,3 = 0,5 mol ⟹ V dd HCl = 0,5/2 = 0,25 lít
Câu 31 :
Hòa tan hết hỗn hợp gồm 15,9 gam Na2CO3 và 34,5 gam K2CO3 cần dùng V dung dịch HCl 2M thu được dung dịch muối và khí cacbonic. Giá trị V là
Đáp án : A Phương pháp giải :
Tính số mol Na2CO3, K2CO3. Dựa vào phương trình hóa học tính được tổng số mol HCl đã phản ứng. Lời giải chi tiết :
nNa2CO3 = 15,9/106 = 0,15 mol; nK2CO3 = 34,5/138 = 0,25 mol Na2CO3 + 2HCl → 2NaCl + CO2 + H2O 0,15 → 0,3 K2CO3 + 2HCl → 2KCl + CO2 + H2O 0,25 → 0,5 ⟹ nHCl = 0,3 + 0,5 = 0,8 mol ⟹ V dd HCl = 0,8/2 = 0,4 lít
Câu 32 :
Đốt cháy hỗn hợp chứa 4,48 lít CH4 và 2,24 lít C2H4 thì cần V lít O2 (đktc) thu được sản phẩm CO2 và nước. Giá trị của V là
Đáp án : C Phương pháp giải :
Tính số mol CH4, C2H4. Dựa vào phương trình hóa học tính được tổng số mol O2 đã phản ứng. Lời giải chi tiết :
nCH4 = 4,48/22,4 = 0,2 mol; nC2H4 = 2,24/22,4 = 0,1 mol CH4 + 2O2 → CO2 + 2H2O 0,2 → 0,4 C2H4 + 3O2 → 2CO2 + 2H2O 0,1 → 0,3 ⟹ nO2 = 0,4 + 0,3 = 0,7 mol ⟹ VO2 = 0,7.22,4 = 15,68 lít
Câu 33 :
Cần dùng V lít H2 (đktc) để khử hoàn toàn hỗn hợp gồm 10,8 gam FeO và 24 gam Fe2O3 thu được kim loại và H2O. Giá trị V là
Đáp án : B Phương pháp giải :
Tính số mol FeO, Fe2O3. Dựa vào phương trình hóa học tính được tổng số mol H2 đã phản ứng. Lời giải chi tiết :
nFeO = 10,8/72 = 0,15 mol; nFe2O3 = 24/160 = 0,15 mol FeO + H2 → Fe + H2O 0,15 → 0,15 Fe2O3 + 3H2 → 2Fe + 3H2O 0,15 → 0,45 ⟹ nH2 = 0,15 + 0,45 = 0,6 mol ⟹ VH2 = 0,6.22,4 = 13,44 lít.
Câu 34 :
Hòa tan hoàn toàn 11,2 gam sắt (Fe) trong axit clohiđric (HCl) thu được muối sắt clorua (FeCl2) và khí hiđro (H2). a. Viết phương trình hóa học xảy ra. b. Tính thể tích khí hiđro (H2) thu được ở điều kiện tiêu chuẩn. c. Tính khối lượng axit clohiđric (HCl) đã tham gia phản ứng.
Đáp án : D Phương pháp giải :
\({n_{Fe}} = {{{m_{Fe}}} \over {{M_{Fe}}}} = {{11,2} \over {56}} = 0,2\,(mol)\) a. Fe + 2 HCl →FeCl2 + H2↑ Theo PT: 1 2 1 (mol) Theo ĐB: 0,2 x = ? y = ? (mol) b. Tìm ra \(y = {{0,2 \times 1} \over 1} = ? \Rightarrow {V_{{H_2}(dktc)}} = 22,4 \times y = ?\,(l)\) c. Tìm ra \(x = {{0,2 \times 2} \over 1} = ? \Rightarrow {m_{HCl}} = {n_{HCl}} \times {M_{HCl}} = 36,5 \times x = ?\,(g)\) Lời giải chi tiết :
a. Fe + 2 HCl →FeCl2 + H2↑ b. \({n_{Fe}} = {{{m_{Fe}}} \over {{M_{Fe}}}} = {{11,2} \over {56}} = 0,2\,(mol)\) Theo phương trình hóa học: \({n_{{H_2}}} = {n_{Fe}} = 0,2\,(mol)\) \({V_{{H_2}(dktc)}} = {n_{{H_2}}} \times 22,4 = 0,2 \times 22,4 = 4,48\,(l)\) c. Theo phương trình hóa học: \({n_{HCl}} = 2{n_{Fe}} = 2 \times 0,2 = 0,4\,(mol)\) mHCl = nHCl × MHCl = 0,4 × 36,5 = 14,6 (g)
Câu 35 :
Magie tác dụng với axit clohiđric: Mg + 2HCl → MgCl2 + H2↑ Nếu có 12g Mg tham gia phản ứng, em hãy tìm: a) Thể tích khí hiđro thu được ở đktc. b) Khối lượng axit clohiđric cần dùng.
Đáp án : D Phương pháp giải :
Số mol của 12 g Mg là: \({n_{Mg}} = {{{m_{Mg}}} \over {{M_{Mg}}}} = {{12} \over {24}} = 0,5\,(mol)\) PTPƯ: Mg + 2HCl → MgCl2 + H2↑ Theo PTP Ư: 1 2 1 (mol) Theo đề bài: 0,5 x=? y = ? (mol) Tìm x, y từ đó tính được VH2(đktc) và mHCl = ? Lời giải chi tiết :
Số mol của 12 g Mg là: \({n_{Mg}} = {{{m_{Mg}}} \over {{M_{Mg}}}} = {{12} \over {24}} = 0,5\,(mol)\) PTPƯ: Mg + 2HCl → MgCl2 + H2↑ Theo PTP Ư: 1 2 1 (mol) Theo đề bài: 0,5 x=? y = ? (mol) a) số mol H2 sinh ra là: y = nH2 = \({{0,5 \times 1} \over 1} = 0,5\,(mol)\) => Thể tích của H2 thu được ở đktc là: VH2(ĐKTC) =nH2×22,4 = 0,5×22,4 = 11,2 (lít) b) Số mol HCl phản ứng là: x = nHCl = \({{0,5 \times 2} \over 1} = 1\,(mol)\) Khối lượng HCl tham gia phản ứng là: mHCl = nHCl×MHCl = 1. 36,5 = 36,5 (g)
Câu 36 :
Đốt cháy hoàn toàn 27 gam Al trong oxi thu được Al2O3. Tính khối lượng Al2O3 thu được và thể tích oxygen (đkc) đã dùng.
Đáp án : A Phương pháp giải :
Viết phương trình hóa học xảy ra, tính toán theo phương trình hóa học. Lời giải chi tiết :
|














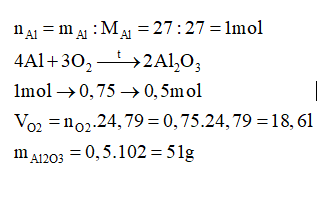





Danh sách bình luận