Bài 46.12* trang 75 SBT hóa học 11Giải bài 46.12* trang 75 sách bài tập hóa học 11. Hỗn hợp M chứa ba hợp chất hữu cơ X, Y và Z. Hai chất X và Y kế tiếp nhau... Quảng cáo
Đề bài Hỗn hợp M chứa ba hợp chất hữu cơ X, Y và Z. Hai chất X và Y kế tiếp nhau trong một dãy đồng đẳng ( \({M_Y} > {M_X}\) ). Chất Z là đồng phân của chất Y. Nếu làm bay hơi 3,2 g M thì thể tích hơi thu được đúng bằng thể tích của 1,68g khí nitơ ở cùng điều kiện. Để đốt cháy hoàn toàn 16g M cần dùng vừa hết 23,52 lít \({O_2}\) (đktc). Sản phẩm cháy chỉ có \(C{O_2}\) và \({H_2}O\) với số mol bằng nhau. Nếu cho 48g M tác dụng với Na(lấy dư), thu được 1,68 lít \({H_2}\)(đktc). Hãy xác địng công thức phân tử, công thức cấu tạo, tên và phần trăm về khối lượng của từng chất trong hỗn hợp M. Phương pháp giải - Xem chi tiết +) Đặt công thức chất X là CxHyOz thì chất Y là Cx+1Hy+2Oz. Chất Z là đồng phân của Y nên CTPT giống chất Y. +) Giả sử trong 16 g hỗn hợp M có a mol chất X và b mol hai chất Y và Z +) Viết PTHH: \({C_x}{H_y}{O_z} + (x + \frac{y}{4} - \dfrac{z}{2}){O_2} \to xC{O_2} + \frac{y}{2}{H_2}O\) \({C_{x + 1}}{H_{y + 2}}{O_z} + (x + \dfrac{y}{4} - \dfrac{z}{2} + 1,5){O_2}\)\( \to (x + 1)C{O_2} + \dfrac{{y + 2}}{2}{H_2}O\) +) Dựa vào dữ kiện đề bài và PTHH, lập hpt ẩn x, y, z, a, b. +) Biện luận và giải hpt => CTPT của X, Y, Z. +) Tính phần trăm về khối lượng của từng chất trong hỗn hợp M. Lời giải chi tiết Số mol 3 chất trong 3,20 g hỗn hợp M : \(\dfrac{{1,68}}{{28}}\) = 0,06 (mol). Số mol 3 chất trong 16 g M : \(\dfrac{{0,06.16}}{{3,2}}\) = 0,3 (mol) Khi đốt hỗn hợp M ta chỉ thu được CO2 và H2O. Vậy, các chất trong hỗn hợp đó chỉ có thể chứa C, H và O. Đặt công thức chất X là CxHyOz thì chất Y là Cx+1Hy+2Oz. Chất Z là đồng phân của Y nên công thức phân tử giống chất Y. Giả sử trong 16 g hỗn hợp M có a mol chất X và b mol hai chất Y và Z : \(\left\{ \begin{array}{l} Khi đốt 16 g M thì tổng khối lượng CO2 và H2O thu được bằng tổng khối lượng của M và O2 và bằng : \(16 + \dfrac{{23,52}}{{22,4}}.32 = 49,6(g)\) Mặt khác, số mol CO2 = số mol H2O = n : 44n + 18n = 49,6 \( \Rightarrow \) n = 0,8 \({C_x}{H_y}{O_z} + (x + \dfrac{y}{4} - \dfrac{z}{2}){O_2} \to xC{O_2} + \dfrac{y}{2}{H_2}O\) a mol xa mol \(\dfrac{y}{2}\)a mol \({C_{x + 1}}{H_{y + 2}}{O_z} + (x + \dfrac{y}{4} - \dfrac{z}{2} + 1,5){O_2}\)\( \to (x + 1)C{O_2} + \dfrac{{y + 2}}{2}{H_2}O\) b mol (x + 1)b mol \(\dfrac{{y + 2}}{2}\)b mol Số mol CO2 là : xa + (x + 1)b = 0,8 (mol) (3) Số mol H2O là : \(\dfrac{{y{\rm{a}} + (y + 2)b}}{2}\) = 0,8 (mol) do đó : ya + (y + 2)b = 1,6 (4) Giải hệ phương trình : Biến đổi (3) ta có x(a + b) + b = 0,8 Vì a + b = 0,3 nên b = 0,8 - 0,3x Vì 0 < b < 0,3 nên 0 < 0,8 - 0,3x < 0,3 \( \Rightarrow \) 1,66 < x < 2,66 x nguyên \( \Rightarrow \) x = 2 \( \Rightarrow \) b = 0,8 - 0,3.2 = 0,2 \( \Rightarrow \) a = 0,3 - 0,2 = 0,1 Thay giá trị của a và b vào (4), tìm được y = 4. Thay giá trị của a, b, x và y vào (2), tìm được z = 1. Vậy chất X có CTPT là C2H4O, hai chất Y và Z có cùng CTPT là C3H6O. Chất X chỉ có thể có CTCT là Chất Y là đồng đẳng của X nên CTCT là Hỗn hợp M có phản ứng với Na. Vậy, chất Z phải là ancol CH2 = CH - CH2 - OH (propenol) : 2CH2 = CH - CH2 - OH + 2Na \( \to \) 2CH2 = CH - CH2 - ONa + H2\( \uparrow \) Số mol Z trong 48 g M là : 2.số mol H2 = 2.\(\dfrac{{1,68}}{{22,4}}\) =0,15 (mol). Số mol Z trong 16 g M là : \(\dfrac{{0,15.16}}{{48}}\) = 0,05 (mol) Số mol Y trong 16 g M là : 0,2 - 0,05 = 0,15 (mol). Thành phần khối lượng của hỗn hợp M : Chất X chiếm : \(\dfrac{{0,1.44}}{{16}}\). 100% = 27,5%. Chất Y chiếm : \(\dfrac{{0,15.58}}{{16}}\). 100% = 54,4%. Chất Z chiếm : \(\dfrac{{0,05.58}}{{16}}\). 100% = 18,1%. Loigiaihay.com
|














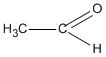 (etanal) vì chất CH2 = CH - OH không bền và chuyển ngay thành etanal.
(etanal) vì chất CH2 = CH - OH không bền và chuyển ngay thành etanal.





Danh sách bình luận