Đề thi học kì 2 Hóa 10 Chân trời sáng tạo - Đề 3Tải về Cho 44,5 gam hỗn hợp bột Zn và Mg tác dụng với dung dịch HCl dư thấy có 22,4 lít khí H2 bay ra (đktc). Khối lượng muối tạo ra trong dung dịch là Quảng cáo
Lựa chọn câu để xem lời giải nhanh hơn
Đề bài Phần trắc nghiệm (7 điểm) Câu 1. Số oxi hóa là một đại số đặc trưng cho đại lượng nào sau đây của nguyên tử trong phân tử? A. Hóa trị. B. Điện tích. C. Khối lượng. D. Số hiệu. Câu 2. Chroium có số oxi hóa +2 trong hợp chất nào sau đây? A. Cr(OH)3. B. Na2CrO4. C. CrCl2. D. Cr2O3. Câu 3. Phản ứng oxi hóa – khử là phản ứng có sự nhường và nhận A. electron. B. neutron. C. proton. D.cation. Câu 4. Cho 44,5 gam hỗn hợp bột Zn và Mg tác dụng với dung dịch HCl dư thấy có 22,4 lít khí H2 bay ra (đktc). Khối lượng muối tạo ra trong dung dịch là A. 80 gam. B. 115,5 gam. C. 51,6 gam. D. 117,5 gam. Câu 5. Sản phẩm của phản ứng giữa dung dịch HCl và dung dịch KMnO4 là A. KCl + MnCl2 + H2O. B. Cl2 + MnCl2 +KOH. C. Cl2 + KCl + MnO2. D. Cl2 + MnCl2 + KCl + H2O. Câu 6. . Fe2O3 là thành phần chính của quặng hematite đỏ, dùng để luyện gang. Số oxi hóa của iron (sắt) trong Fe2O3 là A. +3. B. 3+. C. 3. D.-3. Câu 7. Biện pháp kĩ thuật nào dưới đây không được sử dụng để làm tăng tốc độ phản ứng nung vôi? A. Đập nhỏ đá vôi với kích thước khoảng 10 cm. B. Tăng nồng độ khí carbonic. C. Thổi không khí nén vào lò nung vôi. D.Tăng nhiệt độ của phản ứng lên khoảng 900oC. Câu 8. Dung dịch nào sau đây có thể phân biệt được hai dung dịch NaF và NaCl? A. HCl. B. HF. C. AgNO3. D. Br2. Câu 9. Trong nhóm halogen, từ fluorine đến iodine, nhiệt độ nóng chảy biến đổi như thế nào? A. Giảm dần. B. Tăng dần. C. Không đổi. D. Tuần hoàn Câu 10. Cho các hợp chất sau: NH3, NH4Cl, HNO3, NO2. Số hợp chất chứa nguyên tử nitrogen có số oxi hóa -3 là A. 1 B. 3 C. 2 D. 4 Câu 11. Dung dịch nào sau đây có thể phân biệt được các ion F-, Cl-, Br-, I- trong dung dịch muối? A. NaOH. B. HCl. C. AgNO3. D. KNO3. Câu 12. Dung dịch HF có khả năng ăn mòn thủy tinh là do xảy ra phản ứng hóa học nào sau đây? A. SiO2 + 4HF → SiF4 + 2H2O. B. NaOH + HF → NaF + H2O. C. H2 + F2 → 2HF. D.2F2 + 2H2O → 4HF + O2. Câu 13. Carbon đóng vai trò chất oxi hóa ở phản ứng nào sau đây? A. C + O2 → CO2. B. C + CO2 → 2CO. C. C + H2O → CO + H2. D.C + 2H2 → CH4 Câu 14. KBr thể hiện tính khử khi đun nóng với dung dịch nào sau đây? A. AgNO3. B. H2SO4 đặc. C. HCl. D. H2SO4 loãng. Câu 15. Cho phản ứng thủy phân tinh bột có xúc tác là HCl. Phát biểu nào sau đây không đúng? A. HCl không tác dụng với tinh bột trong quá trình phản ứng. B. Nếu nồng độ HCl tăng, tốc độ phản ứng tăng lên. C. Khi không có HCl, phản ứng thủy phân tinh bột vẫn xảy ra nhưng với tốc độ chậm. D.Nồng độ HCl không đổi sau phản ứng. Câu 16. Hydrohalic acid được dùng làm nguyên liệu để sản xuất hợp chất chống dính teflon là A. HF. B. HCl. C. HBr. D. HI. Câu 17. . Nhỏ vài giọt dung dịch nào sau đây vào dung dịch AgNO3 thu được kết tủa màu vàng nhạt? A. HCl. B. NaBr. C. NaCl. D. HF. Câu 18. Halogen phản ứng mãnh liệt với hydrogen ngay cả trong bóng tối là A. F2. B. Cl2. C. Br2. D. I2. Câu 19. Nguyên tử sulfur chỉ thể hiện tính khử trong chất nào sau đây? A. S. B. SO2. C. H2SO4. D. H2S. Câu 20. Yếu tố nào sau đây không ảnh hưởng đến tốc độ phản ứng? A. áp suất. B. diện tích tiếp xúc. C. khối lượng riêng. D.chất xúc tác. Câu 21. Chất xúc tác là A. chất làm thay đổi tốc độ phản ứng, nhưng khối lượng không thay đổi sau khi phản ứng kết thúc. B. chất làm tăng tốc độ phản ứng. C. chất không thay đổi khối lượng trước và sau phản ứng. D. tất cả các trường hợp trên Câu 22. Nung KNO3 lên 550oC xảy ra phản ứng: KNO3 (s) → KNO2 (s) + 1/2O2 (g) ∆H Phản ứng nhiệt phân KNO3 là A. tỏa nhiệt, có ∆H < 0. B. thu nhiệt, có ∆H > 0. C. tỏa nhiệt, ∆H > 0. D. thu nhiệt, có ∆H < 0. Câu 23. Phản ứng nào sau đây là phản ứng tỏa nhiệt? A. Phản ứng nhiệt phân muối KNO3. B. Phản ứng phân hủy khí NH3. C. Phản ứng oxi hóa glucose trong cơ thể. D.Phản ứng hòa tan NH4Cl trong nước. Câu 24. Đốt cháy hoàn toàn 0,48 gam kim loại M (hóa trị II) bằng khí chlorine, thu được 1,332 gam muối chloride. Kim loại M là A. Ca B. Ba C. Mg D. Cu Câu 25. Phát biểu nào sau đây không đúng? A. Các phản ứng phân hủy thường là phản ứng thu nhiệt. B. Phản ứng càng tỏa ra nhiều nhiệt càng dễ tự xảy ra. C. Phản ứng oxi hóa chất béo cung cấp nhiệt cho cơ thể. D. Các phản ứng khi đun nóng đều dễ xảy ra hơn. Câu 26. Cho phản ứng hóa học sau: Zn (s) + H2SO4 (aq) → ZnSO4 (aq) + H2 (g) Yếu tố nào sau đây không ảnh hưởng đến tốc độ phản ứng? A. Diện tích bề mặt zinc. B. Nồng độ dung dịch sulfuric acid. C. Thể tích dung dịch sulfuric acid. D. Nhiệt độ của dung dịch sulfuric acid. Câu 27. Cho phương trình phản ứng Zn (r) + CuSO4 → ZnSO4 (aq) + Cu (s) ∆H = -210 kJ và các phát biểu sau: (1) Zn bị oxi hóa. (2) Phản ứng trên tỏa nhiệt. (3) Biến thiên enthalpy của phản ứng tạo thành 3,84 gam Cu là +12,6 kJ. (4) Trong quá trình phản ứng, nhiệt độ hỗn hợp tăng lên. Các phát biểu đúng là A. (1) và (3). B. (2) và (4). C. (1) (2) và (4). D.(1) (3) và (4) Câu 28. Cho phản ứng hóa học sau: C (s) + O2 (g) → CO2 (g) Yếu tố nào sau đây không ảnh hưởng đến tốc độ phản ứng trên? A. Nhiệt độ. B. Áp suất O2. C. Hàm lượng carbon. D.Diện tích bề mặt carbon. Phần tự luận (3 điểm) Câu 1. Hàm lượng iron(II) sulfate được xác định qua phản ứng oxi hóa – khử với potassium permanganate: FeSO4 + KMnO4 + H2SO4 → Fe2(SO4)3 + K2SO4 + MnSO4 + H2O a, Lập phương trình hóa học của phản ứng theo phương pháp thăng bằng electron. Chỉ rõ chất oxi hóa, chất khử. b, Thể tích dung dịch KMnO4 0,02M để phản ứng vừa đủ với 20 ml dung dịch FeSO4 0,1M. ………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………… Câu 2. Câu 2. Cho các dung dịch hydrochloric acid, sodium chloride, iodine, kí hiệu ngẫu nhiên là X, Y, Z. Một số kết quả thí nghiệm được ghi lại ở bảng sau.
Tìm kí hiệu tương ứng của các dung dịch ban đầu. …………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………… Câu 3. Cho từ từ đến hết 10 gam dung dịch X gồm NaF 0,84% và NaCl 1,17% vào dung dịch AgNO3 dư, thu được m gam kết tủa. Tính giá trị của m .………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………… -------- Hết -------- Phương pháp giải:
Lời giải chi tiết:
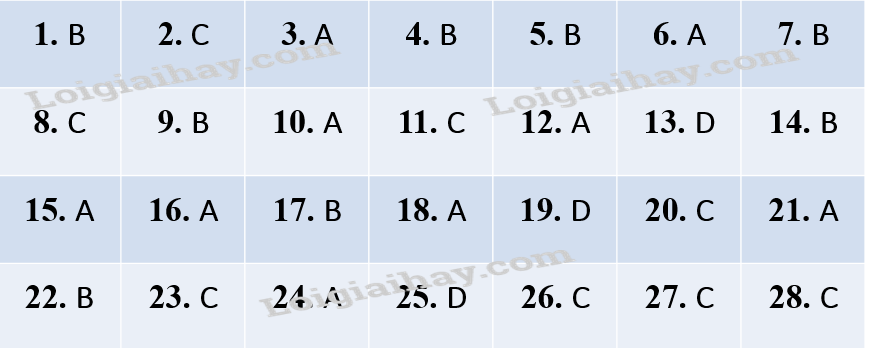
Đáp an· Phần trắc nghiệm (7 điểm) Câu 1. Số oxi hóa là một đại số đặc trưng cho đại lượng nào sau đây của nguyên tử trong phân tử? A. Hóa trị. B. Điện tích. C. Khối lượng. D. Số hiệu. Phương pháp giải: Số oxi hóa là điện tích quy ước của nguyên tử trong phân tử khi coi tất cả các electron liên kết đều chuyển hoàn toàn về nguyên tử có độ âm điện lớn hơn. Lời giải chi tiết: Đáp án B. Câu 2. Chroium có số oxi hóa +2 trong hợp chất nào sau đây? A. Cr(OH)3. B. Na2CrO4. C. CrCl2. D. Cr2O3. Phương pháp giải: Số oxi hóa của Cr trong + Cr(OH)3 là +3. + Na2CrO4 là +6. + CrCl2 là +2. + Cr2O3 là +3. Lời giải chi tiết: Đáp án C. Câu 3. Phản ứng oxi hóa – khử là phản ứng có sự nhường và nhận A. electron. B. neutron. C. proton. D.cation. Phương pháp giải: Phản ứng oxi hóa – khử là phản ứng có sự nhường và nhận electron. Lời giải chi tiết: Đáp án A. Câu 4. Cho 44,5 gam hỗn hợp bột Zn và Mg tác dụng với dung dịch HCl dư thấy có 22,4 lít khí H2 bay ra (đktc). Khối lượng muối tạo ra trong dung dịch là A. 80 gam. B. 115,5 gam. C. 51,6 gam. D. 117,5 gam. Phương pháp giải: \(44,5gam\left\{ \begin{array}{l}Mg\\Zn\end{array} \right. + HCl \to ddX + 1(mol)kh\'i {H_2}\) Bảo toàn H: nHCl = 2nH2 à nHCl = 2 mol BTKL: mFe+Mg + mHCl = mX + mH2 44,5 + 36,5.2 = mX + 2.1 mX = 115,5 (gam) Lời giải chi tiết: Đáp án B. Câu 5. Sản phẩm của phản ứng giữa dung dịch HCl và dung dịch KMnO4 là A. KCl + MnCl2 + H2O. B. Cl2 + MnCl2 +KOH. C. Cl2 + KCl + MnO2. D. Cl2 + MnCl2 + KCl + H2O. Phương pháp giải: KMnO4 + HCl → KCl + MnCl2 + Cl2 + H2O Lời giải chi tiết: Đáp án D. Câu 6. . Fe2O3 là thành phần chính của quặng hematite đỏ, dùng để luyện gang. Số oxi hóa của iron (sắt) trong Fe2O3 là A. +3. B. 3+. C. 3. D.-3. Phương pháp giải: Trong hợp chất, số oxi hóa của O thường là -2. Trong hợp chất, tổng số oxi hóa của các nguyên tử bằng 0. → Số oxi hóa của Fe trong Fe2O3 = +3 Lời giải chi tiết: Đáp án A. Câu 7. Biện pháp kĩ thuật nào dưới đây không được sử dụng để làm tăng tốc độ phản ứng nung vôi? A. Đập nhỏ đá vôi với kích thước khoảng 10 cm. B. Tăng nồng độ khí carbonic. C. Thổi không khí nén vào lò nung vôi. D.Tăng nhiệt độ của phản ứng lên khoảng 900oC. Phương pháp giải: CaCO3 → CaO + CO2 Lời giải chi tiết: Đáp án B. Câu 8. Dung dịch nào sau đây có thể phân biệt được hai dung dịch NaF và NaCl? A. HCl. B. HF. C. AgNO3. D. Br2. Phương pháp giải: Dùng AgNO3: + Không hiện tượng là NaF NaF + AgNO3 → không phản ứng. + Xuất hiện kết tủa màu trắng(AgCl) là NaCl. NaCl + AgNO3 → AgCl (↓) + NaNO3 Lời giải chi tiết: Đáp án C. Câu 9. Trong nhóm halogen, từ fluorine đến iodine, nhiệt độ nóng chảy biến đổi như thế nào? A. Giảm dần. B. Tăng dần. C. Không đổi. D. Tuần hoàn. Phương pháp giải: Nhiệt độ sôi, nhiệt độ nóng chảy của các halogen từ F2 đến I2 tăng dần do: - Tương tác Van der Waals giữa các phân tử tăng. - Khối lượng phân tử tăng. Lời giải chi tiết: Đáp án B. Câu 10. Cho các hợp chất sau: NH3, NH4Cl, HNO3, NO2. Số hợp chất chứa nguyên tử nitrogen có số oxi hóa -3 là A. 1 B. 3 C. 2 D. 4 Phương pháp giải: Xác định số oxi hóa của N trong các hợp chất dựa vào quy tắc xác định số oxi hóa. Số oxi hóa của + NH3 là -3. + NH4Cl là +5. + HNO3 là +5. + NO2 là +4. Lời giải chi tiết: Đáp án A. Câu 11. Dung dịch nào sau đây có thể phân biệt được các ion F-, Cl-, Br-, I- trong dung dịch muối? A. NaOH. B. HCl. C. AgNO3. D. KNO3. Phương pháp giải: Dùng AgNO3: + Xuất hiện kết tủa trắng (AgCl) là Cl-. + Xuất hiện kết tủa vàng nhạt (AgBr) là Br-. + Xuất hiện kết tủa vàng đậm l(AgI) là I-. + Không hiện tượng là F-. Lời giải chi tiết: Đáp án C. Câu 12. Dung dịch HF có khả năng ăn mòn thủy tinh là do xảy ra phản ứng hóa học nào sau đây? A. SiO2 + 4HF → SiF4 + 2H2O. B. NaOH + HF → NaF + H2O. C. H2 + F2 → 2HF. D.2F2 + 2H2O → 4HF + O2. Phương pháp giải: Thành phần của thủy tinh có chứa SiO2 nên xảy ra PTHH: SiO2 + 4HF → SiF4 + 2H2O. Lời giải chi tiết: Đáp án A. Câu 13. Carbon đóng vai trò chất oxi hóa ở phản ứng nào sau đây? A. C + O2 → CO2. B. C + CO2 → 2CO. C. C + H2O → CO + H2. D.C + 2H2 → CH4 Phương pháp giải: \(\)\(\begin{array}{l}\mathop C\limits^0 + 2{\mathop H\limits^0 _2} \to \mathop C\limits^{ - 4} {\mathop H\limits^{ + 1} _4}\\\mathop C\limits^0 + 4e \to \mathop C\limits^{ - 4} \\\mathop {{H_2} \to }\limits^0 2\mathop H\limits^{ + 1} + 2e\end{array}\) → C đóng vai trò là chất oxi hóa. → H2 đóng vai trò là chất khử. Lời giải chi tiết: Đáp án D. Câu 14. KBr thể hiện tính khử khi đun nóng với dung dịch nào sau đây? A. AgNO3. B. H2SO4 đặc. C. HCl. D. H2SO4 loãng. Phương pháp giải: KBr + H2SO4 đặc → K2SO4 + Br2 + SO2 + H2O \(\mathop {2Br}\limits^{ - 1} \to \mathop {B{r_2}}\limits^0 + 2e\) nên KBr thể hiện tính khử. Lời giải chi tiết: Đáp án B Câu 15. Cho phản ứng thủy phân tinh bột có xúc tác là HCl. Phát biểu nào sau đây không đúng? A. HCl không tác dụng với tinh bột trong quá trình phản ứng. B. Nếu nồng độ HCl tăng, tốc độ phản ứng tăng lên. C. Khi không có HCl, phản ứng thủy phân tinh bột vẫn xảy ra nhưng với tốc độ chậm. D.Nồng độ HCl không đổi sau phản ứng. Phương pháp giải: Phản ứng thủy phân tinh bột trong môi trường axit nên HCl có tác dụng với tinh bột. Lời giải chi tiết: Đáp án A. Câu 16. Hydrohalic acid được dùng làm nguyên liệu để sản xuất hợp chất chống dính teflon là A. HF. B. HCl. C. HBr. D. HI. Phương pháp giải: HF được dùng làm nguyên liệu để sản xuất chảo chống dính teflon. Lời giải chi tiết: Đáp án A. Câu 17. . Nhỏ vài giọt dung dịch nào sau đây vào dung dịch AgNO3 thu được kết tủa màu vàng nhạt? A. HCl. B. NaBr. C. NaCl. D. HF. Phương pháp giải: AgNO3 + NaBr → AgBr (↓) + NaNO3 AgBr kết tủa màu vàng nhạt. Lời giải chi tiết: Đáp án B. Câu 18. Halogen phản ứng mãnh liệt với hydrogen ngay cả trong bóng tối là A. F2. B. Cl2. C. Br2. D. I2. Phương pháp giải: F2 phản ứng mãnh liệt với H2 ngay cả trong bóng tối. Lời giải chi tiết: Đáp án A. Câu 19. Nguyên tử sulfur chỉ thể hiện tính khử trong chất nào sau đây? A. S. B. SO2. C. H2SO4. D. H2S. Phương pháp giải: Nguyên tử chỉ thể hiện tính khử khi có số oxi hóa thấp nhất → phải nhường electron. Số oxi hóa của sulfur là -2; 0; +2; +4; +6. → H2S có số oxi hóa -2 chỉ thể hiện tính khử. Lời giải chi tiết: Đáp án D. Câu 20. Yếu tố nào sau đây không ảnh hưởng đến tốc độ phản ứng? A. áp suất. B. diện tích tiếp xúc. C. khối lượng riêng. D.chất xúc tác. Phương pháp giải: - 5 yếu tố ảnh hưởng đến tốc độ phản ứng: 1, Nhiệt độ. 2, Nồng độ. 3, Áp suất. 4, Diện tích tiếp xúc 5, Chất xúc tác. → Khối lượng riêng không ảnh hưởng đến tốc độ phản ứng. Lời giải chi tiết: Đáp án C. Câu 21. Chất xúc tác là A. chất làm thay đổi tốc độ phản ứng, nhưng khối lượng không thay đổi sau khi phản ứng kết thúc. B. chất làm tăng tốc độ phản ứng. C. chất không thay đổi khối lượng trước và sau phản ứng. D. tất cả các trường hợp trên. Phương pháp giải: Chất xúc tác là chất làm thay đổi tốc độ phản ứng, nhưng khối lượng không thay đổi sau khi phản ứng kết thúc. Lời giải chi tiết: Đáp án A. Câu 22. Nung KNO3 lên 550oC xảy ra phản ứng: KNO3 (s) → KNO2 (s) + 1/2O2 (g) ∆H Phản ứng nhiệt phân KNO3 là A. tỏa nhiệt, có ∆H < 0. B. thu nhiệt, có ∆H > 0. C. tỏa nhiệt, ∆H > 0. D. thu nhiệt, có ∆H < 0. Phương pháp giải: Phản ứng nhiệt phân KNO3 chỉ xảy ra ở nhiệt độ cao, khi cung cấp nhiệt vào, đó là phản ứng thu nhiệt, theo quy ước ∆H > 0 Lời giải chi tiết: Đáp án B. Câu 23. Phản ứng nào sau đây là phản ứng tỏa nhiệt? A. Phản ứng nhiệt phân muối KNO3. B. Phản ứng phân hủy khí NH3. C. Phản ứng oxi hóa glucose trong cơ thể. D.Phản ứng hòa tan NH4Cl trong nước. Phương pháp giải: Oxi hóa glucose thành CO2 và H2O, tương tự phản ứng đốt cháy glucose là phản ứng tỏa nhiệt. Lời giải chi tiết: Đáp án C. Câu 24. Đốt cháy hoàn toàn 0,48 gam kim loại M (hóa trị II) bằng khí chlorine, thu được 1,332 gam muối chloride. Kim loại M là A. Ca B. Ba C. Mg D. Cu Phương pháp giải: M + Cl2 →MCl2 BTKL: mM + mCl2 = mMCl2 → mCl2 = 1,332 – 0,48 = 0,852 gam → nCl2 = 0,852/71 = 0,012 mol Ta có: nM = nCl2 = 0,012 mol → MM = 0,48/0,012 = 40 g/mol → M là Ca. Lời giải chi tiết: Đáp án A. Câu 25. Phát biểu nào sau đây không đúng? A. Các phản ứng phân hủy thường là phản ứng thu nhiệt. B. Phản ứng càng tỏa ra nhiều nhiệt càng dễ tự xảy ra. C. Phản ứng oxi hóa chất béo cung cấp nhiệt cho cơ thể. D. Các phản ứng khi đun nóng đều dễ xảy ra hơn. Phương pháp giải: Lời giải chi tiết: Đáp án D. Câu 26. Cho phản ứng hóa học sau: Zn (s) + H2SO4 (aq) → ZnSO4 (aq) + H2 (g) Yếu tố nào sau đây không ảnh hưởng đến tốc độ phản ứng? A. Diện tích bề mặt zinc. B. Nồng độ dung dịch sulfuric acid. C. Thể tích dung dịch sulfuric acid. D. Nhiệt độ của dung dịch sulfuric acid. Phương pháp giải: - 5 yếu tố ảnh hưởng đến tốc độ phản ứng: 1, Nhiệt độ. 2, Nồng độ. 3, Áp suất. 4, Diện tích tiếp xúc 5, Chất xúc tác. → Thể tích không ảnh hưởng đến tốc độ phản ứng. Lời giải chi tiết: Đáp án C. Câu 27. Cho phương trình phản ứng Zn (r) + CuSO4 → ZnSO4 (aq) + Cu (s) ∆H = -210 kJ và các phát biểu sau: (1) Zn bị oxi hóa. (2) Phản ứng trên tỏa nhiệt. (3) Biến thiên enthalpy của phản ứng tạo thành 3,84 gam Cu là +12,6 kJ. (4) Trong quá trình phản ứng, nhiệt độ hỗn hợp tăng lên. Các phát biểu đúng là A. (1) và (3). B. (2) và (4). C. (1) (2) và (4). D.(1) (3) và (4) Phương pháp giải: (1) \(\mathop {Zn}\limits^0 \to \mathop {Zn}\limits^{ + 2} + 2e\) à Zn bị oxi hóa. à (1) đúng. (2) ∆H = -210 kJ < 0 à Phản ứng tỏa nhiệt (3) Biến thiên enthalpy của phản ứng tạo thành 1 mol Cu ~ 64 gam Cu là ∆H = -210 kJ à Biến thiên enthalpy của phản ứng tạo thành 3,84 g Cu là: −210.3,8464=−12,6(kJ)−210.3,8464=−12,6(kJ/mol) à (3) sai. (4) Phản ứng tỏa nhiệt à Trong quá trình phản ứng, nhiệt độ tăng lên. à (4) đúng. Lời giải chi tiết: Đáp án C. Câu 28. Cho phản ứng hóa học sau: C (s) + O2 (g) → CO2 (g) Yếu tố nào sau đây không ảnh hưởng đến tốc độ phản ứng trên? A. Nhiệt độ. B. Áp suất O2. C. Hàm lượng carbon. D.Diện tích bề mặt carbon. Phương pháp giải: - 5 yếu tố ảnh hưởng đến tốc độ phản ứng: 1, Nhiệt độ. 2, Nồng độ. 3, Áp suất. 4, Diện tích tiếp xúc 5, Chất xúc tác. → Hàm lượng carbon không ảnh hưởng đến tốc độ phản ứng. Lời giải chi tiết: Đáp án C. Phần tự luận (3 điểm) Câu 1. Hàm lượng iron(II) sulfate được xác định qua phản ứng oxi hóa – khử với potassium permanganate: FeSO4 + KMnO4 + H2SO4 → Fe2(SO4)3 + K2SO4 + MnSO4 + H2O a, Lập phương trình hóa học của phản ứng theo phương pháp thăng bằng electron. Chỉ rõ chất oxi hóa, chất khử. b, Thể tích dung dịch KMnO4 0,02M để phản ứng vừa đủ với 20 ml dung dịch FeSO4 0,1M. Hướng dẫn giải: a, Sử dụng phương pháp thăng bằng electron để cân bằng PTHH. Chất oxi hóa là chất nhận electron. Chất khử là chất nhường electron. b, Tính theo PTHH. Lời giải chi tiết: a, PTHH: \(10\mathop {Fe}\limits^{ + 2} S{O_4} + {\rm{ 2}}\mathop {KMn}\limits^{ + 7} {O_4} + {\rm{ 8}}{H_2}S{O_4} \to {\rm{ 5}}{\mathop {Fe}\limits^{ + 3} _2}{\left( {S{O_4}} \right)_3} + {\rm{ }}{K_2}S{O_4} + {\rm{ }}\mathop {2Mn}\limits^{ + 2} S{O_4} + {\rm{ 8}}{H_2}O\). \(\begin{array}{l}\mathop {2Fe}\limits^{ + 2} \to \mathop {2Fe}\limits^{ + 3} + 2e\\\mathop {Mn}\limits^{ + 7} + 5e \to \mathop {Mn}\limits^{ + 2} \end{array}\) FeSO4 là chất khử. KMnO4 là chất oxi hóa. b, nFeSO4 = 0,002 mol \(10\mathop {Fe}\limits^{ + 2} S{O_4} + {\rm{ 2}}\mathop {KMn}\limits^{ + 7} {O_4} + {\rm{ 8}}{H_2}S{O_4} \to {\rm{ 5}}{\mathop {Fe}\limits^{ + 3} _2}{\left( {S{O_4}} \right)_3} + {\rm{ }}{K_2}S{O_4} + {\rm{ }}\mathop {2Mn}\limits^{ + 2} S{O_4} + {\rm{ 8}}{H_2}O\) 0,002 → 0,0004 CM = n/V → V = n/CM = 0,0004/0,02 = 0,02 lít = 20ml. Câu 2. Cho các dung dịch hydrochloric acid, sodium chloride, iodine, kí hiệu ngẫu nhiên là X, Y, Z. Một số kết quả thí nghiệm được ghi lại ở bảng sau.
Tìm kí hiệu tương ứng của các dung dịch ban đầu. Phương pháp giải: Dựa vào hiện tượng của X và Y với các thuốc thử để xác định. Lời giải chi tiết: X có xuất hiện màu xanh tím với hồ tinh bột → X là iodine. Y có phản ứng với NaHCO3 sinh ra bọt khí → Y có H+ → Y là hydrochloric acid. Còn lại, Z là sodium chloride. Câu 3. Cho từ từ đến hết 10 gam dung dịch X gồm NaF 0,84% và NaCl 1,17% vào dung dịch AgNO3 dư, thu được m gam kết tủa. Tính giá trị của m Phương pháp giải: - Tính số mol NaF và NaCl. - Viết PTHH hoặc dùng bảo toàn nguyên tố để tính kết tủa. Lời giải chi tiết: PTHH: NaF + AgNO3 → không phản ứng NaCl + AgNO3 → AgCl + NaNO3 0,2 mol → 0,2 mol nNaF = 0,2 mol nNaCl = 0,2 mol → nAgCl = 0,2 mol → mAgCl = 0,2 . 143,5 = 28,7 gam Phương pháp giải:
Lời giải chi tiết:
|




















Danh sách bình luận