Đề thi học kì 1 Hóa 10 Chân trời sáng tạo - Đề số 5Nguyên tử chứa những hạt mang điện làĐề bài
Câu 1 :
Nguyên tử chứa những hạt mang điện là
Câu 2 :
Trường hợp nào sau đây có sự tương ứng giữa hạt cơ bản với khối lượng và điện tích của chúng?
Câu 3 :
Mệnh đề nào sau đây không đúng?
Câu 4 :
Cation X2+ (ion dương) có cấu hình electron ở lớp vỏ ngoài cùng 2p6. Cấu hình electron của nguyên tử X là:
Câu 5 :
Trong một nhóm A theo chiều tăng của điện tích hạt nhân
Câu 6 :
Nhóm các nguyên tử nào dưới đây thuộc cùng một nguyên tố hóa học ?
Câu 7 :
Dãy nào sau đây sắp xếp theo thứ tự tăng dần tính acid ?
Câu 8 :
Sự chuyển động của electron theo quan điểm hiện đại được mô tả
Câu 9 :
Nguyên tố R có Z = 16, hợp chất khí của nó với hydrogen có công thức hóa học dạng:
Câu 10 :
Mỗi orbital nguyên tử chứa tối đa
Câu 11 :
Sự phân bố electron theo ô orbital nào dưới đây là đúng?
Câu 12 :
Hợp chất nào dưới đây chỉ có liên kết cộng hóa trị trong phân tử?
Câu 13 :
Trong phân tử nitrogen, các nguyên tử liên kết với nhau bằng liên kết:
Câu 14 :
Theo qui tắc octet thì công thức cấu tạo của phân tử SO2 là:
Câu 15 :
Cho giá trị độ âm điện của các nguyên tố: F (3,98); O (3,44); C (2,55); H(2,20); Na(0,93); Hợp chất nào sau đây là hợp chất ion:
Câu 16 :
Công thức Lewis của CS2 là
Câu 17 :
Số electron tối đa trên các phân lớp s, p, d, f lần lượt là:
Câu 18 :
Một ion M3+ có tổng số hạt proton, neutron, electron là 73, biết trong ion M3+ có số hạt mang điện nhiều hơn số hạt không mang điện là 17. Vị trí của M trong bảng tuần hoàn hóa học là
Câu 19 :
Khẳng định nào sau đây là đúng khi so sánh kích thước của hạt nhân so với kích thước của nguyên tử?
Câu 20 :
Cho các nguyên tử sau: \({}_{{\rm{13}}}^{{\rm{26}}}{\rm{X}}\), \({}_{{\rm{12}}}^{{\rm{26}}}{\rm{Y}}\), \({}_{{\rm{13}}}^{{\rm{27}}}{\rm{Z}}\), \({}_{{\rm{13}}}^{{\rm{28}}}{\rm{T}}\). Phát biểu đúng là:
Câu 21 :
Trong nguyên tử X có 92 proton, 92 electron, 143 neutron. Kí hiệu hạt nhân nguyên tử X là:
Câu 22 :
Copper có hai đồng vị \({}_{29}^{63}Cu\) (Chiếm 73%) và \({}_{29}^{65}Cu\) (Chiếm 27%). Nguyên tử khối trung bình của Copper là:
Câu 23 :
Nếu orbital chứa 2 electron (hai mũi tên ngược chiều nhau) thì electron đó gọi là
Câu 24 :
Liên kết hydrogen là
Câu 25 :
Lớp M (n=3) có số electron tối đa là
Lời giải và đáp án
Câu 1 :
Nguyên tử chứa những hạt mang điện là
Đáp án : A Phương pháp giải :
Dựa vào kiến thức về thành phần cấu tạo nguyên tử Lời giải chi tiết :
Nguyên tử chứa hạt proton mang điện tích dương, hạt electron mang điện tích âm Đáp án A
Câu 2 :
Trường hợp nào sau đây có sự tương ứng giữa hạt cơ bản với khối lượng và điện tích của chúng?
Đáp án : A Phương pháp giải :
Dựa vào khối lượng và điện tích của các hạt cấu tạo nên nguyên tử Lời giải chi tiết :
Neutron, m \( \approx \) 1 amu, q = 0. Proton, m \( \approx \) 1 amu, q = +1. Electron, m \( \approx \) 0,00055 amu, q = -1. Đáp án A
Câu 3 :
Mệnh đề nào sau đây không đúng?
Đáp án : D Phương pháp giải :
Dựa vào nguyên tắc sắp xếp các nguyên tố trong bảng tuần hoàn Lời giải chi tiết :
Các nguyên tố được sắp xếp theo chiều tăng dần của điện tích hạt nhân Đáp án D
Câu 4 :
Cation X2+ (ion dương) có cấu hình electron ở lớp vỏ ngoài cùng 2p6. Cấu hình electron của nguyên tử X là:
Đáp án : B Phương pháp giải :
Các nguyên tử có xu hướng cho hoặc nhận electron để đạt cấu hình electron của khí hiếm Lời giải chi tiết :
Cation X2+ (ion dương) có cấu hình electron ở lớp vỏ ngoài cùng 2p6 vì X2+ đã nhường đi 2 electron nên cấu hình lớp vỏ của X là 3s2 Đáp án B
Câu 5 :
Trong một nhóm A theo chiều tăng của điện tích hạt nhân
Đáp án : B Phương pháp giải :
Dựa vào xu hướng biến đổi của các nguyên tố và hợp chất trong bảng tuần hoàn Lời giải chi tiết :
Trong một nhóm A, theo chiều tăng của điện tích hạt nhân tính kim loại giảm dần nên tính base của các oxide giảm dần, ngược lại tính phi kim tăng dần nên tính acid của các oxide tăng dần Đáp án B
Câu 6 :
Nhóm các nguyên tử nào dưới đây thuộc cùng một nguyên tố hóa học ?
Đáp án : A Phương pháp giải :
Các nguyên tử của cùng một nguyên tố có cùng số proton Lời giải chi tiết :
\({}_8^{16}M\); \({}_8^{17}Z\) có cùng số proton => thuộc cùng một nguyên tố hóa học Đáp án A
Câu 7 :
Dãy nào sau đây sắp xếp theo thứ tự tăng dần tính acid ?
Đáp án : B Phương pháp giải :
Trong cùng một chu kì, tính acid tăng dần Lời giải chi tiết :
Al2O3; P2O5; SO3; Cl2O7 tăng dần tính acid Đáp án B
Câu 8 :
Sự chuyển động của electron theo quan điểm hiện đại được mô tả
Đáp án : A Phương pháp giải :
Dựa vào sự chuyển động của electron theo quan điểm hiện đại Lời giải chi tiết :
Theo quan điểm hiện đại electron chuyển động rất nhanh xung quanh hạt nhân không theo một quỹ đạo xác định tạo thành vỏ nguyên tử Đáp án A
Câu 9 :
Nguyên tố R có Z = 16, hợp chất khí của nó với hydrogen có công thức hóa học dạng:
Đáp án : B Phương pháp giải :
Xác định nguyên tố R trong bảng tuần hoàn Lời giải chi tiết :
Nguyên tố R có Z = 16 => R là sulfur thuộc chu kì 3 nhòm VIA nên hóa trị với oxygen là 6 và hydrogen là 2 Đáp án B
Câu 10 :
Mỗi orbital nguyên tử chứa tối đa
Đáp án : A Lời giải chi tiết :
Mỗi orbital nguyên tử chứa tối đa 2 electron Đáp án A
Câu 11 :
Sự phân bố electron theo ô orbital nào dưới đây là đúng?
Đáp án : B Phương pháp giải :
Dựa vào sự phân bố electron theo ô orbital theo thuyết Pauli Lời giải chi tiết :
Đáp án B
Câu 12 :
Hợp chất nào dưới đây chỉ có liên kết cộng hóa trị trong phân tử?
Đáp án : B Phương pháp giải :
Dựa vào phân loại của liên kết hóa học Lời giải chi tiết :
Liên kết hóa trị thường là liên kết giữa các phi kim HClO chứa liên kết cộng hóa trị trong phân tử Đáp án B
Câu 13 :
Trong phân tử nitrogen, các nguyên tử liên kết với nhau bằng liên kết:
Đáp án : A Phương pháp giải :
Dựa vào phân loại của liên kết hóa học Lời giải chi tiết :
Liên kết hóa trị thường là liên kết giữa các phi kim N2 chứa liên kết cộng hóa trị trong phân tử Đáp án A
Câu 14 :
Theo qui tắc octet thì công thức cấu tạo của phân tử SO2 là:
Đáp án : B Phương pháp giải :
Dựa vào quy tắc octet Lời giải chi tiết :
SO2 có công thức cấu tạo: O = S → O. Đáp án B
Câu 15 :
Cho giá trị độ âm điện của các nguyên tố: F (3,98); O (3,44); C (2,55); H(2,20); Na(0,93); Hợp chất nào sau đây là hợp chất ion:
Đáp án : A Phương pháp giải :
Liên kết ion có hiệu độ âm điện \( \ge 1,7\) Lời giải chi tiết :
NaF có hiệu độ âm điện = 3,05 > 1,7 => chứa liên kết ion Đáp án A
Câu 16 :
Công thức Lewis của CS2 là
Đáp án : B Phương pháp giải :
Công thức Lewis biểu thị các liên kết của các nguyên tử và electron chưa liên kết của các nguyên tử Lời giải chi tiết :
Đáp án B
Câu 17 :
Số electron tối đa trên các phân lớp s, p, d, f lần lượt là:
Đáp án : C Phương pháp giải :
Dựa vào số electron trong các phân lớp Lời giải chi tiết :
Số electron tối đa trên phân lớp s, p, d, f lần lượt là: 2, 6, 10, 14 Đáp án C
Câu 18 :
Một ion M3+ có tổng số hạt proton, neutron, electron là 73, biết trong ion M3+ có số hạt mang điện nhiều hơn số hạt không mang điện là 17. Vị trí của M trong bảng tuần hoàn hóa học là
Đáp án : B Lời giải chi tiết :
2Z + N = 73 + 3 và 2Z – N = 17 + 3 => Z = 24; N = 28 Cấu hình electron M: 1s2 2s2 2p6 3s2 3p6 3d5 4s1 => chu kì 4, nhóm VIB Đáp án B
Câu 19 :
Khẳng định nào sau đây là đúng khi so sánh kích thước của hạt nhân so với kích thước của nguyên tử?
Đáp án : C Lời giải chi tiết :
Kích thước của hạt nhân gần bằng kích thước của nguyên tử vì khối lượng electron rất nhỏ xấp xỉ bằng 0 Đáp án C
Câu 20 :
Cho các nguyên tử sau: \({}_{{\rm{13}}}^{{\rm{26}}}{\rm{X}}\), \({}_{{\rm{12}}}^{{\rm{26}}}{\rm{Y}}\), \({}_{{\rm{13}}}^{{\rm{27}}}{\rm{Z}}\), \({}_{{\rm{13}}}^{{\rm{28}}}{\rm{T}}\). Phát biểu đúng là:
Đáp án : A Phương pháp giải :
Đồng vị là tập hợp các nguyên tử có cùng số proton Lời giải chi tiết :
X, Z, T có cùng số proton Đáp án A
Câu 21 :
Trong nguyên tử X có 92 proton, 92 electron, 143 neutron. Kí hiệu hạt nhân nguyên tử X là:
Đáp án : A Phương pháp giải :
Dựa vào kí hiệu của nguyên tố: \({}_Z^AX\) Lời giải chi tiết :
Số khối A = P + N = 92 + 143 = 235 Đáp án A
Câu 22 :
Copper có hai đồng vị \({}_{29}^{63}Cu\) (Chiếm 73%) và \({}_{29}^{65}Cu\) (Chiếm 27%). Nguyên tử khối trung bình của Copper là:
Đáp án : A Phương pháp giải :
Dựa vào công thức tính nguyên tử khối trung bình Lời giải chi tiết :
\(\bar M\)= 63.73% + 65.27% = 63,54amu Đáp án A
Câu 23 :
Nếu orbital chứa 2 electron (hai mũi tên ngược chiều nhau) thì electron đó gọi là
Đáp án : A Lời giải chi tiết :
2 electron trong orbital được gọi là electron ghép đôi Đáp án A
Câu 24 :
Liên kết hydrogen là
Đáp án : D Phương pháp giải :
Dựa vào khái niệm của liên kết hydrogen Lời giải chi tiết :
Liên kết hydrogen là liên kết được hình thành giữa nguyên tử H (đã liên kết với một nguyên tử có độ âm điện lớn) với một nguyên tử khác (có độ âm điện lớn) còn cặp electron riêng. Đáp án D
Câu 25 :
Lớp M (n=3) có số electron tối đa là
Đáp án : A Phương pháp giải :
Dựa vào số electron trong các lớp Lời giải chi tiết :
Lớp M có tối đa 18 electron Đáp án A
|














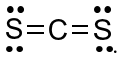







Danh sách bình luận