Đề thi giữa kì 2 Hóa 10 - Chân trời sáng tạo - Đề số 6Dấu hiệu để nhận ra một phản ứng oxi hóa – khử là dựa trên sự thay đổi đại lượng nào sau đây củaĐề bài
Câu 1 :
Dấu hiệu để nhận ra một phản ứng oxi hóa – khử là dựa trên sự thay đổi đại lượng nào sau đây của nguyên tử?
Câu 2 :
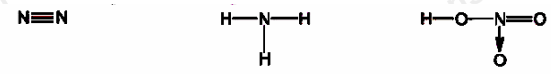
Cho các phân tử có công thức cấu tạo sau:
Số oxi hóa của nguyên tử N trong các phân tử lần lượt từ trái qua phải là
Câu 3 :
Cho phản ứng hóa học sau đây:
Câu 4 :
Trong phản ứng: 2NO2 + 2NaOH \( \to \)NaNO3 + NaNO2 + H2O. Vai trò của NO2 là
Câu 5 :
Cho phản ứng hóa học: Fe + CuSO4 \( \to \) FeSO4 + Cu. Trong phản ứng xảy ra
Câu 6 :
Cho sơ đồ phản ứng oxi hóa – khử: Cu + HNO3 \( \to \) Cu(NO3)2 + NO + H2O. Tỉ lệ mol giữa chất khử và chất oxi hóa là:
Câu 7 :
Phản ứng nào sau đây không phải là phản ứng oxi hóa – khử?
Câu 8 :
Hòa tan 9,6 gam magnesium trong dung dịch HNO3 thu được dung dịch muối và 2,479 lít (đkc) khí X (sản phẩm khử duy nhất). Khí X là
Câu 9 :
Cho 8,6765 lít (đkc) hỗn hợp khí O2 và Cl2 tác dụng vừa đủ với hỗn hợp chứa 0,2 mol Mg và 0,2 mol Al thu được m gam hỗn hợp muối chloride và oxide. Giá trị của m là
Câu 10 :
Phản ứng nào sau đây là phản ứng tỏa nhiệt?
Câu 11 :
Phương trình nhiệt hóa học: 3H2(g) + N2(g) \( \to \) 2NH3(g) \({\Delta _r}H_{298}^o = - 91,80kJ\) Lượng nhiệt tỏa ra khi dùng 9 gam H2(g) để tạo thành NH3(g) là
Câu 12 :
Phát biểu nào sau đây đúng?
Câu 13 :
Phương trình hóa học nào dưới đây biểu thị enthalpy tạo thành chuẩn của CO(g)?
Câu 15 :
Cho các phản ứng dưới đây: (1) CO(g) + ½ O2(g) \( \to \) CO2(g) \({\Delta _r}H_{298}^o = - 283kJ\) (2) C(s) + H2O(g) \( \to \)CO(g) + H2(g) \({\Delta _r}H_{298}^o = 131,25kJ\) (3) H2(g) + F2(g) \( \to \) 2HF(g) \({\Delta _r}H_{298}^o = - 546kJ\) (4) H2(g) + Cl2(g) \( \to \) 2HCl(g) \({\Delta _r}H_{298}^o = - 184,62kJ\) Phản ứng xảy ra thuận lợi nhất là
Câu 16 :
Cho biến thiên enthalpy của phản ứng sau ở điều kiện chuẩn 4FeS2(s) + 11O2(g) \( \to \) 2Fe2O3(s) + 8SO2(g) Cho nhiệt tạo thành của các chất trong bảng sau: Cho các mệnh đều sau: a) \({\Delta _f}H_{298}^o({O_2},g) = 0kJ\) b) \({\Delta _f}H_{298}^o(sp) = - 4025,4kJ\) c) \({\Delta _f}H_{298}^o(c{\rm{d}}) = - 711,6kJ\) d) Đây là phản ứng tỏa nhiệt Số mệnh đề đúng là
Câu 17 :
Cho các đơn chất sau đây: C(graphite,s), Br2(g), Na(s), Na(g), Hg(l), Hg(s). Số đơn chất có \({\Delta _f}H_{298}^o = 0kJ\)là
Câu 18 :
Tiến hành quá trình ozone hóa 100gam oxygen theo phản ứng sau: 3O2(g) \( \to \)2O3(g) Hỗn hợp thu được có chứa 24% ozone về khối lượng, tiêu tốn 71,2 kJ. Nhiệt tạo thành \({\Delta _f}H_{298}^o\)của ozone (kJ/mol) có giá trị là
Câu 19 :
Cho 2 phương trình nhiệt hóa học sau: 0,5H2(g) + 0,5I2(g) \( \to \) HI(g) (1) \({\Delta _r}H_{298}^o(1) = 25,9kJ\) HI(g) \( \to \) 0,5H2 + 0,5I2 (2) Biến thiên enthalpy của phản ứng (2) là
Câu 20 :
Thành phần chính của đa số các loại đá dùng trong xây dựng là CaCO3, chúng vừa có tác dụng chịu nhiệt, vừa chịu được lực. Cho phản ứng sau: Biết \({\Delta _f}H_{298}^o\)(CaCO3(s) = -1206,09 (kJ/mol); \({\Delta _f}H_{298}^o\)(CaO(s)) = -635,10 (kJ/mol); \({\Delta _f}H_{298}^o\)(CO2,g) = -393,50 (kJ/mol). Giá trị \({\Delta _r}H_{298}^o\)của phản ứng tính theo kJ là
Lời giải và đáp án
Câu 1 :
Dấu hiệu để nhận ra một phản ứng oxi hóa – khử là dựa trên sự thay đổi đại lượng nào sau đây của nguyên tử?
Đáp án : B Phương pháp giải :
Dựa vào lý thuyết về phản ứng oxi hóa – khử Lời giải chi tiết :
Dấu hiệu để nhận ra một phản ứng oxi hóa – khử là dựa trên sự thay đổi số oxi hóa của nguyên tử Đáp án B
Câu 2 :
Cho các phân tử có công thức cấu tạo sau:
Số oxi hóa của nguyên tử N trong các phân tử lần lượt từ trái qua phải là
Đáp án : D Phương pháp giải :
Cách xác định số oxi hóa Lời giải chi tiết :
Số oxi hóa của nguyên tử N trong các phân tử trên lần lượt từ trái qua phải là 0, -3, +5
Câu 3 :
Cho phản ứng hóa học sau đây:
Đáp án : B Phương pháp giải :
Khái niệm chất khử, chất oxi hóa, sự khử, sự oxi hóa: - Chất khử (bị oxi hóa) là chất cho electron ⟹ số oxi hóa tăng. - Chất oxi hóa (bị khử) là chất nhận eletron ⟹ số oxi hóa giảm. - Sự khử (quá trình khử) là quá trình nhận electron. - Sự oxi hóa (quá trình oxi hóa) là quá trình cho electron. Lời giải chi tiết :
Sự oxi hóa: Co \( \to \)C+4 + 4e => C là chất khử Sự khử: \(\mathop {{O_2}}\limits^o + 4{\rm{e}} \to 2\mathop O\limits^{ - 2} \) => O2 là chất oxi hóa Đáp án B
Câu 4 :
Trong phản ứng: 2NO2 + 2NaOH \( \to \)NaNO3 + NaNO2 + H2O. Vai trò của NO2 là
Đáp án : B Phương pháp giải :
Dựa vào sự thay đổi số oxi hóa của N để xác định vai trò NO2 trong phản ứng Lời giải chi tiết :
\(2\mathop N\limits^{ + 4} {O_2} + 2NaOH \to Na\mathop N\limits^{ + 5} {O_3} + Na\mathop N\limits^{ + 3} {O_2} + {H_2}{\rm{O}}\) Ta thấy N trong NO2 vừa tăng lên +5 trong NaNO3, vừa giảm xuống +3 trong NaNO2 => NO2 vừa đóng vai trò chất khử, vừa đóng vai trò chất oxi hóa Đáp án B
Câu 5 :
Cho phản ứng hóa học: Fe + CuSO4 \( \to \) FeSO4 + Cu. Trong phản ứng xảy ra
Đáp án : C Phương pháp giải :
Xác định số oxi hóa của các chất => chất khử, chất oxi hóa (sự oxi hóa, sự khử) Lời giải chi tiết :
\(\mathop {Fe}\limits^o + \mathop {Cu}\limits^{ + 2} S{O_4} \to \mathop {Fe}\limits^{ + 2} S{O_4} + \mathop {Cu}\limits^o \) Fe là chất khử và CuSO4 là chất oxi hóa Vậy trong phản ứng xảy ra sự oxi hóa Fe và sự khử Cu2+ Đáp án C
Câu 6 :
Cho sơ đồ phản ứng oxi hóa – khử: Cu + HNO3 \( \to \) Cu(NO3)2 + NO + H2O. Tỉ lệ mol giữa chất khử và chất oxi hóa là:
Đáp án : C Phương pháp giải :
- Dựa vào sự thay đổi số oxi hóa ⟹ Xác định chất khử (số oxi hóa của nguyên tố tăng sau phản ứng) và chất oxi hóa (số oxi hóa của nguyên tố giảm sau phản ứng). - Cân bằng phương trình theo phương pháp thăng bằng electron. Lời giải chi tiết :
Chất khử: \(C{u^o} \to C{u^{ + 2}} + 2{\rm{e}}|x3\) Chất oxi hóa: \({N^{ + 5}} + 3e \to {N^{ + 2}}|x2\) PTHH: 3Cu + 8HNO3 \( \to \)3Cu(NO3)2 + 2NO + 4H2O => Tỉ lệ số mol giữa chất khử và chất oxi hóa là: n Cu : n HNO3 = 3: 8 Đáp án C
Câu 7 :
Phản ứng nào sau đây không phải là phản ứng oxi hóa – khử?
Đáp án : A Phương pháp giải :
Phản ứng oxi hóa - khử là phản ứng hóa học có sự thay đổi số oxi hóa của các nguyên tố. Lời giải chi tiết :
Phản ứng 6HNO3 + Fe2O3 → 2Fe(NO3)3 + 3H2O không phải là phản ứng oxi hóa - khử do không có sự thay đổi số oxi hóa của các nguyên tố. Đáp án A
Câu 8 :
Hòa tan 9,6 gam magnesium trong dung dịch HNO3 thu được dung dịch muối và 2,479 lít (đkc) khí X (sản phẩm khử duy nhất). Khí X là
Đáp án : B Phương pháp giải :
Giả sử 1 mol khí trao đổi n mol electron. Áp dụng bảo toàn e: 2nMg = n.nkhí ⟹ giá trị của n + Nếu n = 1 ⟹ NO2. + Nếu n = 3 ⟹ NO. + Nếu n = 8 ⟹ N2O. + Nếu n = 10 ⟹ N2. Lời giải chi tiết :
nMg = 9,6/24 = 0,4 mol và nkhí = 0,1 mol Áp dụng bảo toàn e: 2nMg = n.nkhí ⇔ 2.0,4 = n.0,1 ⇔ n = 8 ⟹ Khí X là N2O. Đáp án B
Câu 9 :
Cho 8,6765 lít (đkc) hỗn hợp khí O2 và Cl2 tác dụng vừa đủ với hỗn hợp chứa 0,2 mol Mg và 0,2 mol Al thu được m gam hỗn hợp muối chloride và oxide. Giá trị của m là
Đáp án : D Phương pháp giải :
- Đặt nCl2 = x mol; nO2 = y mol. - Lập hệ phương trình: +) Tổng số mol hỗn hợp khí +) Bảo toàn electron Giải tìm được x, y. - Áp dụng BTKL → m = mKL + mkhí Lời giải chi tiết :
Đặt n Cl2 = x mol; n O2 = y mmol n X = 0,35 mol => x + y = 0,35 (1) Các quá trình nhường – nhận e: Mg \( \to \) Mg+2 + 2e Cl2 + 2e \( \to \) 2Cl-1 Al \( \to \) Al+3 + 3e O2 + 4e \( \to \)2O-2 Bảo toàn electron => 2 n Mg + 3 nAl = 2n Cl2 + 4n O2 => 2x + 4y = 2.0,2 + 3.0,2 = 1 (2) Từ (1) và (2) => x = 0,2; y = 0,15 => m = m KL + m khí = (0,2.24 + 0,2.27) + (0,2.71 + 0,15.32) = 29,2 Đáp án D
Câu 10 :
Phản ứng nào sau đây là phản ứng tỏa nhiệt?
Đáp án : B Phương pháp giải :
Phản ứng tỏa nhiệt là phản ứng giải phóng năng lượng dưới dạng nhiệt ra môi trường. Phản ứng thu nhiệt là phản ứng hấp thụ năng lượng dưới dạng nhiệt từ môi trường. Lời giải chi tiết :
Oxi hóa glucose thành CO2 và H2O tương tự phản ứng đốt cháy glucose ⟹ Phản ứng là phản ứng tỏa nhiệt là phản ứng oxi hóa glucose trong cơ thể.
Câu 11 :
Phương trình nhiệt hóa học: 3H2(g) + N2(g) \( \to \) 2NH3(g) \({\Delta _r}H_{298}^o = - 91,80kJ\) Lượng nhiệt tỏa ra khi dùng 9 gam H2(g) để tạo thành NH3(g) là
Đáp án : B Phương pháp giải :
Dựa vào lý thuyết về enthalpy. Lời giải chi tiết :
nH2 = 9:2 = 4,5 (mol) 3 mol H2 ⟶ 2NH3 ⟶ ∆rH 0 298 = -91,80 kJ ⟹ 4,5 mol H2 ⟶ Lượng nhiệt tỏa ra là: 4,5.(-91,80):3 = -137,70 kJ
Câu 12 :
Phát biểu nào sau đây đúng?
Đáp án : A Phương pháp giải :
Dựa vào quy ước về điều kiện chuẩn. Lời giải chi tiết :
A đúng. B, C, D sai.
Câu 13 :
Phương trình hóa học nào dưới đây biểu thị enthalpy tạo thành chuẩn của CO(g)?
Đáp án : C Phương pháp giải :
Dựa vào lý thuyết về enthalpy. Lời giải chi tiết :
Phương trình hóa học biểu thị enthalpy tạo thành chuẩn của CO (g) là: C (than chì) + ½ O2 (g) ⟶ CO (g)
Đáp án : B Phương pháp giải :
Dựa vào lý thuyết về năng lượng hóa học Lời giải chi tiết :
Vì \({\Delta _r}H_{298}^o = 9,0kJ\)> 0 => phản ứng thu nhiệt Đáp án B
Câu 15 :
Cho các phản ứng dưới đây: (1) CO(g) + ½ O2(g) \( \to \) CO2(g) \({\Delta _r}H_{298}^o = - 283kJ\) (2) C(s) + H2O(g) \( \to \)CO(g) + H2(g) \({\Delta _r}H_{298}^o = 131,25kJ\) (3) H2(g) + F2(g) \( \to \) 2HF(g) \({\Delta _r}H_{298}^o = - 546kJ\) (4) H2(g) + Cl2(g) \( \to \) 2HCl(g) \({\Delta _r}H_{298}^o = - 184,62kJ\) Phản ứng xảy ra thuận lợi nhất là
Đáp án : C Phương pháp giải :
Dựa vào lý thuyết về năng lượng hoá học. Lời giải chi tiết :
Phản ứng xảy ra thuận lợi nhất là phản ứng (3). Đáp án C
Câu 16 :
Cho biến thiên enthalpy của phản ứng sau ở điều kiện chuẩn 4FeS2(s) + 11O2(g) \( \to \) 2Fe2O3(s) + 8SO2(g) Cho nhiệt tạo thành của các chất trong bảng sau: Cho các mệnh đều sau: a) \({\Delta _f}H_{298}^o({O_2},g) = 0kJ\) b) \({\Delta _f}H_{298}^o(sp) = - 4025,4kJ\) c) \({\Delta _f}H_{298}^o(c{\rm{d}}) = - 711,6kJ\) d) Đây là phản ứng tỏa nhiệt Số mệnh đề đúng là
Đáp án : B Phương pháp giải :
Dựa vào lý thuyết về năng lượng hóa học Lời giải chi tiết :
a), b), c), d) đúng. \(\begin{array}{l}{\Delta _r}H_{298}^o = 2.{\Delta _f}H_{298}^o(F{e_2}{O_3},s) + 8.{\Delta _f}H_{298}^o(S{O_2},g) - 11.{\Delta _f}H_{298}^o({O_2},g) - 4.{\Delta _f}H_{298}^o(Fe{S_2},s)\\ = 2.( - 825,5) + 8.( - 296,8) - 11.0 - 4.( - 1779) = - 3313,8kJ/mol < 0\end{array}\) => Phản ứng tỏa nhiệt Đáp án B
Câu 17 :
Cho các đơn chất sau đây: C(graphite,s), Br2(g), Na(s), Na(g), Hg(l), Hg(s). Số đơn chất có \({\Delta _f}H_{298}^o = 0kJ\)là
Đáp án : C Phương pháp giải :
Đơn chất bền có \({\Delta _f}H_{298}^o = 0kJ\) Lời giải chi tiết :
Các đơn chất C(graphite,s) Br2(l), Na(s), Hg(l) bền đều có \({\Delta _f}H_{298}^o = 0kJ\) Đáp án C
Câu 18 :
Tiến hành quá trình ozone hóa 100gam oxygen theo phản ứng sau: 3O2(g) \( \to \)2O3(g) Hỗn hợp thu được có chứa 24% ozone về khối lượng, tiêu tốn 71,2 kJ. Nhiệt tạo thành \({\Delta _f}H_{298}^o\)của ozone (kJ/mol) có giá trị là
Đáp án : A Phương pháp giải :
Dựa vào lý thuyết enthalpy Lời giải chi tiết :
n O3 = 0,24.100:48 = 0,5 mol 0,5 mol O3 tiêu tốn 71,2 kJ năng lượng => 2 mol O3 tiêu tốn 71,2 : 0,5.2 = 284,8 KJ => \({\Delta _r}H_{298}^o\)=284,8 kJ => \({\Delta _r}H_{298}^o\)= 2. \({\Delta _f}H_{298}^o({O_3},g) - 3.\Delta fH_{298}^o({O_2},g) = 2.284,8 - 3,0 = 142,4kJ/mol\) Đáp án A
Câu 19 :
Cho 2 phương trình nhiệt hóa học sau: 0,5H2(g) + 0,5I2(g) \( \to \) HI(g) (1) \({\Delta _r}H_{298}^o(1) = 25,9kJ\) HI(g) \( \to \) 0,5H2 + 0,5I2 (2) Biến thiên enthalpy của phản ứng (2) là
Đáp án : D Phương pháp giải :
Dựa vào lý thuyết về biến thiên enthalpy của phản ứng hóa học Lời giải chi tiết :
\(\begin{array}{l}{\Delta _r}H_{298}^o(1) = {\Delta _f}H_{298}^o(HI) - 0,5.{\Delta _r}H_{298}^o({H_2}) - 0,5.{\Delta _r}H_{298}^o({I_2}) = {\Delta _f}H_{298}^o(HI)\\{\Delta _r}H_{298}^o(2) = 0,5.{\Delta _f}H_{298}^o({H_2}) + 0,5.{\Delta _f}H_{298}^o({I_2}) - {\Delta _f}H_{298}^o(HI) = - {\Delta _f}H_{298}^o(HI)\\ \to {\Delta _r}H_{298}^o(2) = - {\Delta _r}H_{298}^o(1) = - 25,9kJ\end{array}\) Đáp án D
Câu 20 :
Thành phần chính của đa số các loại đá dùng trong xây dựng là CaCO3, chúng vừa có tác dụng chịu nhiệt, vừa chịu được lực. Cho phản ứng sau: Biết \({\Delta _f}H_{298}^o\)(CaCO3(s) = -1206,09 (kJ/mol); \({\Delta _f}H_{298}^o\)(CaO(s)) = -635,10 (kJ/mol); \({\Delta _f}H_{298}^o\)(CO2,g) = -393,50 (kJ/mol). Giá trị \({\Delta _r}H_{298}^o\)của phản ứng tính theo kJ là
Đáp án : B Phương pháp giải :
\({\Delta _r}H_{298}^o = {\Delta _f}H_{298}^o(sp) - {\Delta _f}H_{298}^o(c{\rm{d}})\) Lời giải chi tiết :
\({\Delta _r}H_{298}^o = {\Delta _f}H_{298}^o(CaO) + {\Delta _f}H_{298}^o(C{O_2}) - {\Delta _f}H_{298}^o(CaC{O_3}) = - 635,1 + ( - 393,5) - ( - 1206,90) = 178,3kJ\)
|














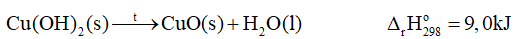

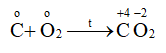








Danh sách bình luận