Đề thi học kì 1 Hóa 10 Chân trời sáng tạo - Đề số 6Chu kì làĐề bài
Câu 1 :
Trong bảng tuần hoàn, nguyên tố X có số thứ tự 11. Vậy X thuộc
Câu 2 :
Nguyên tố có Z = 21 có số phân lớp electron là
Câu 3 :
Vỏ nguyên tử T có 3 lớp electron và 8 electron ở lớp ngoài cùng. Trong bảng tuần hoàn T có vị trí là
Câu 4 :
Một nguyên tử nitrogen có 7 electron và 7 neutron. Khối lượng của nguyên tử nitrogen này là
Câu 5 :
Trong phân tử XY2 có tổng số hạt mang điện là 44. Tổng số khối của các nguyên tử trong XY2 là 44. Số hạt không mang điện trong Y nhiều hơn số hạt không mang điện trong X là 2. Biết rằng trong nguyên tử X các hạt có số lượng bằng nhau. Số proton của Y là
Câu 6 :
Một số nguyên tố R có 2 electron ngoài cùng thuộc phân lớp 3p. Cấu hình electron đầy đủ của nguyên tố R là
Câu 7 :
Bảng tuần hoàn hiện nay có số chu kì là
Câu 8 :
Cho kí hiệu các nguyên tử sau: \(_{\rm{6}}^{{\rm{14}}}{\rm{X, }}_{\rm{7}}^{{\rm{14}}}{\rm{Y, }}_{\rm{8}}^{{\rm{16}}}{\rm{Z, }}_{\rm{9}}^{{\rm{19}}}{\rm{T, }}_{\rm{8}}^{{\rm{17}}}{\rm{Q, }}_{{\rm{ 9}}}^{{\rm{16}}}{\rm{M, }}_{{\rm{10}}}^{{\rm{19}}}{\rm{E, }}_{\rm{7}}^{{\rm{16}}}{\rm{G, }}_{\rm{8}}^{{\rm{18}}}{\rm{L}}\). Dãy nào sau đây gồm các nguyên tử thuộc cùng một nguyên tố hóa học?
Câu 9 :
Dãy nguyên tố nào sau đây sắp xếp theo chiều tăng dần bán kính nguyên tử?
Câu 10 :
Cho các nguyên tố 11Na, 19K, 13Al, 12Mg. Chiều tăng dần tính kim loại của chúng là
Câu 11 :
Cho các phát biểu sau: (a) Trong một chu kì, theo chiều tăng dần điện tích hạt nhân, tính kim loại của các nguyên tố có xu hướng giảm dần. (b) Oxide cao nhất ứng với nguyên tố Mg là MgO. (c) Nguyên tố có độ âm điện cao nhất là F. (d) Trong một chu kì, theo chiều tăng dần điện tích hạt nhân, tính acid của các hydroxide có xu hướng giảm dần. (e) Độ âm điện là đại lượng đặc trưng cho sự hút electron liên kết của một nguyên tử trong phân tử. Số phát biểu đúng là
Câu 12 :
Cho: ZMg = 12, ZAl = 13, ZCl = 17, ZF = 9. Dãy sắp xếp các nguyên tử theo chiều bán kính giảm dần là
Câu 13 :
Hợp chất khí của nguyên tố M có dạng MH2. Công thức oxide cao nhất của M là
Câu 14 :
Liên kết hóa học là
Câu 15 :
Chất nào sau đây có dạng tinh thể ion?
Câu 16 :
Cho các chất sau: NaCl, HCl, NH3, Li2O, MgO, O2. Những chất tạo bởi liên kết cộng hóa trị là
Câu 17 :
Liên kết trong phân tử HF, HCl, HBr, HI đều là
Câu 18 :
Phân tử nào dưới đây chỉ có liên kết cộng hóa trị không phân cực?
Câu 19 :
Điều nào sau đây đúng khi nói về liên kết hydrogen nội phân tử?
Câu 20 :
Hợp chất nào sau đây tạo được liên kết hydrogen liên phân tử?
Lời giải và đáp án
Câu 1 :
Trong bảng tuần hoàn, nguyên tố X có số thứ tự 11. Vậy X thuộc
Đáp án : A Phương pháp giải :
Cách xác định vị trí của một nguyên tố khi biết Z: 1. Viết cấu hình e nguyên tử của nguyên tố. 2. Từ cấu hình suy ra vị trí của nguyên tố trong bảng tuần hoàn: *Chu kì: số lớp = số thứ tự chu kì *Nhóm: - Nếu e cuối cùng được điền vào phân lớp s, p ⟹ nhóm A Số e lớp ngoài cùng = số thứ tự nhóm - Nếu e cuối cùng được điền vào phân lớp d, f ⟹ nhóm B Gọi n là tổng số e hóa trị của nguyên tố (n = số e lớp ngoài cùng + số e phân lớp sát ngoài cùng nếu nó chưa bão hòa) + n < 8 ⟹ nhóm nB + 8 ≤ n ≤ 10 ⟹ nhóm VIIIB + n > 10 ⟹ nhóm (n-10)B Lời giải chi tiết :
Số thứ tự 11 ⟹ Z = 11 ⟹ Cấu hình e của X là 1s22s22p63s1 ⟹ Vị trí của X trong bảng tuần hoàn là: Chu kì 3, nhóm IA.
Câu 2 :
Nguyên tố có Z = 21 có số phân lớp electron là
Đáp án : D Phương pháp giải :
- Viết cấu hình electron nguyên tử. - Xác định số phân lớp electron. Lời giải chi tiết :
Z = 21: 1s2 2s2 2p6 3s2 3p6 3d1 4s2 → Có 7 phân lớp electron là: 1s, 2s, 2p, 3s, 3p, 3d, 4s.
Câu 3 :
Vỏ nguyên tử T có 3 lớp electron và 8 electron ở lớp ngoài cùng. Trong bảng tuần hoàn T có vị trí là
Đáp án : B Phương pháp giải :
- Số thứ tự ô nguyên tố = tổng số e của nguyên tử.- Số thứ tự chu kì = số lớp e.- Số thứ tự nhóm:+ Nếu cấu hình e lớp ngoài cùng có dạng nsanpb (a = 1 → 2 và b = 0 → 6): Nguyên tố thuộc nhóm (a + b)A+ Nếu cấu hình e kết thúc ở dạng (n - 1)dxnsy(x = 1 → 10; y = 1 → 2): Nguyên tố thuộc nhóm B: * Nhóm (x + y)B nếu 3 ≤ (x + y) ≤ 7 * Nhóm VIIIB nếu 8 ≤ (x + y) ≤ 10 * Nhóm (x + y - 10)B nếu 10 < (x + y) Lời giải chi tiết :
Cấu hình electron: 1s2 2s2 2p6 3s2 3p6 ⟹ Ô 18, chu kì 3, nhóm VIIIA.
Câu 4 :
Một nguyên tử nitrogen có 7 electron và 7 neutron. Khối lượng của nguyên tử nitrogen này là
Đáp án : C Phương pháp giải :
Khối lượng nguyên tử = khối lượng proton + khối lượng neutron = số p + số n (amu) Lời giải chi tiết :
Số p = số e = 7 Khối lượng nguyên tử nitrogen = 7 + 7 = 14 amu.
Câu 5 :
Trong phân tử XY2 có tổng số hạt mang điện là 44. Tổng số khối của các nguyên tử trong XY2 là 44. Số hạt không mang điện trong Y nhiều hơn số hạt không mang điện trong X là 2. Biết rằng trong nguyên tử X các hạt có số lượng bằng nhau. Số proton của Y là
Đáp án : C Phương pháp giải :
Gọi số hạt trong X là p1, n1, e1 và trong Y là p2, n2, e2 (biết số p = số e). Phương trình (1) tổng số hạt mang điện là 44. Phương trình (2) tổng số khối của các nguyên tử trong XY2 là 44. Phương tình (3) số hạt không mang điện trong Y nhiều hơn số hạt không mang điện trong X là 2. Phương trình (4) nguyên tử X các hạt có số lượng bằng nhau. Từ (1) (2) (3) (4) xác định p1, p2, n1, n2. Lời giải chi tiết :
Gọi số hạt trong X là p1, n1 và trong Y là p2, n2 (biết số p = số e). Phương trình (1) tổng số hạt mang điện là 44: 2p1 + 4p2 = 44. Phương trình (2) tổng số khối của các nguyên tử trong XY2 là 44: p1 + n1 + 2p2 + 2n2=44. Phương tình (3) số hạt không mang điện trong Y nhiều hơn số hạt không mang điện trong X là 2: n1 + 2 = n2. Phương trình (4) nguyên tử X các hạt có số lượng bằng nhau: p1 = n1. Từ (1) (2) (3) (4) suy ra p1 = 6, n1= 6, p2= 8, n2 = 8.
Câu 6 :
Một số nguyên tố R có 2 electron ngoài cùng thuộc phân lớp 3p. Cấu hình electron đầy đủ của nguyên tố R là
Đáp án : A Phương pháp giải :
Dựa vào cách viết cấu hình electron. Lời giải chi tiết :
Cấu hình electron đầy đủ: 1s2 2s2 2p6 3s2 3p2.
Câu 7 :
Bảng tuần hoàn hiện nay có số chu kì là
Đáp án : A Phương pháp giải :
Dựa vào lý thuyết về bảng tuần hoàn hóa học. Lời giải chi tiết :
Bảng tuần hoàn hiện nay có 7 chu kì.
Câu 8 :
Cho kí hiệu các nguyên tử sau: \(_{\rm{6}}^{{\rm{14}}}{\rm{X, }}_{\rm{7}}^{{\rm{14}}}{\rm{Y, }}_{\rm{8}}^{{\rm{16}}}{\rm{Z, }}_{\rm{9}}^{{\rm{19}}}{\rm{T, }}_{\rm{8}}^{{\rm{17}}}{\rm{Q, }}_{{\rm{ 9}}}^{{\rm{16}}}{\rm{M, }}_{{\rm{10}}}^{{\rm{19}}}{\rm{E, }}_{\rm{7}}^{{\rm{16}}}{\rm{G, }}_{\rm{8}}^{{\rm{18}}}{\rm{L}}\). Dãy nào sau đây gồm các nguyên tử thuộc cùng một nguyên tố hóa học?
Đáp án : D Phương pháp giải :
Nguyên tố hóa học là tập hợp những nguyên tử có cùng số proton. Lời giải chi tiết :
Dãy gồm các nguyên tử thuộc cùng một nguyên tố hóa học là \(_{\rm{8}}^{{\rm{16}}}{\rm{Z, }}_{\rm{8}}^{{\rm{17}}}{\rm{Q, }}_{\rm{8}}^{{\rm{18}}}{\rm{L}}\).
Câu 9 :
Dãy nguyên tố nào sau đây sắp xếp theo chiều tăng dần bán kính nguyên tử?
Đáp án : C Phương pháp giải :
Trong cùng chu kì, theo chiều tăng dần của điện tích hạt nhân, độ âm điện tăng dần, bán kính nguyên tử giảm dần, tính phi kim tăng dần, tính kim loại giảm dần. Trong cùng nhóm, theo chiều tăng dần của điện tích hạt nhân, độ âm điện giảm dần, bán kính nguyên tử tăng dần, tính phi kim giảm dần, tính kim loại tăng dần. Lời giải chi tiết :
Trong cùng chu kì 2, theo chiều Z tăng ⟶ RBe > RC > RO > RF Trong cùng nhóm IIA, theo chiều Z tăng ⟶ RBe < RCa ⟹ Dãy nguyên tố sắp xếp theo chiều tăng dần độ âm điện của nguyên tử là F, O, C, Be, Ca.
Câu 10 :
Cho các nguyên tố 11Na, 19K, 13Al, 12Mg. Chiều tăng dần tính kim loại của chúng là
Đáp án : B Phương pháp giải :
- Từ Z → Cấu hình e → Vị trí trong BTH. - Từ vị trí so sánh được tính kim loại của các nguyên tố: + Trong cùng một chu kì, theo chiều tăng của điện tích hạt nhân thì tính kim loại giảm dần. + Trong cùng một nhóm A, theo chiều tăng của điện tích hạt nhân thì tính kim loại tăng dần. Lời giải chi tiết :
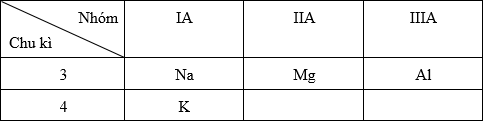
Cấu hình e nguyên tử: 11Na: 1s22s22p63s1. 19K: 1s22s22p63s23p64s1. 13Al: 1s22s22p63s23p1. 12Mg: 1s22s22p63s2. Vị trí tương đối của các nguyên tố trong bảng tuần hoàn:
- Trong cùng một chu kì, theo chiều tăng của điện tích hạt nhân thì tính kim loại giảm dần → Al < Mg < Na - Trong cùng một nhóm A, theo chiều tăng của điện tích hạt nhân thì tính kim loại tăng dần → Na < K Vậy tính kim loại: Al < Mg < Na < K.
Câu 11 :
Cho các phát biểu sau: (a) Trong một chu kì, theo chiều tăng dần điện tích hạt nhân, tính kim loại của các nguyên tố có xu hướng giảm dần. (b) Oxide cao nhất ứng với nguyên tố Mg là MgO. (c) Nguyên tố có độ âm điện cao nhất là F. (d) Trong một chu kì, theo chiều tăng dần điện tích hạt nhân, tính acid của các hydroxide có xu hướng giảm dần. (e) Độ âm điện là đại lượng đặc trưng cho sự hút electron liên kết của một nguyên tử trong phân tử. Số phát biểu đúng là
Đáp án : D Phương pháp giải :
Dựa vào xu hướng biến đổi tính kim loại, tính phi kim trong một nhóm và chu kì. Dựa vào xu hướng biến đổi độ tính acid trong một chu kì. Dựa vào thành phần và tính acid, tính base, của các oxide cao nhất trong một chu kì. Lời giải chi tiết :
(a) đúng. (b) đúng. (c) đúng. (d) sai, vì trong một chu kì, theo chiều tăng dần điện tích hạt nhân, tính acid của các hydroxide có xu hướng tăng dần. (e) đúng.
Câu 12 :
Cho: ZMg = 12, ZAl = 13, ZCl = 17, ZF = 9. Dãy sắp xếp các nguyên tử theo chiều bán kính giảm dần là
Đáp án : C Phương pháp giải :
- Xác định vị trí tương đối của các nguyên tố trong BTH các nguyên tố hóa học. - So sánh bán kính: + Nguyên tử nguyên tố nào có số lớp e lớn hơn thì bán kính lớn hơn. + Trong cùng một chu kì, theo chiều tăng của điện tích hạt nhân thì bán kính nguyên tử giảm dần. + Trong cùng một nhóm A, theo chiều tăng của điện tích hạt nhân thì bán kính nguyên tử tăng dần. Lời giải chi tiết :
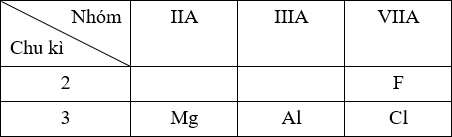
ZMg = 12: 1s2 2s2 2p6 3s2 → chu kì 3, nhóm IIA ZAl = 13: 1s2 2s2 2p6 3s2 3p1 → chu kì 3, nhóm IIIA ZCl = 17: 1s2 2s2 2p6 3s2 3p5 → chu kì 3, nhóm VIIA ZF = 9: 1s2 2s2 2p5 → chu kì 2, nhóm VIIA Vị trí tương đối của các nguyên tố trong BTH:
⟹ Bán kính: Mg > Al > Cl > F.
Câu 13 :
Hợp chất khí của nguyên tố M có dạng MH2. Công thức oxide cao nhất của M là
Đáp án : B Phương pháp giải :
Từ công thức hợp chất khí của nguyên tố M suy ra vị trí của M trong bảng tuần hoàn, từ đó xác định được công thức oxide cao nhất của M. Lời giải chi tiết :
Hợp chất khí của nguyên tố M có dạng MH2 ⟹ hóa trị của R trong hợp chất với oxygen là 8 - 2 = 6 ⟹ M thuộc nhóm VIA. Vậy công thức oxide cao nhất của M là MO3.
Câu 14 :
Liên kết hóa học là
Đáp án : B Phương pháp giải :
Dựa vào lý thuyết về liên kết hóa học. Lời giải chi tiết :
Liên kết hóa học là sự kết hợp giữa các nguyên tử tạo thành phân tử hay tinh thể bền vững hơn.
Câu 15 :
Chất nào sau đây có dạng tinh thể ion?
Đáp án : B Phương pháp giải :
Lý thuyết về mạng tinh thể nguyên tử, tinh thể phân tử. Lời giải chi tiết :
- Nước đá, iot là tinh thể phân tử. - Than chì có cấu trúc lớp. - Muối ăn là tinh thể ion.
Câu 16 :
Cho các chất sau: NaCl, HCl, NH3, Li2O, MgO, O2. Những chất tạo bởi liên kết cộng hóa trị là
Đáp án : D Phương pháp giải :
Dựa vào khái niệm liên kết ion và liên kết cộng hóa trị Lời giải chi tiết :
Những phân tử tạo bởi kim loại điển hình ( thuộc nhóm IA, IIA, IIIA) và phi kim điển hình ( nhóm VIA, VIIA) tạo thành liên kết ion. Những phân tử tạo bởi phi kim và phi kim tạo thành liên kết cộng hóa trị. Những chất tạo bởi liên kết cộng hóa trị là HCl, NH3, O2.
Câu 17 :
Liên kết trong phân tử HF, HCl, HBr, HI đều là
Đáp án : B Phương pháp giải :
- Liên kết cộng hóa trị trong đó cặp electron chung lệch về phóa 1 nguyên tử (có độ âm điện lớn hơn) gọi là liên kết cộng hóa trị có cực hay liên kết cộng hóa trị phân cực. - Liên kết cộng hóa trị trong đó cặp electron chung không bị lệch về phía nguyên tử nào gọi là liên kết cộng hóa trị không phân cực. - Liên kết ion là liên kết được hình thành bởi lực hút tĩnh điện giữa hai ion mang điện tích trái dấu. Lời giải chi tiết :
Liên kết trong phân tử HF, HCl, HBr, HI đều là các liên kết cộng hóa trị có cực.
Câu 18 :
Phân tử nào dưới đây chỉ có liên kết cộng hóa trị không phân cực?
Đáp án : A Phương pháp giải :
Phân tử của đơn chất được tạo nên bởi liên kết cộng hóa trị không phân cực. Lời giải chi tiết :
Phân tử có liên kết cộng hóa trị không phân cực là Br2.
Câu 19 :
Điều nào sau đây đúng khi nói về liên kết hydrogen nội phân tử?
Đáp án : B Phương pháp giải :
Dựa vào lý thuyết về liên kết hydrogen. Lời giải chi tiết :
Liên kết hydrogen nội phân tử là lực hút tĩnh điện giữa nguyên tử H (thường trong các liên kết H-F, H-N, H-O) ở một phân tử với một trong các nguyên tử có độ âm điện mạnh (thường là N, O, F) ở ngay chính phân tử đó.
Câu 20 :
Hợp chất nào sau đây tạo được liên kết hydrogen liên phân tử?
Đáp án : D Phương pháp giải :
Dựa vào khái niệm liên kết hydrogen. Lời giải chi tiết :
Hợp chất nào sau đây tạo được liên kết hydrogen liên phân tử là CH3OH.
|






















Danh sách bình luận