Đề thi giữa kì 1 Hóa 10 Chân trời sáng tạo - Đề số 11Nguyên tử gồm hạt nhân và vỏ nguyên tử. Vỏ nguyên tử chứa loại hạt nào sau đây?Đề bài
Phần 1. Trắc nghiệm nhiều đáp án lựa chọn
Câu 1 :
Nguyên tử gồm hạt nhân và vỏ nguyên tử. Vỏ nguyên tử chứa loại hạt nào sau đây?
Câu 2 :
Các nguyên tử của cùng một nguyên tố hóa học là đồng vị của nhau có sự khác nhau về
Câu 3 :
Kí hiệu phân lớp electron nào sau đây sai?
Câu 5 :
Cấu hình electron của nguyên tử Al (Z = 13) là
Câu 6 :
Biết số hiệu nguyên tử của hai nguyên tố X và Y lần lượt là 19 và 17. Cho các phát biểu sau: (a) Độ âm điện của nguyên tử X nhỏ hơn độ âm điện của nguyên tử Y. (b) Số electron độc thân của nguyên tử X ít hơn số electron độc thân của nguyên tử Y (c) X và Y đều là phi kim (d) X thuộc chu kì IA, Y thuộc chu kì VA. Số phát biểu đúng là
Câu 8 :
Trong bảng tuần hoàn các nguyên tố hóa học, các nguyên tố khí hiếm thuộc nhóm
Câu 9 :
Cho số hiệu nguyên tử của nguyên tố R là 7. Phát biểu nào sau đây sai?
Câu 10 :
Biết rằng đường kính của nguyên tử gấp 10000 lần đường kính của hạt nhân. Nếu đường kính của nguyên tử khoảng 10 pm (picomet) thì đường kính của hạt nhân khoảng
Câu 11 :
Nguyên tố magnesium có 2 đồng vị là \({}_{12}^{24}{\rm{Mg}}\)và \({}_{12}^{25}{\rm{Mg}}\). Tỉ lệ số nguyên tử của hai đồng vị là: \({}_{12}^{24}{\rm{Mg}}\): \({}_{12}^{25}{\rm{Mg}}\)= 3:2. Nguyên tử khối trung bình của magnesium là
Câu 12 :
Sự phân bố electron theo ô orbital nào dưới đây là đúng?
Câu 13 :
Hạt nhân nguyên tử Y có 3 hạt proton và 4 hạt neutron. Kí hiệu nguyên tử của Y là
Câu 14 :
Một nguyên tử X có tổng số hạt proton, neutron và electron là 34. Trong đó, số hạt mang điện nhiều hơn số hạt không mang điện là 10 hạt. Điện tích hạt nhân nguyên tử X là bao nhiêu?
Câu 16 :
Nguyên tử của nguyên tố hóa học X có cấu hình electron là [Ne]3s23p5. Nguyên tố X thuộc
Câu 17 :
Có các nhận định sau: a. Nguyên tử nguyên tố có cấu hình e lớp ngoài cùng là 3s23p5 thì nguyên tố đó là kim loại. b. Hạt nhân nguyên tử gồm hạt proton và electron. c. Lớp K là lớp có mức năng lượng thấp nhất. d. Ion X- có cấu hình e là 1s22s22p6. Vậy nguyên tố X là khí hiếm. e. Nguyên tử khối của nguyên tố X là 17. Tính gần đúng thì khối lượng nguyên tử nguyên tố đó nặng gấp 17 lần đơn vị khối lượng. Số nhận định đúng là:
Câu 18 :
Anion X2– có cấu hình electron lớp ngoài cùng là 3s23p6. Cấu hình electron của X là
Phần 2. Câu hỏi đúng, sai
Câu 1 :
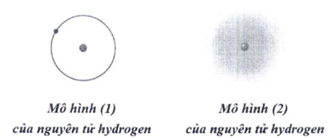
Trong lịch sử các thuyết về mô hình nguyên tử có mô hình hành tinh nguyên tử (mô hình Rutherford – Bohr) và mô hình hiện đại của nguyên tử.
Với nguyên tử hydrogen, mô hình (1) là mô hình hiện đại, mô hình (2) là mô hình hành tinh nguyên tử.
Đúng
Sai
Khái niệm về xác suất tìm thấy electron xuất phát từ mô hình hành tinh nguyên tử.
Đúng
Sai
Theo mô hình (1), electron chuyển động trên quỹ đạo xác định xung quanh hạt nhân.
Đúng
Sai
Khái niệm về orbital nguyên tử xuất phát từ mô hình hiện đại của nguyên tử.
Đúng
Sai
Câu 2 :
Trong tự nhiên, đồng có 2 đồng vị \(_{29}^{63}Cu\)và \(_{29}^{65}Cu\), nguyên tử khối trung bình của Cu là 63,54. Thành phần % đồng vị \(_{29}^{63}Cu\)là 27%.
Đúng
Sai
Thành phần % đồng vị \(_{29}^{63}Cu\)trong CuCl2 là 34,18%
Đúng
Sai
Có thể tạo được 4 loại CuX2 khác nhau.
Đúng
Sai
Số neutron chênh lệch giữa 2 đồng vị là 4.
Đúng
Sai
Câu 3 :
Một hợp chất có công thức XY2 trong đó X chiếm 50% về khối lượng. Trong hạt nhân của X và Y đều có số proton bằng số neutron. Tổng số proton trong phân tử XY2 là 32. X thuộc họ p
Đúng
Sai
Y có 6 electron hóa trị.
Đúng
Sai
X, Y thuộc cùng một nhóm.
Đúng
Sai
Y có độ âm điện lớn nhất trong bảng tuần hoàn.
Đúng
Sai
Câu 4 :
Cho các nhận định về orbital p như sau: Các electron thuộc các obitan 2px, 2py, 2pz có năng lượng như nhau.
Đúng
Sai
Các electron thuộc các obitan 2px, 2py, 2pz chỉ khác nhau về định hướng trong không gian
Đúng
Sai
Năng lượng của các electron thuộc các phân lớp 3s, 3p, 3d là khác nhau.
Đúng
Sai
Năng lượng của các electron thuộc các obitan 2s và 2px là như nhau.
Đúng
Sai
Phần 3. Trả lời ngắn
Lời giải và đáp án
Phần 1. Trắc nghiệm nhiều đáp án lựa chọn
Câu 1 :
Nguyên tử gồm hạt nhân và vỏ nguyên tử. Vỏ nguyên tử chứa loại hạt nào sau đây?
Đáp án : B Phương pháp giải :
Dựa vào thành phần nguyên tử. Lời giải chi tiết :
Vỏ nguyên tử chứa các hạt electron mang điện tích âm. Đáp án B
Câu 2 :
Các nguyên tử của cùng một nguyên tố hóa học là đồng vị của nhau có sự khác nhau về
Đáp án : A Phương pháp giải :
Dựa vào khái niệm nguyên tố hóa học. Lời giải chi tiết :
Các nguyên tử của cùng một nguyên tố hóa học là đồng vị của nhau có sự khác nhau về số neutron, có cùng số proton. Đáp án A
Câu 3 :
Kí hiệu phân lớp electron nào sau đây sai?
Đáp án : D Phương pháp giải :
Dựa vào lớp và phân lớp. Lời giải chi tiết :
Phân lớp f xuất hiện từ lớp thứ tư. Đáp án D
Đáp án : A Phương pháp giải :
Dựa vào hình dạng orbital. Lời giải chi tiết :
Hình bên biểu diễn hình dạng s vì orbital s có dạng hình cầu. Đáp án A
Câu 5 :
Cấu hình electron của nguyên tử Al (Z = 13) là
Đáp án : D Phương pháp giải :
Dựa vào cấu hình electron. Lời giải chi tiết :
Cấu hình electron của nguyên tử Al là: 1s22s22p63s23p1 Đáp án D
Câu 6 :
Biết số hiệu nguyên tử của hai nguyên tố X và Y lần lượt là 19 và 17. Cho các phát biểu sau: (a) Độ âm điện của nguyên tử X nhỏ hơn độ âm điện của nguyên tử Y. (b) Số electron độc thân của nguyên tử X ít hơn số electron độc thân của nguyên tử Y (c) X và Y đều là phi kim (d) X thuộc chu kì IA, Y thuộc chu kì VA. Số phát biểu đúng là
Đáp án : A Phương pháp giải :
Dựa vào cấu hình electron của X và Y. Lời giải chi tiết :
X là kim loại potassium (K); Y là phi kim chlorine (Cl) (a) đúng (b) đúng (c) sai, X là kim loại (d) sai, Y thuộc chu kì VIIA. Đáp án A
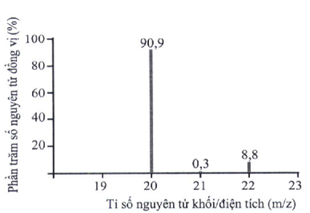
Đáp án : C Phương pháp giải :
Dựa vào phổ khối lượng của Ne. Lời giải chi tiết :
Có 3 đồng vị bền của Ne là: \(^{20}Ne{,^{21}}Ne{,^{22}}Ne\) Đáp án C
Câu 8 :
Trong bảng tuần hoàn các nguyên tố hóa học, các nguyên tố khí hiếm thuộc nhóm
Đáp án : C Phương pháp giải :
Dựa vào cấu tạo của bảng tuần hoàn. Lời giải chi tiết :
Các nguyên tố khí hiếm thuộc nhóm VIIIA trong bảng tuần hoàn. Đáp án C
Câu 9 :
Cho số hiệu nguyên tử của nguyên tố R là 7. Phát biểu nào sau đây sai?
Đáp án : D Phương pháp giải :
Dựa vào vị trí của R trong bảng tuần hoàn. Lời giải chi tiết :
R là nguyên tố nitrogen (N) trong bảng tuần hoàn. A. Đúng B. Đúng, do N ở nhóm VA; Si ở nhóm IVA nên tính phi kim N mạnh hơn Si. C. Đúng D. Sai, do N có 3 electron phân lớp p ngoài cùng. Đáp án D
Câu 10 :
Biết rằng đường kính của nguyên tử gấp 10000 lần đường kính của hạt nhân. Nếu đường kính của nguyên tử khoảng 10 pm (picomet) thì đường kính của hạt nhân khoảng
Đáp án : D Phương pháp giải :
Dựa vào kích thước hạt nhân nguyên tử. Lời giải chi tiết :
Đường kính của hạt nhân khoảng: \(\frac{{10}}{{10000}} = {10^{ - 3}}pm\) Đáp án D
Câu 11 :
Nguyên tố magnesium có 2 đồng vị là \({}_{12}^{24}{\rm{Mg}}\)và \({}_{12}^{25}{\rm{Mg}}\). Tỉ lệ số nguyên tử của hai đồng vị là: \({}_{12}^{24}{\rm{Mg}}\): \({}_{12}^{25}{\rm{Mg}}\)= 3:2. Nguyên tử khối trung bình của magnesium là
Đáp án : B Phương pháp giải :
Dựa vào công thức tính nguyên tử khối trung bình của nguyên tố. Lời giải chi tiết :
\({\bar M_{Mg}} = \frac{{24.3 + 25.2}}{5} = 24,4\) Đáp án B
Câu 12 :
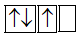
Sự phân bố electron theo ô orbital nào dưới đây là đúng?
Đáp án : B Phương pháp giải :
Dựa vào quy tắc Hunt. Lời giải chi tiết :
B đúng vì cần điền các electron vào tất cả các ô orbital, và 1 ô chứa 2 spin ngược chiều. Đáp án B
Câu 13 :
Hạt nhân nguyên tử Y có 3 hạt proton và 4 hạt neutron. Kí hiệu nguyên tử của Y là
Đáp án : C Phương pháp giải :
Dựa vào kí hiệu nguyên tố. Lời giải chi tiết :
Kí hiệu nguyên tử của Y là: \(_3^7Y\) Đáp án C
Câu 14 :
Một nguyên tử X có tổng số hạt proton, neutron và electron là 34. Trong đó, số hạt mang điện nhiều hơn số hạt không mang điện là 10 hạt. Điện tích hạt nhân nguyên tử X là bao nhiêu?
Đáp án : A Phương pháp giải :
Dựa vào thành phần nguyên tử. Lời giải chi tiết :
Ta có: p + n + e = 34 p + e – n = 10 \( \to \) n = 12; p = e = 11 Điện tích hạt nhân nguyên tử X là +11. Đáp án A
Đáp án : B Phương pháp giải :
Dựa vào kiến thức về nguyên tố hóa học. Lời giải chi tiết :
Trong nguyên tử, số khối bằng tổng các hạt proton và neutron. Đáp án B
Câu 16 :
Nguyên tử của nguyên tố hóa học X có cấu hình electron là [Ne]3s23p5. Nguyên tố X thuộc
Đáp án : C Phương pháp giải :
Dựa vào cấu hình electron của X. Lời giải chi tiết :
X có 7 electron lớp ngoài cùng nên thuộc nhóm IIA. X có 3 lớp electron nên thuộc chu kì 3 Đáp án C
Câu 17 :
Có các nhận định sau: a. Nguyên tử nguyên tố có cấu hình e lớp ngoài cùng là 3s23p5 thì nguyên tố đó là kim loại. b. Hạt nhân nguyên tử gồm hạt proton và electron. c. Lớp K là lớp có mức năng lượng thấp nhất. d. Ion X- có cấu hình e là 1s22s22p6. Vậy nguyên tố X là khí hiếm. e. Nguyên tử khối của nguyên tố X là 17. Tính gần đúng thì khối lượng nguyên tử nguyên tố đó nặng gấp 17 lần đơn vị khối lượng. Số nhận định đúng là:
Đáp án : C Phương pháp giải :
Dựa vào cấu hình electron nguyên tử. Lời giải chi tiết :
a. sai, nguyên tử nguyên tố có cấu hình e lớp ngoài cùng là 3s23p5 thì nguyên tố đó là phi kim. b. sai, hạt nhân nguyên tử gồm p và n. c. đúng d. sai, nguyên tố X là phi kim có cấu hình là 1s22s22p5 e. đúng Đáp án C
Câu 18 :
Anion X2– có cấu hình electron lớp ngoài cùng là 3s23p6. Cấu hình electron của X là
Đáp án : A Phương pháp giải :
Nguyên tử nhận electron để trở thành anion. Lời giải chi tiết :
Cấu hình electron của X là 1s22s22p63s23p4. Đáp án A
Phần 2. Câu hỏi đúng, sai
Câu 1 :
Trong lịch sử các thuyết về mô hình nguyên tử có mô hình hành tinh nguyên tử (mô hình Rutherford – Bohr) và mô hình hiện đại của nguyên tử.
Với nguyên tử hydrogen, mô hình (1) là mô hình hiện đại, mô hình (2) là mô hình hành tinh nguyên tử.
Đúng
Sai
Khái niệm về xác suất tìm thấy electron xuất phát từ mô hình hành tinh nguyên tử.
Đúng
Sai
Theo mô hình (1), electron chuyển động trên quỹ đạo xác định xung quanh hạt nhân.
Đúng
Sai
Khái niệm về orbital nguyên tử xuất phát từ mô hình hiện đại của nguyên tử.
Đúng
Sai
Đáp án
Với nguyên tử hydrogen, mô hình (1) là mô hình hiện đại, mô hình (2) là mô hình hành tinh nguyên tử.
Đúng
Sai
Khái niệm về xác suất tìm thấy electron xuất phát từ mô hình hành tinh nguyên tử.
Đúng
Sai
Theo mô hình (1), electron chuyển động trên quỹ đạo xác định xung quanh hạt nhân.
Đúng
Sai
Khái niệm về orbital nguyên tử xuất phát từ mô hình hiện đại của nguyên tử.
Đúng
Sai
Phương pháp giải :
Dựa vào mô hình Rutherford – Bohr. Lời giải chi tiết :
a. sai, mô hình (2) là mô hình hiện đại, mô hình (1) là hành tinh nguyên tử. b. sai, khái niệm về xác suất tìm thấy electron xuất phát từ mô hình hiện đại. c. đúng d. đúng
Câu 2 :
Trong tự nhiên, đồng có 2 đồng vị \(_{29}^{63}Cu\)và \(_{29}^{65}Cu\), nguyên tử khối trung bình của Cu là 63,54. Thành phần % đồng vị \(_{29}^{63}Cu\)là 27%.
Đúng
Sai
Thành phần % đồng vị \(_{29}^{63}Cu\)trong CuCl2 là 34,18%
Đúng
Sai
Có thể tạo được 4 loại CuX2 khác nhau.
Đúng
Sai
Số neutron chênh lệch giữa 2 đồng vị là 4.
Đúng
Sai
Đáp án
Thành phần % đồng vị \(_{29}^{63}Cu\)là 27%.
Đúng
Sai
Thành phần % đồng vị \(_{29}^{63}Cu\)trong CuCl2 là 34,18%
Đúng
Sai
Có thể tạo được 4 loại CuX2 khác nhau.
Đúng
Sai
Số neutron chênh lệch giữa 2 đồng vị là 4.
Đúng
Sai
Phương pháp giải :
Dựa vào kiến thức về đồng vị. Lời giải chi tiết :
Gọi % đồng vị \(_{29}^{63}Cu\)là a%, % đồng vị \(_{29}^{65}Cu\)là 100% - a% Ta có: \({\bar M_{Cu}} = \frac{{a.63 + (100 - a).65}}{{100}} = 63,54 \to a = 73\% \) a. Sai b. đúng vì %\(_{29}^{63}Cu\)trong CuCl2 là: \(\frac{{73\% .63}}{{63,54 + 35,5.2}}.100 = 34,18\% \) c. sai, có thể tạo ra 2 loại CuX2 là \(_{29}^{63}Cu\)X2 và \(_{29}^{65}Cu\)X2 d. sai, số neutron chênh lệch giữa 2 đồng vị là 2.
Câu 3 :
Một hợp chất có công thức XY2 trong đó X chiếm 50% về khối lượng. Trong hạt nhân của X và Y đều có số proton bằng số neutron. Tổng số proton trong phân tử XY2 là 32. X thuộc họ p
Đúng
Sai
Y có 6 electron hóa trị.
Đúng
Sai
X, Y thuộc cùng một nhóm.
Đúng
Sai
Y có độ âm điện lớn nhất trong bảng tuần hoàn.
Đúng
Sai
Đáp án
X thuộc họ p
Đúng
Sai
Y có 6 electron hóa trị.
Đúng
Sai
X, Y thuộc cùng một nhóm.
Đúng
Sai
Y có độ âm điện lớn nhất trong bảng tuần hoàn.
Đúng
Sai
Phương pháp giải :
Dựa vào cấu hình electron X, Y. Lời giải chi tiết :
Theo đề ra ta có: PX = EX = NX và PY = EY = NY Trong hợp chất XY2, X chiếm 50% về khối lượng nên: \(\frac{{{M_{\rm{X}}}}}{{2{M_Y}}} = 1 \to {P_{\rm{X}}} + {N_{\rm{X}}} = 2{P_Y} + 2{N_Y} \to {P_X} = 2{P_Y}\)(1) Tổng số proton trong phân tử XY2 là 32 nên PX + 2PY = 32 (2) Từ (1) và (2) ta tìm được X là S và Y là O Công thức XY2 là SO2 Cấu hình electron của S: 1s22s22p63s23p4 và của O: 1s22s22p4 a. đúng b. đúng c. đúng d. sai, F có độ âm điện lớn nhất.
Câu 4 :
Cho các nhận định về orbital p như sau: Các electron thuộc các obitan 2px, 2py, 2pz có năng lượng như nhau.
Đúng
Sai
Các electron thuộc các obitan 2px, 2py, 2pz chỉ khác nhau về định hướng trong không gian
Đúng
Sai
Năng lượng của các electron thuộc các phân lớp 3s, 3p, 3d là khác nhau.
Đúng
Sai
Năng lượng của các electron thuộc các obitan 2s và 2px là như nhau.
Đúng
Sai
Đáp án
Các electron thuộc các obitan 2px, 2py, 2pz có năng lượng như nhau.
Đúng
Sai
Các electron thuộc các obitan 2px, 2py, 2pz chỉ khác nhau về định hướng trong không gian
Đúng
Sai
Năng lượng của các electron thuộc các phân lớp 3s, 3p, 3d là khác nhau.
Đúng
Sai
Năng lượng của các electron thuộc các obitan 2s và 2px là như nhau.
Đúng
Sai
Phương pháp giải :
Dựa vào năng lượng orbital nguyên tử. Lời giải chi tiết :
a. đúng. Các electron trên cùng một phân lớp có mức năng lượng bằng nhau. b. đúng. Các obitan 2px, 2py, 2pz định hướng theo các trục x, y, z. c. đúng. Các electron trên cùng một lớp có mức năng lượng xấp xỉ nhau. d. sai. Năng lượng của các electron thuộc các obitan 2s và 2px là xấp xỉ nhau.
Phần 3. Trả lời ngắn
Phương pháp giải :
Dựa vào số hiệu nguyên tử. Lời giải chi tiết :
Các nguyên tố kim loại có số hiệu nguyên tử là 13, 19, 20. Đáp án 3 Phương pháp giải :
Dựa vào phổ khối của Mg. Lời giải chi tiết :
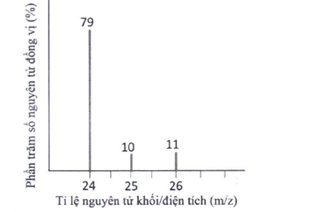
\({\bar M_{Mg}} = \frac{{79.24 + 25.10 + 11.26}}{{100}} = 24,32\) Đáp án 24,3 Phương pháp giải :
Dựa vào thành phần nguyên tử. Lời giải chi tiết :
Ta có: P + E + N = 28 N – P = 1 P = E Giải ra ta được: P = E = 9; N = 10 Nguyên tử khối của X là: 9 + 10 = 19 Đáp án 19. Phương pháp giải :
Dựa vào công thức tính nguyên tử khối trung bình. Lời giải chi tiết :
Nguyên tử khối trung bình của C là: \(\frac{{12.98,89 + 13.1,11}}{{100}} = 12,0111\) %12C trong H2CO3 là: \(\frac{{12.98,89\% }}{{2 + 12,0111 + 16.3}}.100 = 19,14\% \) Đáp án 19,14
|















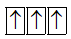






Danh sách bình luận