Đề thi giữa kì 2 Hóa 10 - Chân trời sáng tạo - Đề số 3Số oxi hóa của đơn chất luôn bằngĐề bài
I. Trắc nghiệm
Câu 1 :
Số oxi hóa của đơn chất luôn bằng
Câu 2 :
Phản ứng nào sau đây là phản ứng oxi hóa – khử?
Câu 3 :
Trong phản ứng hoá học: 2Na + 2H2O → 2NaOH + H2, chất oxi hoá là
Câu 4 :
Nguyên tố Floruine có thể có những số oxi hóa là -1 và 0. Vậy phân tử F2 thể hiện tính chất nào sau đây ?
Câu 5 :
Cho quá trình
Câu 6 :
Cho phương trình hoá học: Cu + HNO3 \( \to \) Cu(NO3)2 + NO + H2O Tổng hệ số cân bằng (nguyên, tối giản) của phản ứng là
Câu 7 :
Cho phản ứng hoá học: \(C{l_2} + KOH \to KCl + KCl{O_3} + {H_2}O.\) Tỉ lệ giữa số nguyên tử chlorine đóng vai trò chất oxi hóa và số nguyên tử chlorine đóng vai trò chất khử trong phương trình hoá học của phản ứng đã cho tương ứng là
Câu 8 :
Cho 3,16 gam KMnO4 tác dụng với dung dịch HCl (dư), sau khi phản ứng xảy ra hoàn toàn thì số mol HCl bị oxi hóa là
Câu 9 :
Phản ứng thu nhiệt có :
Câu 10 :
Cho phương trình nhiệt hoá học của phản ứng. 2H2(g) + O2 (g) → 2H2O (l) \({\Delta _r}H_{298}^0\) = - 571,68 kJ Phản ứng trên là phản ứng
Câu 11 :
Phản ứng nào sau đây là phản ứng toả nhiệt?
Câu 12 :
Dựa vào phương trình nhiệt hoá học của phản ứng sau: N2 (g) + 3H2(g) → 2NH3 (g) \({\Delta _r}H_{298}^0\)= – 91,8 kJ Giá trị \({\Delta _r}H_{298}^0\) của phản ứng: 2NH3 (g) → N2 (g) + 3H2(g) là
Câu 14 :
Cho phương trình hoá học của phản ứng: C2H4 (g) + H₂O (l) → C2H5OH (I) Biết nhiệt tạo thành chuẩn của các chất trên cho ở bảng sau đây :
Biến thiên enthalpy của phản ứng theo nhiệt tạo thành chuẩn của các chất trên là :
Câu 15 :
\({\Delta _r}H_{298}^0\) = -285,66 kJ Xác định giá trị của \({\Delta _r}H_{298}^0\) khi lấy gấp 3 lần khối lượng của các chất phản ứng.
II. Tự luận
Lời giải và đáp án
I. Trắc nghiệm
Câu 1 :
Số oxi hóa của đơn chất luôn bằng
Đáp án : A Phương pháp giải :
Dựa vào quy tắc xác định số oxi hóa Lời giải chi tiết :
Số oxi hóa của đơn chất luôn bằng 0 Đáp án A
Câu 2 :
Phản ứng nào sau đây là phản ứng oxi hóa – khử?
Đáp án : A Phương pháp giải :
Dựa vào khái niệm phản ứng oxi hóa – khử Lời giải chi tiết :
Đáp án A
Câu 3 :
Trong phản ứng hoá học: 2Na + 2H2O → 2NaOH + H2, chất oxi hoá là
Đáp án : A Phương pháp giải :
Chất oxi hóa là chất nhận electron Lời giải chi tiết :
Chất oxi hóa là H2O Đáp án A
Câu 4 :
Nguyên tố Floruine có thể có những số oxi hóa là -1 và 0. Vậy phân tử F2 thể hiện tính chất nào sau đây ?
Đáp án : A Phương pháp giải :
Dựa vào số oxi hóa của F Lời giải chi tiết :
Phân tử F2 thể hiện tính oxi hóa Đáp án A
Câu 5 :
Cho quá trình
Đáp án : B Phương pháp giải :
Dựa vào quá trình trao đổi electron của S Lời giải chi tiết :
S đã nhận 2 electron => chất oxi hóa có quá trình khử Đáp án B
Câu 6 :
Cho phương trình hoá học: Cu + HNO3 \( \to \) Cu(NO3)2 + NO + H2O Tổng hệ số cân bằng (nguyên, tối giản) của phản ứng là
Đáp án : B Phương pháp giải :
Dựa vào phương pháp thăng bằng electron Lời giải chi tiết :
\(\begin{array}{l}C{u^0} \to C{u^{ + 2}} + 2{\rm{e|x3}}\\{N^{ + 5}} + 3e \to {N^{ + 2}}|x2\end{array}\) 3Cu + 8HNO3 \( \to \) 3Cu(NO3)2 + 2NO + 4H2O Tổng hệ số cân bằng tối giản là: 3 + 8 + 3 + 2 + 4 = 20 Đáp án B
Câu 7 :
Cho phản ứng hoá học: \(C{l_2} + KOH \to KCl + KCl{O_3} + {H_2}O.\) Tỉ lệ giữa số nguyên tử chlorine đóng vai trò chất oxi hóa và số nguyên tử chlorine đóng vai trò chất khử trong phương trình hoá học của phản ứng đã cho tương ứng là
Đáp án : B Phương pháp giải :
Dựa vào phương pháp thăng bằng electron Lời giải chi tiết :
\(\begin{array}{l}C{l_2} + 2{\rm{e}} \to 2C{l^{ - 1}}|x5\\C{l_2} \to 2C{l^{ + 5}} + 10{\rm{e|x1}}\end{array}\) Tỉ lệ giữa số nguyên tử chlorine đóng vai trò chất oxi hóa và số nguyên tủ chlorine đóng vai trò chất khử là 5 :1
Câu 8 :
Cho 3,16 gam KMnO4 tác dụng với dung dịch HCl (dư), sau khi phản ứng xảy ra hoàn toàn thì số mol HCl bị oxi hóa là
Đáp án : C Phương pháp giải :
Viết phương trình phản ứng oxi hóa của KMnO4 và HCl Lời giải chi tiết :
n KMnO4 = 3,16 : 158 = 0,02 mol 2KMnO4 + 16HCl \( \to \)2KCl + 2MnCl2 + 5Cl2 + 8H2O Theo bảo toàn electron: n HCl bị oxi hóa = 0,1 mol Đáp án C
Câu 9 :
Phản ứng thu nhiệt có :
Đáp án : A Phương pháp giải :
Dựa vào dấu của \(\Delta H\) Lời giải chi tiết :
Phản ứng thu nhiệt có \(\Delta H > 0\) Đáp án A
Câu 10 :
Cho phương trình nhiệt hoá học của phản ứng. 2H2(g) + O2 (g) → 2H2O (l) \({\Delta _r}H_{298}^0\) = - 571,68 kJ Phản ứng trên là phản ứng
Đáp án : C Phương pháp giải :
Dựa vào dấu của \(\Delta H\) Lời giải chi tiết :
Phản ứng trên có \({\Delta _r}H_{298}^0\) = - 571,68 < 0 => Phản ứng tỏa nhiệt Đáp án C
Câu 11 :
Phản ứng nào sau đây là phản ứng toả nhiệt?
Đáp án : C Phương pháp giải :
Dựa vào khái niệm phản ứng tỏa nhiệt và thu nhiệt Lời giải chi tiết :
Phản ứng oxi hóa glucose trong cơ thể là phản ứng tỏa nhiệt Đáp án C
Câu 12 :
Dựa vào phương trình nhiệt hoá học của phản ứng sau: N2 (g) + 3H2(g) → 2NH3 (g) \({\Delta _r}H_{298}^0\)= – 91,8 kJ Giá trị \({\Delta _r}H_{298}^0\) của phản ứng: 2NH3 (g) → N2 (g) + 3H2(g) là
Đáp án : D Phương pháp giải :
Dựa vào \({\Delta _r}H_{298}^0\)(1) Lời giải chi tiết :
\({\Delta _r}H_{298}^0\)(2) = - \({\Delta _r}H_{298}^0\)(1) = 91,8 KJ. Đáp án D
Đáp án : D Phương pháp giải :
Dựa vào khái niệm enthalpy tạo thành chuẩn của chất Lời giải chi tiết :
(1) là phản ứng enthalpy tạo thành chuẩn của NO Đáp án D
Câu 14 :
Cho phương trình hoá học của phản ứng: C2H4 (g) + H₂O (l) → C2H5OH (I) Biết nhiệt tạo thành chuẩn của các chất trên cho ở bảng sau đây :
Biến thiên enthalpy của phản ứng theo nhiệt tạo thành chuẩn của các chất trên là :
Đáp án : B Phương pháp giải :
Dựa vào công thức tính \({\Delta _r}H_{298}^0\) của phản ứng Lời giải chi tiết :
\({\Delta _r}H_{298}^0\)= \({\Delta _f}H_{298}^0\)(C2H5OH) - \({\Delta _f}H_{298}^0\)(C2H4) - \({\Delta _f}H_{298}^0\)(H2O) = -277,63 – 52,47 – (-285,84) = -44,26 KJ Đáp án B
Câu 15 :
\({\Delta _r}H_{298}^0\) = -285,66 kJ Xác định giá trị của \({\Delta _r}H_{298}^0\) khi lấy gấp 3 lần khối lượng của các chất phản ứng.
Đáp án : B Lời giải chi tiết :
Khi lấy gấp 3 lần khối lượng của chất phản ứng thì \({\Delta _r}H_{298}^0\)gấp 3 lần => \({\Delta _r}H_{298}^0\)= 3.(-285,66) = -856,98 kJ
II. Tự luận
Lời giải chi tiết :
a) PTHH: 3C2H5OH + K2Cr2O7+ 4H2SO4→ 3CH3CHO + K2SO4 + Cr2(SO4)3 + 7H2O b) n K2Cr2O7 = 0,02 . 0,01 = 2.10-4 mol theo phương trình hóa học: n C2H5OH = 6.10-4 mol m C2H5OH = 6.10-4.46 = 0,0276g %m C2H5OH = \(\frac{{0,0276}}{{25}}.100 = 0,11\% \) Người lái xe có vi phạm luật giao thông. Lời giải chi tiết :
\(\begin{array}{l}{M^0} \to {M^{ + n}} + n.e\\\frac{{0,26}}{n}{\rm{ 0,26}}\\{S^{ + 6}} + 2e \to {S^{ + 4}}\\{\rm{ 0,26 0,13}}\end{array}\) MM = \(\frac{{2,34}}{{\frac{{0,26}}{n}}} = 9n\)=> Với n = 3, M = 27 (Al)
|














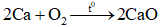
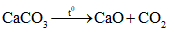
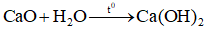
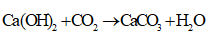
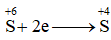 , đây là quá trình
, đây là quá trình

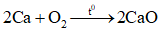 : là phản ứng oxi hóa – khử vì có sự thay đổi số oxi hóa của Ca và O2
: là phản ứng oxi hóa – khử vì có sự thay đổi số oxi hóa của Ca và O2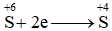









Danh sách bình luận