Đề thi học kì 1 Hóa 10 Chân trời sáng tạo - Đề số 8Hạt mang điện trong hạt nhân nguyên tử là:Đề bài
Phần 1. Trắc nghiệm nhiều đáp án lựa chọn
Câu 1 :
Hạt mang điện trong hạt nhân nguyên tử là:
Câu 2 :
Cho các nguyên tử \({}_6^{12}X,{}_7^{14}Y,{}_6^{14}Z.\)Những nguyên tử nào cùng thuộc một nguyên tố hóa học?
Câu 3 :
Nitrogen trong thiên nhiên là hỗn hợp gồm hai đồng vị là (99,63%) và (0,37%). Nguyên tử khối trung bình của nitrogen là:
Câu 4 :
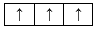
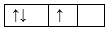
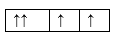
Sự phân bố electron theo ô orbital nào dưới đây là đúng?
Câu 5 :
Một nguyên tố R có cấu hình electron: 1s22s22p63s23p4, công thức hợp chất của R với hydrogen và công thức oxide cao nhất là:
Câu 6 :
Cấu hình electron nào sau đây không phải của kim loại?
Câu 7 :
Ion nào sau đây không là ion đơn nguyên tử?
Câu 8 :
Dựa vào giá trị độ âm điện của S là 2,58 và O là 3,44. Loại liên kết trong các phân tử SO3 là
Câu 9 :
Tổng số hạt proton, neutron và electron trong nguyên tử X là 58. Số hạt mang điện nhiều hơn số hạt không mang điện là 18. X là
Câu 10 :
Nguyên tố Ca có số hiệu nguyên tử là 20. Phát biểu nào sau đây về Ca là không đúng?
Câu 11 :
Nguyên tử của nguyên tố A có tổng số electron ở phân lớp p là 5, Vị trí của nguyên tố A trong bảng tuần hoàn là:
Câu 12 :
Liên kết ion được tạo thành giữa?
Câu 13 :
Nguyên tử của nguyên tố X có cấu hình electron 1s22s22p63s23p64s1, nguyên tử của nguyên tố Y có cấu hình electron 1s22s22p5. Liên kết hóa học giữa nguyên tử X và nguyên tử Y thuộc loại liên kết nào?
Câu 14 :
Công thức cấu tạo nào sau đây là công thức Lewis?
Câu 15 :
Dãy nào sau đây gồm các chất mà phân tử đều chỉ có liên kết cộng hóa trị phân cực?
Câu 17 :
Cation M2+ có cấu hình electron 1s22s22p63s23p6. Cấu hình electron của nguyên tử M là?
Câu 18 :
Phân tử nào sau đây có chứa liên kết ba?
Phần 2. Câu hỏi đúng, sai
Câu 1 :
Cho nguyên tử sulfur (lưu huỳnh) có Z = 16 và N = 16. a. Số khối của nguyên tử sulfur là 16.
Đúng
Sai
b. Sulfur là một nguyên tố phi kim do có 6 electron thuộc lớp ngoài cùng.
Đúng
Sai
c. Ở trạng thái cơ bản, nguyên tử sulfur có số orbital chứa eletron là 8.
Đúng
Sai
d. Trong bảng tuần hoàn các nguyên tố sulfur nằm ở chu kì 3.
Đúng
Sai
Câu 2 :
Aluminium có rất nhiều ứng dụng trong cuộc sống. Aluminium được dùng để sản xuất các thiết bị và dụng cụ sinh hoạt như nồi, chảo, các đường dây tải điện, các loại cửa,… đặc biệt dùng trong công nghệ sản xuất vỏ máy bay do nhẹ, bền. Trong bảng tuần hoàn các nguyên tố hoá học, nguyên tử Aluminium thuộc chu kì 3 và nhóm IIIA. a. Trong hạt nhân nguyên tử Aluminium có 13 hạt proton.
Đúng
Sai
b. Nguyên tử Aluminium có 3 lớp electron.
Đúng
Sai
c. Nguyên tố Aluminium có có tính kim loại mạnh hơn nguyên tố có số hiệu 11.
Đúng
Sai
d. oxide cao nhất của Aluminium có công thức Al2O3 là basic oxide.
Đúng
Sai
Câu 3 :
Cho 2 nguyên tố X và Y có số hiệu nguyên tử lần lượt là 11 và 8. a. Số electron hoá trị của X và Y lần lượt là 1 và 2.
Đúng
Sai
b. Hợp chất tạo thành giữa X và Y có liên kết ion và có công thức là X2Y.
Đúng
Sai
c. Hợp chất tạo thành giữa X và Y là chất khí tan tốt trong nước.
Đúng
Sai
d. Khi tạo thành hợp chất, nguyên tử X nhường 2 electron và nguyên tử Y nhận 2 electron.
Đúng
Sai
Câu 4 :
Ammonia là chất khí không màu có mùi khai là xốc. Ammonia là chất trung gian trong sản xuất phân bón. Công thức Lewis của Ammonia hình bên
a. Phân tử Ammonia chứa 3 liên kết cộng hoá trị phân cực, cặp elctron dùng chung lệch về phía nguyên tử hydrogen.
Đúng
Sai
b. Trong phân tử ammonia nguyên tử nitrogen còn 1 cặp electron chưa liên kết nên có khả năng hình thành liên kết cho nhận.
Đúng
Sai
c. Khí Ammonia tan tốt trong nước do hình thành liên kết hydrogen với các phân tử nước.
Đúng
Sai
d. Liên kết giữa nguyên tử N và H được hình thành do sự xen phủ của orbital s và p gọi là liên kết .
Đúng
Sai
Phần 3. Trả lời ngắn
Câu 1 :
Trong sản xuất thịt chế biến sẵn, người ta thường bổ sung một hợp chất có công thức dạng X2Y để ức chế sự sinh sôi phát triển của vi khuẩn trong thịt, giúp thịt lâu hư, tránh các trường hợp ngộ độc thực phẩm do thịt bị ôi thiu. Phân tử X2Y có tồng số proton là 23. Biết X, Y ở hai nhóm A liên tiếp trong cùng một chu kì. Phần trăm khối lượng của Y trong oxide cao nhất của Y là bao nhiêu? Đáp án:
Câu 2 :
Hợp chất X có công thức là A2B có tổng số hạt (p, n, e) là 92, trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 28. Nguyên tử nguyên tố A có số proton nhiều hơn so với nguyên tử nguyên tố B là 3. Số hạt mang điện của nguyên tử A là ? Đáp án:
Câu 3 :
Cho các chất sau: C2H6, H2O, NH3, PF3, C2H5OH. Số chất tạo được liên kết hydrogen là? Đáp án:
Câu 4 :
Hai nguyên tố M và X tạo thành hợp chất có công thức là M2X. Cho biết: Tổng số proton trong hợp chất bằng 46. Trong hạt nhân của M có số hạt không mang điện nhiều hơn số hạt mang điện là 1. Trong hạt nhân của X có số hạt mang điện bằng số hạt không mang điện. Trong hợp chất M2X, nguyên tố X chiếm 17,02% về khối lượng. Liên kết M2X thuộc liên kết gì? Đáp án: Lời giải và đáp án
Phần 1. Trắc nghiệm nhiều đáp án lựa chọn
Câu 1 :
Hạt mang điện trong hạt nhân nguyên tử là:
Đáp án : B Phương pháp giải :
Dựa vào thành phần nguyên tử. Lời giải chi tiết :
Hạt proton mang điện tích dương trong hạt nhân nguyên tử. Đáp án B
Câu 2 :
Cho các nguyên tử \({}_6^{12}X,{}_7^{14}Y,{}_6^{14}Z.\)Những nguyên tử nào cùng thuộc một nguyên tố hóa học?
Đáp án : C Phương pháp giải :
Các nguyên tố hóa học có cùng số proton khác nhau neutron. Lời giải chi tiết :
X và Z cùng có 6 proton nên thuộc cùng nguyên tố hóa học Đáp án C
Câu 3 :
Nitrogen trong thiên nhiên là hỗn hợp gồm hai đồng vị là (99,63%) và (0,37%). Nguyên tử khối trung bình của nitrogen là:
Đáp án : B Phương pháp giải :
Dựa vào công thức tính nguyên tử khối trung bình. Lời giải chi tiết :
\({\bar M_N} = \frac{{14.99,63 + 15.0,37}}{{100}} = 14\) Đáp án B
Câu 4 :
Sự phân bố electron theo ô orbital nào dưới đây là đúng?
Đáp án : B Phương pháp giải :
Dựa vào sự phân bố electron theo ô orbital. Lời giải chi tiết :
B đúng, vì cần đầy đủ electron vào ô orbital và mỗi orbital chứa tối đa 2 spin trái dấu. Đáp án B
Câu 5 :
Một nguyên tố R có cấu hình electron: 1s22s22p63s23p4, công thức hợp chất của R với hydrogen và công thức oxide cao nhất là:
Đáp án : B Phương pháp giải :
Dựa vào cấu hình electron của R. Lời giải chi tiết :
Vì R có 6 electron lớp ngoài cùng nên công thức oxide cao nhất là RO3 và công thức với hydrogen là RH2 Đáp án B
Câu 6 :
Cấu hình electron nào sau đây không phải của kim loại?
Đáp án : B Phương pháp giải :
Các nguyên tử kim loại có 1,2,3 số electron lớp ngoài cùng. Lời giải chi tiết :
1s22s22p63s23p5 có 7 electron lớp ngoài cùng nên không thuộc nguyên tố kim loại. Đáp án B
Câu 7 :
Ion nào sau đây không là ion đơn nguyên tử?
Đáp án : B Phương pháp giải :
Dựa vào các ion. Lời giải chi tiết :
Ion NO3- là ion đa nguyên tử. Đáp án B
Câu 8 :
Dựa vào giá trị độ âm điện của S là 2,58 và O là 3,44. Loại liên kết trong các phân tử SO3 là
Đáp án : A Phương pháp giải :
Dựa vào hiệu độ âm điện. Lời giải chi tiết :
Liên kết trong phân tử SO3 là liên kết cộng hóa trị không phân cực. Đáp án A
Câu 9 :
Tổng số hạt proton, neutron và electron trong nguyên tử X là 58. Số hạt mang điện nhiều hơn số hạt không mang điện là 18. X là
Đáp án : C Phương pháp giải :
Dựa vào thành phần nguyên tử Lời giải chi tiết :
Ta có: p + n + e = 58 p + e – n = 18 và p = e giải phương trình ta được: p = e = 19; n = 20. X là K Đáp án C
Câu 10 :
Nguyên tố Ca có số hiệu nguyên tử là 20. Phát biểu nào sau đây về Ca là không đúng?
Đáp án : D Phương pháp giải :
Dựa vào vị trí của Ca. Lời giải chi tiết :
D sai vì nguyên tố Ca là một kim loại. Đáp án D
Câu 11 :
Nguyên tử của nguyên tố A có tổng số electron ở phân lớp p là 5, Vị trí của nguyên tố A trong bảng tuần hoàn là:
Đáp án : B Phương pháp giải :
Dựa vào vị trí của A trong bảng tuần hoàn. Lời giải chi tiết :
Cấu hình của nguyên tố A là: 1s2 2s22p5 Vậy A ở chu kì 2, nhóm VIIA Đáp án B
Câu 12 :
Liên kết ion được tạo thành giữa?
Đáp án : C Phương pháp giải :
Dựa vào khái niệm liên kết ion. Lời giải chi tiết :
Liên kết ion được tạo thành giữa một nguyên tử kim loại điển hình và một nguyên tử phi kim điển hình. Đáp án C
Câu 13 :
Nguyên tử của nguyên tố X có cấu hình electron 1s22s22p63s23p64s1, nguyên tử của nguyên tố Y có cấu hình electron 1s22s22p5. Liên kết hóa học giữa nguyên tử X và nguyên tử Y thuộc loại liên kết nào?
Đáp án : C Phương pháp giải :
Xác định nguyên tử nguyên tố X, Y từ đó xác định liên kết. Lời giải chi tiết :
X là kim loại K, Y là phi kim F. Liên kết hóa học giữa nguyên tử K và nguyên tử F thuộc liên kết ion. Đáp án C
Câu 14 :
Công thức cấu tạo nào sau đây là công thức Lewis?
Đáp án : B Phương pháp giải :
Dựa vào công thức Lewis. Lời giải chi tiết :
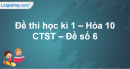
biểu diễn công thức Lewis của phân tử O2. Đáp án B
Câu 15 :
Dãy nào sau đây gồm các chất mà phân tử đều chỉ có liên kết cộng hóa trị phân cực?
Đáp án : B Phương pháp giải :
Dựa vào liên kết cộng hóa trị phân cưc. Lời giải chi tiết :
H2O, HCl, H2S chứa liên kết cộng hóa trị phân cực. Đáp án B
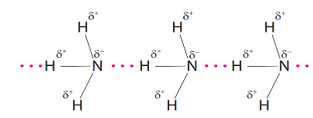
Đáp án : D Phương pháp giải :
Dựa vào khái niệm liên kết hydrogen. Lời giải chi tiết :
Các đường nét đứt đại diện cho liên kết hydrogen hình thành giữa nguyên tử nitrogen và hydrogen. Đáp án D
Câu 17 :
Cation M2+ có cấu hình electron 1s22s22p63s23p6. Cấu hình electron của nguyên tử M là?
Đáp án : B Phương pháp giải :
Dựa vào cấu hình của M Lời giải chi tiết :
M có khả năng nhường 2 electron để tạo thành cation M2+ nên cấu hình electron của nguyên tử M là: 1s22s22p63s23p64s2 Đáp án B
Câu 18 :
Phân tử nào sau đây có chứa liên kết ba?
Đáp án : A Phương pháp giải :
Dựa vào cấu tạo của các nguyên tử, phân tử. Lời giải chi tiết :
N2 chứa liên kết ba N≡N Đáp án A
Phần 2. Câu hỏi đúng, sai
Câu 1 :
Cho nguyên tử sulfur (lưu huỳnh) có Z = 16 và N = 16. a. Số khối của nguyên tử sulfur là 16.
Đúng
Sai
b. Sulfur là một nguyên tố phi kim do có 6 electron thuộc lớp ngoài cùng.
Đúng
Sai
c. Ở trạng thái cơ bản, nguyên tử sulfur có số orbital chứa eletron là 8.
Đúng
Sai
d. Trong bảng tuần hoàn các nguyên tố sulfur nằm ở chu kì 3.
Đúng
Sai
Đáp án
a. Số khối của nguyên tử sulfur là 16.
Đúng
Sai
b. Sulfur là một nguyên tố phi kim do có 6 electron thuộc lớp ngoài cùng.
Đúng
Sai
c. Ở trạng thái cơ bản, nguyên tử sulfur có số orbital chứa eletron là 8.
Đúng
Sai
d. Trong bảng tuần hoàn các nguyên tố sulfur nằm ở chu kì 3.
Đúng
Sai
Phương pháp giải :
Dựa vào vị trí của S trong bảng tuần hoàn. Lời giải chi tiết :
a. sai, số khối của nguyên tử S là 32. b. đúng c. sai, nguyên tử sulfur có 9 ô orbital. d. đúng
Câu 2 :
Aluminium có rất nhiều ứng dụng trong cuộc sống. Aluminium được dùng để sản xuất các thiết bị và dụng cụ sinh hoạt như nồi, chảo, các đường dây tải điện, các loại cửa,… đặc biệt dùng trong công nghệ sản xuất vỏ máy bay do nhẹ, bền. Trong bảng tuần hoàn các nguyên tố hoá học, nguyên tử Aluminium thuộc chu kì 3 và nhóm IIIA. a. Trong hạt nhân nguyên tử Aluminium có 13 hạt proton.
Đúng
Sai
b. Nguyên tử Aluminium có 3 lớp electron.
Đúng
Sai
c. Nguyên tố Aluminium có có tính kim loại mạnh hơn nguyên tố có số hiệu 11.
Đúng
Sai
d. oxide cao nhất của Aluminium có công thức Al2O3 là basic oxide.
Đúng
Sai
Đáp án
a. Trong hạt nhân nguyên tử Aluminium có 13 hạt proton.
Đúng
Sai
b. Nguyên tử Aluminium có 3 lớp electron.
Đúng
Sai
c. Nguyên tố Aluminium có có tính kim loại mạnh hơn nguyên tố có số hiệu 11.
Đúng
Sai
d. oxide cao nhất của Aluminium có công thức Al2O3 là basic oxide.
Đúng
Sai
Phương pháp giải :
Dựa vào vị trí của Al trong bảng tuần hoàn. Lời giải chi tiết :
a. đúng b. đúng c. sai, nguyên tố Al có tính kim loại yếu hơn nguyên tố Na d. sai, Al2O3 là oxide lưỡng tính.
Câu 3 :
Cho 2 nguyên tố X và Y có số hiệu nguyên tử lần lượt là 11 và 8. a. Số electron hoá trị của X và Y lần lượt là 1 và 2.
Đúng
Sai
b. Hợp chất tạo thành giữa X và Y có liên kết ion và có công thức là X2Y.
Đúng
Sai
c. Hợp chất tạo thành giữa X và Y là chất khí tan tốt trong nước.
Đúng
Sai
d. Khi tạo thành hợp chất, nguyên tử X nhường 2 electron và nguyên tử Y nhận 2 electron.
Đúng
Sai
Đáp án
a. Số electron hoá trị của X và Y lần lượt là 1 và 2.
Đúng
Sai
b. Hợp chất tạo thành giữa X và Y có liên kết ion và có công thức là X2Y.
Đúng
Sai
c. Hợp chất tạo thành giữa X và Y là chất khí tan tốt trong nước.
Đúng
Sai
d. Khi tạo thành hợp chất, nguyên tử X nhường 2 electron và nguyên tử Y nhận 2 electron.
Đúng
Sai
Phương pháp giải :
Dựa vào vị trí của X, Y trong bảng tuần hoàn. Lời giải chi tiết :
a. sai, số electron hóa trị của Y là 6 b. đúng c. sai, hợp chất tạo thành giữa X và Y là chất rắn tan tốt trong nước. d. sai, nguyên tử X nhường 1 electron, nguyên tử Y nhận 2 electron
Câu 4 :
Ammonia là chất khí không màu có mùi khai là xốc. Ammonia là chất trung gian trong sản xuất phân bón. Công thức Lewis của Ammonia hình bên
a. Phân tử Ammonia chứa 3 liên kết cộng hoá trị phân cực, cặp elctron dùng chung lệch về phía nguyên tử hydrogen.
Đúng
Sai
b. Trong phân tử ammonia nguyên tử nitrogen còn 1 cặp electron chưa liên kết nên có khả năng hình thành liên kết cho nhận.
Đúng
Sai
c. Khí Ammonia tan tốt trong nước do hình thành liên kết hydrogen với các phân tử nước.
Đúng
Sai
d. Liên kết giữa nguyên tử N và H được hình thành do sự xen phủ của orbital s và p gọi là liên kết .
Đúng
Sai
Đáp án
a. Phân tử Ammonia chứa 3 liên kết cộng hoá trị phân cực, cặp elctron dùng chung lệch về phía nguyên tử hydrogen.
Đúng
Sai
b. Trong phân tử ammonia nguyên tử nitrogen còn 1 cặp electron chưa liên kết nên có khả năng hình thành liên kết cho nhận.
Đúng
Sai
c. Khí Ammonia tan tốt trong nước do hình thành liên kết hydrogen với các phân tử nước.
Đúng
Sai
d. Liên kết giữa nguyên tử N và H được hình thành do sự xen phủ của orbital s và p gọi là liên kết .
Đúng
Sai
Phương pháp giải :
Dựa vào cấu tạo của ammonia. Lời giải chi tiết :
a. sai, cặp electron dùng chung lệch về phía nguyên tử nitrogen. b. đúng c. đúng d. sai, liên kết giữa nguyên tử N và H được hình thành do sự xen phủ của orbital s và s gọi là liên kết σ
Phần 3. Trả lời ngắn
Câu 1 :
Trong sản xuất thịt chế biến sẵn, người ta thường bổ sung một hợp chất có công thức dạng X2Y để ức chế sự sinh sôi phát triển của vi khuẩn trong thịt, giúp thịt lâu hư, tránh các trường hợp ngộ độc thực phẩm do thịt bị ôi thiu. Phân tử X2Y có tồng số proton là 23. Biết X, Y ở hai nhóm A liên tiếp trong cùng một chu kì. Phần trăm khối lượng của Y trong oxide cao nhất của Y là bao nhiêu? Đáp án: Đáp án
Đáp án: Phương pháp giải :
Xác định X, Y dựa vào thành phần nguyên tử Lời giải chi tiết :
Tổng proton X2Y là 2.PX + PY =23 (1) 2 nhóm A liên tiếp trong 1 chu kì, ta có PX – PY =1 (2) hoặc PY – PX =1 (3) Từ (1) và (2) giải ra PX=8 (O), PY=7 (N). Công thức N2O5 \(\% {m_N} = \frac{{14.2}}{{14.2 + 16.5}}.100\% = 25,925\% \) Từ (1) và (3) giải ra PX, Py lẻ (loại)
Câu 2 :
Hợp chất X có công thức là A2B có tổng số hạt (p, n, e) là 92, trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 28. Nguyên tử nguyên tố A có số proton nhiều hơn so với nguyên tử nguyên tố B là 3. Số hạt mang điện của nguyên tử A là ? Đáp án: Đáp án
Đáp án: Phương pháp giải :
Dựa vào thành phần nguyên tử Lời giải chi tiết :
Gọi các hạt trong nguyên tử A là n1, e1, p1 Các hạt trong nguyên tử B là n2, e2, p2 Theo bài ra , ta có: 4p1 + 2n1 + 2p2 + n2 = 92 4p1 + 2p2 – 2n1 – n2 = 28 P1 – p2 = 3 Suy ra p1 = 11, p2 = 8 Vậy số hạt mang điện của A là 11+ 11 = 22
Câu 3 :
Cho các chất sau: C2H6, H2O, NH3, PF3, C2H5OH. Số chất tạo được liên kết hydrogen là? Đáp án: Đáp án
Đáp án: Phương pháp giải :
Dựa vào khái niệm liên kết hydrogen. Lời giải chi tiết :
H2O, NH3, C2H5OH chứa liên kết hydrogen.
Câu 4 :
Hai nguyên tố M và X tạo thành hợp chất có công thức là M2X. Cho biết: Tổng số proton trong hợp chất bằng 46. Trong hạt nhân của M có số hạt không mang điện nhiều hơn số hạt mang điện là 1. Trong hạt nhân của X có số hạt mang điện bằng số hạt không mang điện. Trong hợp chất M2X, nguyên tố X chiếm 17,02% về khối lượng. Liên kết M2X thuộc liên kết gì? Đáp án: Đáp án
Đáp án: Phương pháp giải :
Dựa vào thành phần nguyên tử. Lời giải chi tiết :
Ta có: 2.PM + PX = 46 (1) 2.NM – 2.PM = 1 (2) PX = NX (3) %X = \(\frac{{{P_X} + {N_X}}}{{2.({P_M} + {N_M}) + {P_X} + {N_X}}}.100 = 17.02\% \) (4) Từ (1), (2), (3), (4) ta được PM = 19; PX = 8 Vậy M là K; X là O Liên kết trong K2O là liên kết ion.
|














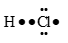
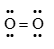
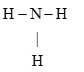
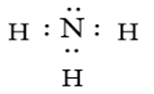








Danh sách bình luận