Đề thi giữa kì 2 Hóa 10 - Chân trời sáng tạo - Đề số 2Phát biểu nào dưới đây không đúng?Đề bài
I. Trắc nghiệm
Câu 1 :
Phát biểu nào dưới đây không đúng?
Câu 2 :
Ở điều kiện chuẩn, công thức tính biến thiên enthalpy của phản ứng theo nhiệt tạo thành là:
Câu 3 :
Cho quá trình Fe2+ \( \to \)Fe3+ + 1e, đây là quá trình
Câu 4 :
Sự khử là
Câu 5 :
Cho phương trình nhiệt hóa học: N2 (g) + O2 (g) \( \to \)2NO (g) \({\Delta _r}H_{298}^0\)=179,20 kJ. Phản ứng trên là phản ứng:
Câu 6 :
Trong phản ứng dưới đây: \(Mn{O_2} + 4HCl \to MnC{l_2} + C{l_2} + 2{H_2}O\). Nếu dùng 17,4g MnO2 thì điều chế được bao nhiêu lít khí chlorine?
Câu 7 :
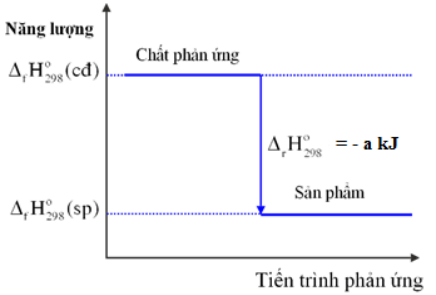
Biến thiên enthalpy của một phản ứng được ghi ở sơ đồ dưới đây. Kết luận nào sau đây là đúng
Câu 8 :
Trong phản ứng: 2FeCl3 + H2S \( \to \)2FeCl2 + S + 2HCl. Vai trò của H2S là:
Câu 9 :
Dung dịch glucose (C6H12O6) 5% có khối lượng riêng là 1,02 g/ml, phản ứng oxi hóa 1 mol glucose tạo thành CO2 (g) và H2O (l) tỏa ra nhiệt lượng là 2803,0 kJ. Một người bệnh được truyền một chai chứa 500ml dung dịch glucose 5%. Năng lượng tối đa từ phản ứng oxi hóa hoàn toàn glucose mà bệnh nhân đó có thể nhận được là
Câu 10 :
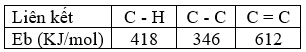
Cho giá trị trung bình của các năng lượng liên kết ở điều kiện chuẩn:
Biến thiên enthalpy của phản ứng: C3H8 (g) \( \to \)CH4(g) + C2H4(g) có giá trị là
Câu 11 :
Dựa vào phương trình nhiệt hóa học của phản ứng sau: CO2(g) \( \to \)CO(g) + ½ O2(g) \({\Delta _r}H_{298}^0\)=280kJ Giá trị \({\Delta _r}H_{298}^0\)của phản ứng: 2CO2(g) \( \to \)2CO(g) + O2(g) là:
Câu 12 :
Cho biến thiên enthalpy của phản ứng sau ở điều kiện chuẩn: 4FeS2(s) + 11O2 \( \to \)2Fe2O3(s) + 8SO2(g) Biết nhiệt tạo thành \({\Delta _f}H_{298}^0\)của FeS2(s), Fe2O3(s), và SO2(g) lần lượt là -177,9 kJ/mol, -825,5 kJ/mol và -296,8 kJ/mol. Phát biểu nào sau đây sai?
Câu 13 :
Cho nhiệt tạo thành chuẩn của các chất trong phương trình: Biến thiên enthalpy của phản ứng sau: N2O4(g) +3CO(g) \( \to \)N2O(g) + 3CO2(g)
Câu 14 :
Phương trình nhiệt hóa học cho biết thông tin nào về phản ứng hóa học:
Câu 15 :
: Trong các phát biểu sau đây có bao nhiêu phát biểu đúng? (1) Tất cả các phản ứng cháy đều tỏa nhiệt (2) Phản ứng tỏa nhiệt là phản ứng giải phóng năng lượng dưới dạng nhiệt (3) Tất cả các phản ứng mà chất tham gia có chứa nguyên tố oxygen đều tỏa nhiệt (4) Phản ứng thu nhiệt là phản ứng hấp thu năng lượng dưới dạng nhiệt (5) Lượng nhiệt mà phản ứng hấp thụ hay giải phóng không phụ thuộc vào điều kiện thực hiện phản ứng và thể (6) Sự cháy của nhiên liệu (xăng, dầu, khí gas, than, gỗ,…) là những ví dụ về phản ứng thu nhiệt vì cần phải khơi mào
II. Tự luận
Câu 2 :
: Xác định biến thiên enthalpy \({\Delta _r}H_{298}^0\)của mỗi phản ứng sau: a, Phản ứng nhiệt phân đá vôi:
b, Phản ứng đốt cháy methane:
Lời giải và đáp án
I. Trắc nghiệm
Câu 1 :
Phát biểu nào dưới đây không đúng?
Đáp án : C Phương pháp giải :
Dựa vào khái niệm về phản ứng oxi hóa khử Lời giải chi tiết :
Phản ứng oxi hóa khử là phản ứng trong đó có sự thay đổi số oxi hóa của một hoặc một số nguyên tố Đáp án C
Câu 2 :
Ở điều kiện chuẩn, công thức tính biến thiên enthalpy của phản ứng theo nhiệt tạo thành là:
Đáp án : C Phương pháp giải :
Dựa vào công thức tính biến thiên năng lượng của phản ứng Lời giải chi tiết :
\({\Delta _r}H_{298}^0 = \sum {{\Delta _f}H_{298}^0(sp) - \sum {{\Delta _f}H_{298}^0} } (c{\rm{d}})\) Đáp án C
Câu 3 :
Cho quá trình Fe2+ \( \to \)Fe3+ + 1e, đây là quá trình
Đáp án : D Phương pháp giải :
Dựa vào khái niệm về chất khử và chất oxi hóa Lời giải chi tiết :
Fe2+ \( \to \)Fe3+ + 1e: ion Fe2+ đã nhường 1 electron để trở thành ion Fe3+ => đây là chất khử có quá trình oxi hóa Đáp án D
Câu 4 :
Sự khử là
Đáp án : C Phương pháp giải :
Dựa vào khái niệm chất khử, chất oxi hóa Lời giải chi tiết :
Sự khử là quá trình nhận electron Đáp án C
Câu 5 :
Cho phương trình nhiệt hóa học: N2 (g) + O2 (g) \( \to \)2NO (g) \({\Delta _r}H_{298}^0\)=179,20 kJ. Phản ứng trên là phản ứng:
Đáp án : C Phương pháp giải :
Dựa vào dấu của \({\Delta _r}H_{298}^0\) Lời giải chi tiết :
Phản ứng trên có \({\Delta _r}H_{298}^0\)> 0 => phản ứng thu nhiệt và hấp thu 179,20 kJ nhiệt Đáp án C
Câu 6 :
Trong phản ứng dưới đây: \(Mn{O_2} + 4HCl \to MnC{l_2} + C{l_2} + 2{H_2}O\). Nếu dùng 17,4g MnO2 thì điều chế được bao nhiêu lít khí chlorine?
Đáp án : C Phương pháp giải :
Dựa vào số mol của MnO2 Lời giải chi tiết :
n MnO2 = 17,4 : 87 = 0,2 mol theo phản ứng: n MnO2 = n HCl = 0,2 mol => V Cl2 = 0,2 . 24,79 = 4,958l
Câu 7 :
Biến thiên enthalpy của một phản ứng được ghi ở sơ đồ dưới đây. Kết luận nào sau đây là đúng
Đáp án : B Phương pháp giải :
Dựa vào sơ đồ biến thiên enthalpy của phản ứng Lời giải chi tiết :
Nhiệt tạo thành của sản phẩm nhỏ hơn nhiệt tạo thành của chất tham gia nên \({\Delta _r}H_{298}^0\)của phản ứng < 0 => phản ứng tỏa nhiệt Đáp án B
Câu 8 :
Trong phản ứng: 2FeCl3 + H2S \( \to \)2FeCl2 + S + 2HCl. Vai trò của H2S là:
Đáp án : D Phương pháp giải :
Dựa vào sự thay đổi số oxi hóa H2S Lời giải chi tiết :
\({H_2}\mathop S\limits^{ - 2} \to \mathop S\limits^o + 2{\rm{e}}\)=> nhường electron => chất khử Đáp án D
Câu 9 :
Dung dịch glucose (C6H12O6) 5% có khối lượng riêng là 1,02 g/ml, phản ứng oxi hóa 1 mol glucose tạo thành CO2 (g) và H2O (l) tỏa ra nhiệt lượng là 2803,0 kJ. Một người bệnh được truyền một chai chứa 500ml dung dịch glucose 5%. Năng lượng tối đa từ phản ứng oxi hóa hoàn toàn glucose mà bệnh nhân đó có thể nhận được là
Đáp án : A Phương pháp giải :
Tính số mol glucose trong 500ml dung dịch Lời giải chi tiết :
m dung dịch glucose = 500.1,02 = 510g => m glucose = 510 . 5% = 25,5g Năng lượng tối đa từ phản ứng oxi hóa hoàn toàn glucose mà bệnh nhân đó nhận được là: \(\frac{{25,5.2830}}{{180}} = 397,09kJ\) Đáp án A
Câu 10 :
Cho giá trị trung bình của các năng lượng liên kết ở điều kiện chuẩn:
Biến thiên enthalpy của phản ứng: C3H8 (g) \( \to \)CH4(g) + C2H4(g) có giá trị là
Đáp án : C Phương pháp giải :
Dựa vào năng lượng liên kết của các chất Lời giải chi tiết :
\({\Delta _r}H_{298}^0\)= E C3H8 – E CH4 – E C2H4 = (2.EC-C + 8.E C-H ) – 4.E C-H – E C=C – 4. E C-H = 2.346 + 8.418 – 4.418 – 612 – 4.418 = 80 kJ Đáp án C
Câu 11 :
Dựa vào phương trình nhiệt hóa học của phản ứng sau: CO2(g) \( \to \)CO(g) + ½ O2(g) \({\Delta _r}H_{298}^0\)=280kJ Giá trị \({\Delta _r}H_{298}^0\)của phản ứng: 2CO2(g) \( \to \)2CO(g) + O2(g) là:
Đáp án : C Phương pháp giải :
Dựa vào \({\Delta _r}H_{298}^0\)của phản ứng Lời giải chi tiết :
Giá trị \({\Delta _r}H_{298}^0\)của phản ứng: 2CO2(g) \( \to \)3CO(g) + O2(g) là: 2. \({\Delta _r}H_{298}^0\)(1) = 2.280 = 560 kJ Đáp án C
Câu 12 :
Cho biến thiên enthalpy của phản ứng sau ở điều kiện chuẩn: 4FeS2(s) + 11O2 \( \to \)2Fe2O3(s) + 8SO2(g) Biết nhiệt tạo thành \({\Delta _f}H_{298}^0\)của FeS2(s), Fe2O3(s), và SO2(g) lần lượt là -177,9 kJ/mol, -825,5 kJ/mol và -296,8 kJ/mol. Phát biểu nào sau đây sai?
Đáp án : C Phương pháp giải :
\(\sum {{\Delta _f}H_{298}^0} \)(cđ) = 4. \({\Delta _f}H_{298}^0\)(FeS2) = 4. – 177,9 = - 711,6 kJ \(\sum {{\Delta _f}H_{298}^0} \)(sp) = 2. \({\Delta _f}H_{298}^0\)(Fe2O3) + 8. \({\Delta _f}H_{298}^0\)(SO2) = 2.(-825,5) + 8.(-296,8) = -4025,4 kJ Đáp án C
Câu 13 :
Cho nhiệt tạo thành chuẩn của các chất trong phương trình: Biến thiên enthalpy của phản ứng sau: N2O4(g) +3CO(g) \( \to \)N2O(g) + 3CO2(g)
Đáp án : A Phương pháp giải :
Dựa vào công thức tính \({\Delta _r}H_{298}^0\)của phản ứng Lời giải chi tiết :
\({\Delta _r}H_{298}^0\)= \({\Delta _f}H_{298}^0\)(N2O) + 3.\({\Delta _f}H_{298}^0\)(CO2) – 3. \({\Delta _f}H_{298}^0\)(CO) - \({\Delta _f}H_{298}^0\)(N2O4) = 82,05 + 3.(-393,5) – 3.(-110,5) – 9,16 = -776,11 kJ Đáp án A
Câu 14 :
Phương trình nhiệt hóa học cho biết thông tin nào về phản ứng hóa học:
Đáp án : D Phương pháp giải :
Dựa vào kiến thức của năng lượng hóa học Lời giải chi tiết :
Phương trình nhiệt hóa học cho biết nhiệt của phản ứng, trạng thái chất đầu và chất cuối Đáp án D
Câu 15 :
: Trong các phát biểu sau đây có bao nhiêu phát biểu đúng? (1) Tất cả các phản ứng cháy đều tỏa nhiệt (2) Phản ứng tỏa nhiệt là phản ứng giải phóng năng lượng dưới dạng nhiệt (3) Tất cả các phản ứng mà chất tham gia có chứa nguyên tố oxygen đều tỏa nhiệt (4) Phản ứng thu nhiệt là phản ứng hấp thu năng lượng dưới dạng nhiệt (5) Lượng nhiệt mà phản ứng hấp thụ hay giải phóng không phụ thuộc vào điều kiện thực hiện phản ứng và thể (6) Sự cháy của nhiên liệu (xăng, dầu, khí gas, than, gỗ,…) là những ví dụ về phản ứng thu nhiệt vì cần phải khơi mào
Đáp án : C Phương pháp giải :
Dựa vào kiến thức về năng lượng hóa học Lời giải chi tiết :
(1) đúng (2) đúng (3) sai, vì phản ứng nung KNO3 là phản ứng thu nhiệt (4) đúng (5) sai, vì thể của các chất có nhiệt tạo thành khác nhau (6) sai, sự cháy của nhiên liệu là phản ứng tỏa nhiệt Đáp án C
II. Tự luận
Lời giải chi tiết :
n Fe = 2,8 : 56 = 0,05 mol Fe + H2SO4 \( \to \)FeSO4 + H2 0,05 0,05 0,05 V H2 = 0,05 . 24,79 = 1,2395 lít 10FeSO4 + 2KMnO4 + 8H2SO4 \( \to \)5Fe2(SO4)3 + K2SO4 + 2MnSO4 + 8H2O 0,05 \( \to \) 0,01 V KMnO4 = 0,01 : 0,1 = 0,1 lít = 100ml
Câu 2 :
: Xác định biến thiên enthalpy \({\Delta _r}H_{298}^0\)của mỗi phản ứng sau: a, Phản ứng nhiệt phân đá vôi:
b, Phản ứng đốt cháy methane:
Lời giải chi tiết :
a) \({\Delta _r}H_{298}^0\)= \({\Delta _f}H_{298}^0\)(CaO) + \({\Delta _f}H_{298}^0\)(CO2) - \({\Delta _f}H_{298}^0\)(CaCO3) = (-635,1) + (-393,5) – (-1206,9) = 178,3 kJ b) \({\Delta _r}H_{298}^0\)= E CH4 + 2. E O2 – E CO2 – 2. E H2O = 4. E C-H + 2. EO=O – 2. E C=O – 2. 2. E O-H = 4.418 + 2.494 – 2.732 – 4.459 = -640 kJ
|















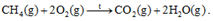








Danh sách bình luận