Đề thi học kì 2 Hóa 10 Chân trời sáng tạo - Đề số 8Xét phản ứng đốt cháy methane:Đề bài
I. Trắc nghiệm
Câu 1 :
Xét phản ứng đốt cháy methane: CH4(g) + 2O2(g) ⟶ CO2(g) + 2H2O(l) \({\Delta _r}H_{298}^o\) = – 890,3 kJ Biết nhiệt tạo thành chuẩn của CO2(g) và H2O(l) tương ứng là – 393,5 và – 285,8 kJ/mol. Nhiệt tạo thành chuẩn của khí methane là
Câu 2 :
Cho phản ứng sau: CH4(g) + Cl2(g) → CH3Cl(g) + HCl(g) Biến thiên enthalpy chuẩn của phản ứng trên tính theo năng lượng liên kết là
Câu 3 :
Tốc độ trung bình của phản ứng là
Câu 4 :
Cho phản ứng hoá học: Zn(s) + 2HCl(aq) → ZnCl2(aq) + H2(g) Sau 40 giây, nồng độ của HCl giảm từ 0,6M về 0,4M. Tốc độ trung bình của phản ứng theo nồng độ HCl trong 40 giây là
Câu 5 :
Phát biểu nào sau đây không đúng?
Câu 6 :
Dùng bình chứa oxygen thay cho dùng không khí để đốt cháy acetylene. Yếu tố ảnh hưởng đến tốc độ của quá trình biến đổi này là
Câu 7 :
Khi nhiệt độ tăng thêm 10oC, tốc độ phản ứng hoá học tăng thêm 2 lần. Tốc độ phản ứng sẽ giảm đi bao nhiêu lần nhiệt khi nhiệt độ giảm từ 70oC xuống 40oC?
Câu 8 :
Các enzyme là chất xúc tác, có chức năng:
Câu 9 :
Khí oxygen được điều chế trong phòng thí nghiệm bằng cách nhiệt phân potassium chlorate với xúc tác manganes dioxide. Để thí nghiệm thành công và rút ngắn thời gian tiến hành có thể dùng một số biện pháp sau: (1) Trộn đều bột potassium chlorate và xúc tác. (2) Nung ở nhiệt độ cao. (3) Dùng phương pháp dời nước để thu khí oxygen. (4) Nghiền nhỏ potassium chlorate. Số biện pháp dùng để tăng tốc độ phản ứng là
Câu 10 :
Vị trí nhóm halogen trong bảng tuần hoàn là
Câu 11 :
Nguyên tử chlorine không có khả năng thể hiện số oxi hoá
Câu 12 :
Chất nào dưới đây có sự thăng hoa khi đun nóng?
Câu 13 :
Cho phản ứng tổng quát sau: X2(g) + 2KBr(aq) → 2KX(aq) + Br2(aq) X có thể là chất nào sau đây?
Câu 14 :
Chọn phương trình phản ứng đúng?
Câu 15 :
Liên kết trong hợp chất hydrogen halide là
Câu 16 :
Phản ứng giữa chất nào sau đây với dung dịch H2SO4 đặc, nóng không phải là phản ứng oxi hóa – khử?
Câu 17 :
Hoá chất dùng để phân biệt hai dung dịch NaI và KCl là
II. Câu hỏi đúng sai
Câu 1 :
Cho các phát biểu sau: a) Hydrochloric acid được sử dụng cho quá trình thuỷ phân các chất trong sản xuất, chế biến thực phẩm.
Đúng
Sai
b) Hydrofluoric acid hoặc hydrogen fluoride phản ứng với chlorine dùng để sản xuất fluorine.
Đúng
Sai
c) Trong công nghiệp, hydrofluoric acid dùng tẩy rửa các oxide của sắt trên bề mặt của thép.
Đúng
Sai
d) Hydrogen fluoride được dùng để sản xuất chất làm lạnh hydrochlorofluorocarbon HCFC (thay thế chất CFC), chất chảy cryolite, …
Đúng
Sai
Câu 2 :
Cho các phát biểu sau a) Trong phản ứng điều chế nước Javel bằng chlorine và sodium hydroxide, chlorine vừa đóng vai trò chất oxi hoá, vừa đóng vai trò chất khử.
Đúng
Sai
b) Fluorine có số oxi hoá bằng -1 trong các hợp chất.
Đúng
Sai
c) Tất cả các muối halide của bạc (AgF, AgCl, AgBr, AgI) đều là những chất không tan trong nước ở nhiệt độ thường.
Đúng
Sai
d) Ở cùng điều kiện áp suất, hydrogen fluoride (HF) có nhiệt độ sôi cao nhất trong các hydrogen halide là do liên kết H – F bền nhất trong các liên kết H – X.
Đúng
Sai
Câu 3 :
Cho các phát biểu sau a) Tốc độ của mọi phản ứng hóa học đều tuân theo định luật tác dụng khối lượng.
Đúng
Sai
b) Hằng số tốc độ phản ứng là tốc độ của phản ứng khi nồng độ của tất cả các chất trong hỗn hợp phản ứng đều bằng nhau và bằng 1.
Đúng
Sai
c) Hằng số tốc độ của phản ứng phụ thuộc vào thời gian.
Đúng
Sai
d) Hằng số tốc độ phản ứng là tốc độ của phản ứng khi nồng độ các chất phản ứng bằng nhau và bằng 1 M.
Đúng
Sai
Câu 4 :
Cho biết phản ứng tạo thành 2 mol HCl(g) ở điều kiện chuẩn tỏa ra 184,6 kJ \({H_2}(g) + C{l_2}(g) \to 2HCl(g)\)(1) a) Nhiệt tạo thành chuẩn của HCl (g) là -184,6 kJ/mol
Đúng
Sai
b) Biến thiên enthalpy chuẩn của phản ứng (1) là -184,6 kJ
Đúng
Sai
c) Nhiệt tạo thành chuẩn của HCl(g) là -92,3 kJ/mol
Đúng
Sai
d) Biến thiên enthalpy chuẩn của phản ứng (1) là -92,3 kJ.
Đúng
Sai
III. Tự luận
Lời giải và đáp án
I. Trắc nghiệm
Câu 1 :
Xét phản ứng đốt cháy methane: CH4(g) + 2O2(g) ⟶ CO2(g) + 2H2O(l) \({\Delta _r}H_{298}^o\) = – 890,3 kJ Biết nhiệt tạo thành chuẩn của CO2(g) và H2O(l) tương ứng là – 393,5 và – 285,8 kJ/mol. Nhiệt tạo thành chuẩn của khí methane là
Đáp án : A Phương pháp giải :
Dựa vào công thức tính \({\Delta _r}H_{298}^o\) Lời giải chi tiết :
Câu 2 :
Cho phản ứng sau: CH4(g) + Cl2(g) → CH3Cl(g) + HCl(g) Biến thiên enthalpy chuẩn của phản ứng trên tính theo năng lượng liên kết là
Đáp án : C Phương pháp giải :
Dựa vào công thức tính \({\Delta _r}H_{298}^o\)theo năng lượng liên kết Lời giải chi tiết :
\({\Delta _r}H_{298}^o\)= Eb(CH4) + Eb(Cl2) – Eb(CH3Cl) – Eb(HCl) Đáp án C
Câu 3 :
Tốc độ trung bình của phản ứng là
Đáp án : B Phương pháp giải :
Dựa vào khái niệm của tốc độ phản ứng Lời giải chi tiết :
Tốc độ trung bình của phản ứng là tốc độ được tính trong một khoảng thời gian phản ứng Đáp án B
Câu 4 :
Cho phản ứng hoá học: Zn(s) + 2HCl(aq) → ZnCl2(aq) + H2(g) Sau 40 giây, nồng độ của HCl giảm từ 0,6M về 0,4M. Tốc độ trung bình của phản ứng theo nồng độ HCl trong 40 giây là
Đáp án : C Phương pháp giải :
Dựa vào công thức tính tốc độ phản ứng Lời giải chi tiết :
\(v = \frac{1}{2}.\frac{{0,6 - 0,4}}{{40}} = 0,0025M/s\) Đáp án C
Câu 5 :
Phát biểu nào sau đây không đúng?
Đáp án : B Phương pháp giải :
Dựa vào kiến thức về tốc độ phản ứng Lời giải chi tiết :
Tốc độ phản ứng luôn dương Đáp án B
Câu 6 :
Dùng bình chứa oxygen thay cho dùng không khí để đốt cháy acetylene. Yếu tố ảnh hưởng đến tốc độ của quá trình biến đổi này là
Đáp án : C Phương pháp giải :
Dựa vào các yếu tố ảnh hưởng đến tốc độ phản ứng Lời giải chi tiết :
Dùng bình chứa oxygen làm tăng nồng độ oxygen để đốt cháy acetylene Đáp án C
Câu 7 :
Khi nhiệt độ tăng thêm 10oC, tốc độ phản ứng hoá học tăng thêm 2 lần. Tốc độ phản ứng sẽ giảm đi bao nhiêu lần nhiệt khi nhiệt độ giảm từ 70oC xuống 40oC?
Đáp án : A Phương pháp giải :
Dựa vào hệ số nhiệt độ Van’t Hoff Lời giải chi tiết :
\(\frac{{{v_{{{70}^o}C}}}}{{{v_{{{40}^o}C}}}} = {\gamma ^{\frac{{(70 - 40)}}{{10}}}} = {2^3} = 8\) Khi giảm nhiệt độ xuống tốc độ phản ứng giảm 8 lần Đáp án A
Câu 8 :
Các enzyme là chất xúc tác, có chức năng:
Đáp án : A Phương pháp giải :
Dựa vào khái niệm về chất xúc tác Lời giải chi tiết :
Các enzyme là chất xúc tác có chức năng làm giảm năng lượng hoạt hóa của phản ứng
Câu 9 :
Khí oxygen được điều chế trong phòng thí nghiệm bằng cách nhiệt phân potassium chlorate với xúc tác manganes dioxide. Để thí nghiệm thành công và rút ngắn thời gian tiến hành có thể dùng một số biện pháp sau: (1) Trộn đều bột potassium chlorate và xúc tác. (2) Nung ở nhiệt độ cao. (3) Dùng phương pháp dời nước để thu khí oxygen. (4) Nghiền nhỏ potassium chlorate. Số biện pháp dùng để tăng tốc độ phản ứng là
Đáp án : B Phương pháp giải :
Dựa vào các yếu tố ảnh hưởng đến tốc độ phản ứng Lời giải chi tiết :
(1), (2), (4) là các biện pháp làm tăng tốc độ phản ứng Đáp án B
Câu 10 :
Vị trí nhóm halogen trong bảng tuần hoàn là
Đáp án : C Lời giải chi tiết :
Nhóm Halogen nằm ở nhóm VIIA trong bảng tuần hoàn Đáp án C
Câu 11 :
Nguyên tử chlorine không có khả năng thể hiện số oxi hoá
Đáp án : D Phương pháp giải :
Dựa vào số oxi hóa của nguyên tử chlorine Lời giải chi tiết :
Nguyên tử chlorine không thể hiện số oxi hóa +2 Đáp án D
Câu 12 :
Chất nào dưới đây có sự thăng hoa khi đun nóng?
Đáp án : B Phương pháp giải :
Dựa vào trạng thái của nguyên tố halogen Lời giải chi tiết :
I2 có sự thăng hoa khi đun nóng Đáp án B
Câu 13 :
Cho phản ứng tổng quát sau: X2(g) + 2KBr(aq) → 2KX(aq) + Br2(aq) X có thể là chất nào sau đây?
Đáp án : A Phương pháp giải :
Dựa vào khả năng tham gia phản ứng khử của nguyên tử halogen Lời giải chi tiết :
X2 là Cl2 vì tính khử của Cl2 mạnh hơn Br- Đáp án A
Câu 14 :
Chọn phương trình phản ứng đúng?
Đáp án : A Phương pháp giải :
Dựa vào tính chất của acid HCl Lời giải chi tiết :
Fe + 2HCl → FeCl2 + H2 đúng Đáp án A
Câu 15 :
Liên kết trong hợp chất hydrogen halide là
Đáp án : D Phương pháp giải :
Dựa vào độ âm điện của halogen với hydrogen Lời giải chi tiết :
Liên kết trong hợp chất hydrogen halide là liên kết cộng hóa trị phân cực Đáp án D
Câu 16 :
Phản ứng giữa chất nào sau đây với dung dịch H2SO4 đặc, nóng không phải là phản ứng oxi hóa – khử?
Đáp án : C Phương pháp giải :
H2SO4 đặc nóng thể hiện tính oxi hóa mạnh khi tác dụng với chất khử sẽ tạo nên phản ứng oxi hóa khử Lời giải chi tiết :
NaCl khi phản ứng với H2SO4 đặc nóng không thay đổi số oxi hóa Đáp án C
Câu 17 :
Hoá chất dùng để phân biệt hai dung dịch NaI và KCl là
Đáp án : C Phương pháp giải :
Dựa vào màu sắc của kết tủa gốc ion I- và Cl- Lời giải chi tiết :
AgNO3 là thuốc thử để phân biệt NaI và KCl vì AgI có màu vàng đậm, AgCl có màu trắng
II. Câu hỏi đúng sai
Câu 1 :
Cho các phát biểu sau: a) Hydrochloric acid được sử dụng cho quá trình thuỷ phân các chất trong sản xuất, chế biến thực phẩm.
Đúng
Sai
b) Hydrofluoric acid hoặc hydrogen fluoride phản ứng với chlorine dùng để sản xuất fluorine.
Đúng
Sai
c) Trong công nghiệp, hydrofluoric acid dùng tẩy rửa các oxide của sắt trên bề mặt của thép.
Đúng
Sai
d) Hydrogen fluoride được dùng để sản xuất chất làm lạnh hydrochlorofluorocarbon HCFC (thay thế chất CFC), chất chảy cryolite, …
Đúng
Sai
Đáp án
a) Hydrochloric acid được sử dụng cho quá trình thuỷ phân các chất trong sản xuất, chế biến thực phẩm.
Đúng
Sai
b) Hydrofluoric acid hoặc hydrogen fluoride phản ứng với chlorine dùng để sản xuất fluorine.
Đúng
Sai
c) Trong công nghiệp, hydrofluoric acid dùng tẩy rửa các oxide của sắt trên bề mặt của thép.
Đúng
Sai
d) Hydrogen fluoride được dùng để sản xuất chất làm lạnh hydrochlorofluorocarbon HCFC (thay thế chất CFC), chất chảy cryolite, …
Đúng
Sai
Lời giải chi tiết :
a) đúng b) sai, F2 được sản xuất từ điện phân dung dịch KF, HF c) sai, HCl được dùng để tẩy rửa các oxide của sắt trên bề mặt của thép d) đúng
Câu 2 :
Cho các phát biểu sau a) Trong phản ứng điều chế nước Javel bằng chlorine và sodium hydroxide, chlorine vừa đóng vai trò chất oxi hoá, vừa đóng vai trò chất khử.
Đúng
Sai
b) Fluorine có số oxi hoá bằng -1 trong các hợp chất.
Đúng
Sai
c) Tất cả các muối halide của bạc (AgF, AgCl, AgBr, AgI) đều là những chất không tan trong nước ở nhiệt độ thường.
Đúng
Sai
d) Ở cùng điều kiện áp suất, hydrogen fluoride (HF) có nhiệt độ sôi cao nhất trong các hydrogen halide là do liên kết H – F bền nhất trong các liên kết H – X.
Đúng
Sai
Đáp án
a) Trong phản ứng điều chế nước Javel bằng chlorine và sodium hydroxide, chlorine vừa đóng vai trò chất oxi hoá, vừa đóng vai trò chất khử.
Đúng
Sai
b) Fluorine có số oxi hoá bằng -1 trong các hợp chất.
Đúng
Sai
c) Tất cả các muối halide của bạc (AgF, AgCl, AgBr, AgI) đều là những chất không tan trong nước ở nhiệt độ thường.
Đúng
Sai
d) Ở cùng điều kiện áp suất, hydrogen fluoride (HF) có nhiệt độ sôi cao nhất trong các hydrogen halide là do liên kết H – F bền nhất trong các liên kết H – X.
Đúng
Sai
Lời giải chi tiết :
a) đúng b) đúng c) sai, AgF tan trong nước d) đúng
Câu 3 :
Cho các phát biểu sau a) Tốc độ của mọi phản ứng hóa học đều tuân theo định luật tác dụng khối lượng.
Đúng
Sai
b) Hằng số tốc độ phản ứng là tốc độ của phản ứng khi nồng độ của tất cả các chất trong hỗn hợp phản ứng đều bằng nhau và bằng 1.
Đúng
Sai
c) Hằng số tốc độ của phản ứng phụ thuộc vào thời gian.
Đúng
Sai
d) Hằng số tốc độ phản ứng là tốc độ của phản ứng khi nồng độ các chất phản ứng bằng nhau và bằng 1 M.
Đúng
Sai
Đáp án
a) Tốc độ của mọi phản ứng hóa học đều tuân theo định luật tác dụng khối lượng.
Đúng
Sai
b) Hằng số tốc độ phản ứng là tốc độ của phản ứng khi nồng độ của tất cả các chất trong hỗn hợp phản ứng đều bằng nhau và bằng 1.
Đúng
Sai
c) Hằng số tốc độ của phản ứng phụ thuộc vào thời gian.
Đúng
Sai
d) Hằng số tốc độ phản ứng là tốc độ của phản ứng khi nồng độ các chất phản ứng bằng nhau và bằng 1 M.
Đúng
Sai
Lời giải chi tiết :
a) sai, các phản ứng đơn giản tuân theo định luật tác dụng khối lượng b) sai, Hằng số tốc độ phản ứng có giá trị đúng bằng tốc độ phản ứng khi nồng độ các chất phản ứng bằng nhau và bằng 1 M. c) sai, hằng số tốc độ phản ứng phụ thuộc vào nhiệt độ và bản chất của chất tham gia d) đúng
Câu 4 :
Cho biết phản ứng tạo thành 2 mol HCl(g) ở điều kiện chuẩn tỏa ra 184,6 kJ \({H_2}(g) + C{l_2}(g) \to 2HCl(g)\)(1) a) Nhiệt tạo thành chuẩn của HCl (g) là -184,6 kJ/mol
Đúng
Sai
b) Biến thiên enthalpy chuẩn của phản ứng (1) là -184,6 kJ
Đúng
Sai
c) Nhiệt tạo thành chuẩn của HCl(g) là -92,3 kJ/mol
Đúng
Sai
d) Biến thiên enthalpy chuẩn của phản ứng (1) là -92,3 kJ.
Đúng
Sai
Đáp án
a) Nhiệt tạo thành chuẩn của HCl (g) là -184,6 kJ/mol
Đúng
Sai
b) Biến thiên enthalpy chuẩn của phản ứng (1) là -184,6 kJ
Đúng
Sai
c) Nhiệt tạo thành chuẩn của HCl(g) là -92,3 kJ/mol
Đúng
Sai
d) Biến thiên enthalpy chuẩn của phản ứng (1) là -92,3 kJ.
Đúng
Sai
Lời giải chi tiết :
(a) sai, vì phản ứng tạo 2 mol HCl (b) đúng (c) đúng (d) sai
III. Tự luận
Lời giải chi tiết :
2NaCl ( tt) + H2SO4 đ \( \to \) Na2SO4 + 2 HCl 4 HCl + MnO2 \( \to \)MnCl2 + Cl2 + H2O Cl2 + 2KBr \( \to \) 2KCl + Br2 Br2 + 2 KI \( \to \) 2KBr + I2 Lời giải chi tiết :
nCl2 = 9,916/24,79 = 0,4 mol MnO2 +4HClđặc\( \to \)MnCl2 +Cl2 +2H2O 0,4 \( \to \) 0,4 (mol) MnO2 : chất oxi hóa ; HCl : chất khử m MnO2 = 0,4 x 87 = 34,8gam Lời giải chi tiết :
nB =\(\frac{{0,4958}}{{24,79}}\) = 0,02 mol Gọi số mol MgCO3 là x (mol), số mol Zn là y (mol). Phương trình hoá học: MgCO3 + 2HCl → MgCl2 + CO2 + H2O x 2x x x mol Zn + 2HCl → ZnCl2 + H2 y 2y y y mol Ta có hệ phương trình:
Lời giải chi tiết :
a) \({v_1} = \frac{{\Delta C}}{{{t_1}}};{\rm{ }}{v_2} = \frac{{\Delta C}}{{{t_2}}}{\rm{ }} \to {\rm{ }}\frac{{{v_2}}}{{{v_1}}} = \frac{{{t_1}}}{{{t_2}}}\) \(\frac{{{v_{{t_2}}}}}{{{v_{{t_1}}}}} = {\gamma ^{\frac{{{t_2} - {t_1}}}{{10}}}}{\rm{ }} \Leftrightarrow {\rm{ }}\frac{{3,8}}{{3,2}} = {\gamma ^{\frac{{100 - 90}}{{10}}}}{\rm{ }} \to {\rm{ }}\gamma = 1,1875\) b) \(\frac{{{v_{90}}}}{{{v_{80}}}} = \frac{{{t_{80}}}}{{{t_{90}}}} = {\gamma ^{\frac{{{t_2} - {t_1}}}{{10}}}}{\rm{ }} \Leftrightarrow {\rm{ }}\frac{{{t_{80}}}}{{3,8}} = 1,{1875^{\frac{{90 - 80}}{{10}}}}{\rm{ }} \to {\rm{ }}{t_{80}} = {\rm{ 4,5 min}}\)
|














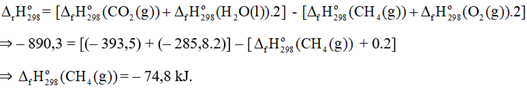
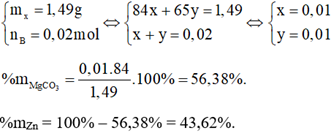










Danh sách bình luận