Đề thi giữa kì 2 Hóa 10 - Chân trời sáng tạo - Đề số 1Chromium có số oxi hóa +2 trong hợp chất nào sau đây?Đề bài
I. Trắc nghiệm
Câu 1 :
Chromium có số oxi hóa +2 trong hợp chất nào sau đây?
Câu 2 :
Hệ số cân bằng (nguyên, tối giản) của Cu2S và HNO3 trong phản ứng: Cu2S + HNO3 → Cu(NO3)2 + H2SO4 + NO + H2O là
Câu 3 :
Cho các phản ứng sau: (a) 4HCl + PbO2 \( \to \)PbCl2 + Cl2 + 2H2O (b) HCl + NH4HCO3 \( \to \)NH4Cl + CO2 + H2O (c) 2HCl + 2HNO3 \( \to \)2NO2 + Cl2 + 2H2O (d) 2HCl + Zn \( \to \)ZnCl2 + H2 Số phản ứng trong đó HCl thể hiện tính khử là
Câu 4 :
Thuốc tím chứa ion permanganate (MnO4-) có tính oxi hóa mạnh, được dùng để sát trùng, diệt khuẩn trong y học, đời sống và nuôi trồng thủy sản. Số oxi hóa của mangase trong ion permanganate là:
Câu 5 :
Dẫn khí SO2 vào 100ml dung dịch KMnO4 0,02M đến khi dung dịch vừa mất màu tím. Phản ứng xảy ra theo sơ đồ sau: SO2 + KMnO4 + H2O → H2SO4 + K2SO4 + MnSO4 Thể tích khí SO2 đã tham gia phản ứng ở điều kiện chuẩn là:
Câu 6 :
Số quá trình thu nhiệt trong các quá trình sau: (1) Nước hóa rắn (2) Sự tiêu hóa thức ăn (3) Qúa trình chạy của con người (4) Khí CH4 đốt ở trong lò (5) Hòa tan KBr vào nước làm cho nước trở nên lạnh (6) Sulfuric acid đặc khi thêm vào nước làm cho nước nóng lên.
Câu 7 :
Điều kiện nào sau đây không phải là điều kiện chuẩn?
Câu 8 :
Dựa vào phương trình hóa học của các phản ứng sau: (1) CS2(l) + 3O2(g) \( \to \)CO2(g) + 2SO2(g) \({\Delta _r}H_{298}^0\)= -1110,21 kJ (2) CO2(g) \( \to \)CO(g) + ½ O2(g) \({\Delta _r}H_{298}^0\)=280,00 kJ (3) Na(s) + 2H2O(l) \( \to \)NaOH(aq) + H2(g) \({\Delta _r}H_{298}^0\)= -367,50 kJ (4) ZnSO4(s) \( \to \)ZnO(s) + SO3(g) \({\Delta _r}H_{298}^0\) = 235,21 kJ Cặp phản ứng thu nhiệt là:
Câu 9 :
Bình “ga” loại 12 cân sử dụng trong hộ gia đình Y có chứa 12 kg khí hóa lỏng (LPG) gồm propane và butane với tỉ lệ mol tương ứng là 2 : 3. Khi đốt cháy hoàn toàn, 1 mol propane (C3H8) tỏa ra lượng nhiệt là 2220 kJ và 1 mol butane (C4H10) tỏa ra lượng nhiệt là 2850 kJ. Trung bình, lượng nhiệt tiêu thụ từ đốt khí “ga” của hộ gia đình Y là 10 000 kJ/ngày và hiệu suất sử dụng nhiệt là 67,3%. Sau bao nhiêu ngày hộ gia đình Y sử dụng hết bình ga trên?
Câu 10 :
Để xác định hàm lượng S trong một loại nhiên liệu, người ta tiến hành đốt cháy 10 gam mẫu nhiên liệu đó, sau đó cho toàn bộ lượng khí SO2 sinh ra vào dung dịch KMnO4 0,1M, thì thấy thể tích dung dịch KMnO4 phản ứng vừa đủ là 5 mL. Biết trong phản ứng trên, Mn+7 đã bị khử thành Mn+2. Phần trăm khối lượng S trong loại nhiên liệu trên là:
Câu 11 :
Cho phản ứng: C2H6(g) + Cl2(g) \( \to \)C2H5Cl(g) + HCl (g). Biết
\({\Delta _r}H_{298}^0\)của phản ứng là:
Câu 12 :
Phản ứng của 1 mol ethanol lỏng với oxygen xảy ra theo phương trình: \({C_2}{H_5}{\rm{O}}H(l) + {O_2}(g) \to C{O_2}(g) + {H_2}{\rm{O}}(l)(1)\) Những nhận định nào sau đây là đúng? (1) Đây là phản ứng tỏa nhiệt vì nó tạo ra khí CO2 và nước lỏng (2) Đây là phản ứng oxi hóa – khử với tổng số hệ số cân bằng trong phương trình là 9 (3) Biến thiên enthalpy chuẩn của phản ứng sẽ thay đổi nếu nước tạo ra ở thể khí (4) Sản phẩm của phản ứng chiếm một thể tích lớn hơn so với chất phản ứng
Câu 13 :
Kim loại nhôm có thể khử được oxide của nhiều nguyên tố. Dựa vào bảng enthalpy tạo thành chuẩn của các chất biết \({\Delta _f}H_{298}^0\)của Fe3O4 và Al2O3 lần lượt là -1118,4 và -1675,7 kJ/mol biến thiên enthalpy của phản ứng nhôm khử 1 mol Fe3O4(s) là:
Câu 14 :
Phản ứng giữa 2 mol khí hydrogen và 1 mol khí oxygen tạo thành 2 mol H2O lỏng, giải phóng nhiệt lượng 571,68 kJ. Phương trình nhiệt hóa học được biểu diễn là
Câu 15 :
Ở điều kiện chuẩn, cần phải cung cấp 26,48 kJ nhiệt lượng cho quá trình ½ mol H2(g) phản ứng với ½ mol I2 (s) để thu được 1 mol HI(s). Ta nói enthalpy tạo thành của HI (g) ở điều kiện chuẩn là 26,48 kJ/mol. Phản ứng trên được biểu diễn như sau: \(\frac{1}{2}{H_2}(g) + \frac{1}{2}{I_2}(s) \to HI(g){\rm{ }}{\Delta _{\rm{f}}}{\rm{H}}_{298}^0 = 26,48kJ/mol\) ở cùng điều kiện phản ứng, nếu thu được 3 mol HI thì lượng nhiệt cần thu vào là:
II. Tự luận
Lời giải và đáp án
I. Trắc nghiệm
Câu 1 :
Chromium có số oxi hóa +2 trong hợp chất nào sau đây?
Đáp án : C Phương pháp giải :
Dựa vào quy tắc xác định số oxi hóa Lời giải chi tiết :
Cr có số oxi hóa + 2 trong hợp chất CrCl2 Đáp án C
Câu 2 :
Hệ số cân bằng (nguyên, tối giản) của Cu2S và HNO3 trong phản ứng: Cu2S + HNO3 → Cu(NO3)2 + H2SO4 + NO + H2O là
Đáp án : A Phương pháp giải :
Dựa vào phương pháp thăng bằng electron Lời giải chi tiết :
\(\begin{array}{l}{(C{u_2}S)^o} \to 2C{u^{ + 2}} + {S^{ + 6}} + 10e|x3\\{N^{ + 5}} + 3e \to {N^{ + 2}}|x10\end{array}\) 3Cu2S + 22HNO3 → 6Cu(NO3)2 + 3H2SO4 + 10NO + 8H2O Hệ số cân bằng tối giẩn của Cu2S và HNO3 là 3 và 22 Đáp án A
Câu 3 :
Cho các phản ứng sau: (a) 4HCl + PbO2 \( \to \)PbCl2 + Cl2 + 2H2O (b) HCl + NH4HCO3 \( \to \)NH4Cl + CO2 + H2O (c) 2HCl + 2HNO3 \( \to \)2NO2 + Cl2 + 2H2O (d) 2HCl + Zn \( \to \)ZnCl2 + H2 Số phản ứng trong đó HCl thể hiện tính khử là
Đáp án : A Phương pháp giải :
Chất khử là chất nhường electron Lời giải chi tiết :
(a), (c) HCl thể hiện tính khử Đáp án A
Câu 4 :
Thuốc tím chứa ion permanganate (MnO4-) có tính oxi hóa mạnh, được dùng để sát trùng, diệt khuẩn trong y học, đời sống và nuôi trồng thủy sản. Số oxi hóa của mangase trong ion permanganate là:
Đáp án : C Phương pháp giải :
Dựa vào quy tắc xác định số oxi hóa Lời giải chi tiết :
Số oxi hóa của Mn trong MnO4- là: x + 4.(-2) = -1 => x = +7 Đáp án C
Câu 5 :
Dẫn khí SO2 vào 100ml dung dịch KMnO4 0,02M đến khi dung dịch vừa mất màu tím. Phản ứng xảy ra theo sơ đồ sau: SO2 + KMnO4 + H2O → H2SO4 + K2SO4 + MnSO4 Thể tích khí SO2 đã tham gia phản ứng ở điều kiện chuẩn là:
Đáp án : C Phương pháp giải :
Dựa vào phương pháp thăng bằng electron Lời giải chi tiết :
\(\begin{array}{l}{S^{ + 4}} \to {S^{ + 6}} + 2e|x5\\M{n^{ + 7}} + 5{\rm{e}} \to M{n^{ + 2}}|x2\end{array}\) 5SO2 + 2KMnO4 + 2H2O → 2H2SO4 + K2SO4 + 2MnSO4 n KMnO4 = 0,1 . 0,02 = 0,002 mol Theo phản ứng: n SO2 = 5/2 n KMnO4 = 5/2 . 0,002 = 0,005 mol V SO2 = 0,005 . 24,79 = 0,124 lít Đáp án C
Câu 6 :
Số quá trình thu nhiệt trong các quá trình sau: (1) Nước hóa rắn (2) Sự tiêu hóa thức ăn (3) Qúa trình chạy của con người (4) Khí CH4 đốt ở trong lò (5) Hòa tan KBr vào nước làm cho nước trở nên lạnh (6) Sulfuric acid đặc khi thêm vào nước làm cho nước nóng lên.
Đáp án : B Phương pháp giải :
Quá trình thu nhiệt là quá trình hấp thu năng lượng dưới dạng nhiệt Lời giải chi tiết :
(1), (5) là quá trình thu nhiệt Đáp án B
Câu 7 :
Điều kiện nào sau đây không phải là điều kiện chuẩn?
Đáp án : D Phương pháp giải :
Điều kiện chuẩn được thực hiện ở áp suất 1 bar và nhiệt độ 25oC hay 298K Lời giải chi tiết :
Áp suất 1 bar và nhiệt độ 25K không phải là điều kiện chuẩn Đáp án D
Câu 8 :
Dựa vào phương trình hóa học của các phản ứng sau: (1) CS2(l) + 3O2(g) \( \to \)CO2(g) + 2SO2(g) \({\Delta _r}H_{298}^0\)= -1110,21 kJ (2) CO2(g) \( \to \)CO(g) + ½ O2(g) \({\Delta _r}H_{298}^0\)=280,00 kJ (3) Na(s) + 2H2O(l) \( \to \)NaOH(aq) + H2(g) \({\Delta _r}H_{298}^0\)= -367,50 kJ (4) ZnSO4(s) \( \to \)ZnO(s) + SO3(g) \({\Delta _r}H_{298}^0\) = 235,21 kJ Cặp phản ứng thu nhiệt là:
Đáp án : D Phương pháp giải :
Phản ứng thu nhiệt có \({\Delta _r}H_{298}^0\)> 0 Lời giải chi tiết :
(2), (4) có \({\Delta _r}H_{298}^0\)> 0 => phản ứng thu nhiệt Đáp án D
Câu 9 :
Bình “ga” loại 12 cân sử dụng trong hộ gia đình Y có chứa 12 kg khí hóa lỏng (LPG) gồm propane và butane với tỉ lệ mol tương ứng là 2 : 3. Khi đốt cháy hoàn toàn, 1 mol propane (C3H8) tỏa ra lượng nhiệt là 2220 kJ và 1 mol butane (C4H10) tỏa ra lượng nhiệt là 2850 kJ. Trung bình, lượng nhiệt tiêu thụ từ đốt khí “ga” của hộ gia đình Y là 10 000 kJ/ngày và hiệu suất sử dụng nhiệt là 67,3%. Sau bao nhiêu ngày hộ gia đình Y sử dụng hết bình ga trên?
Đáp án : C Lời giải chi tiết :
Gọi số mol của C3H8 và C4H10 lần lượt là 2a và 3a m C3H8 + m C4H10 = 12.103 => 44.2a + 58.3a = 12.103 => a = 45,801 mol => n C3H8 = 91,6 mol; n C4H10 = 137,4 mol Nhiệt lượng tỏa ra khi đốt cháy khí gas trong bình là: 91,6.2220 + 137,4.2850 = 594942 kJ Số ngày sử dụng hộ gia đình hết bình gas là: 594942.67,3% : 10 000 = 40 ngày Đáp án C
Câu 10 :
Để xác định hàm lượng S trong một loại nhiên liệu, người ta tiến hành đốt cháy 10 gam mẫu nhiên liệu đó, sau đó cho toàn bộ lượng khí SO2 sinh ra vào dung dịch KMnO4 0,1M, thì thấy thể tích dung dịch KMnO4 phản ứng vừa đủ là 5 mL. Biết trong phản ứng trên, Mn+7 đã bị khử thành Mn+2. Phần trăm khối lượng S trong loại nhiên liệu trên là:
Đáp án : A Phương pháp giải :
Dựa vào phản ứng oxi hóa khử Lời giải chi tiết :
n KMnO4 = 5.10-3 . 0,1 = 5.10-4 mol 5SO2 + 2KMnO4 + 2H2O → 2H2SO4 + K2SO4 + 2MnSO4 12,5.10-4 5.10-4 %S = \(\frac{{12,{{5.10}^{ - 4}}.32}}{{10}}.100 = 0,4\% \) Đáp án A
Câu 11 :
Cho phản ứng: C2H6(g) + Cl2(g) \( \to \)C2H5Cl(g) + HCl (g). Biết
\({\Delta _r}H_{298}^0\)của phản ứng là:
Đáp án : C Phương pháp giải :
Dựa vào công thức tính \({\Delta _r}H_{298}^0\)theo năng lượng liên kết của các chất Lời giải chi tiết :
\({\Delta _r}H_{298}^0\)= E C2H6 + E Cl2 – E C2H5Cl – E HCl = E C-C + 6. E C-H + E Cl – Cl – E C-C – E C – Cl – 5. E C – H - E H-Cl = 347 + 6. 414 + 243 – 347 – 339 – 5.414 – 432 = - 114 kJ. Đáp án C
Câu 12 :
Phản ứng của 1 mol ethanol lỏng với oxygen xảy ra theo phương trình: \({C_2}{H_5}{\rm{O}}H(l) + {O_2}(g) \to C{O_2}(g) + {H_2}{\rm{O}}(l)(1)\) Những nhận định nào sau đây là đúng? (1) Đây là phản ứng tỏa nhiệt vì nó tạo ra khí CO2 và nước lỏng (2) Đây là phản ứng oxi hóa – khử với tổng số hệ số cân bằng trong phương trình là 9 (3) Biến thiên enthalpy chuẩn của phản ứng sẽ thay đổi nếu nước tạo ra ở thể khí (4) Sản phẩm của phản ứng chiếm một thể tích lớn hơn so với chất phản ứng
Đáp án : D Phương pháp giải :
Dựa vào kiến thức về năng lượng hóa học Lời giải chi tiết :
Cân bằng phương trình oxi hóa khử đốt cháy ethanol: \({C_2}{H_5}{\rm{O}}H(l) + 3{O_2}(g) \to 2C{O_2}(g) + 3{H_2}{\rm{O}}(l)(1)\) Tổng hệ số phương trình là 9 Biến thiên enthalpy chuẩn của phản ứng thay đổi nếu tạo ra nước ở thể khí vì nhiệt tạo thành của nước ở 2 thể khác nhau (1) sai vì phản ứng tỏa nhiệt hay thu nhiệt dựa vào \({\Delta _r}H_{298}^0\)của phản ứng (4) sai vì tổng thể tích sản phẩm lớn hơn tổng thể tích chất tham gia Đáp án D
Câu 13 :
Kim loại nhôm có thể khử được oxide của nhiều nguyên tố. Dựa vào bảng enthalpy tạo thành chuẩn của các chất biết \({\Delta _f}H_{298}^0\)của Fe3O4 và Al2O3 lần lượt là -1118,4 và -1675,7 kJ/mol biến thiên enthalpy của phản ứng nhôm khử 1 mol Fe3O4(s) là:
Đáp án : B Phương pháp giải :
Dựa vào nhiệt tạo thành chuẩn của chất Lời giải chi tiết :
8Al + 3Fe3O4 \( \to \) 4Al2O3 + 9Fe \({\Delta _r}H_{298}^0\)= \(4.{\Delta _f}H_{298}^0(A{l_2}{O_3}) - 3.{\Delta _f}H_{298}^0(F{e_3}{O_4})\)= 4. (-1675,7) – 3.(-1118,4) = -3347,6 kJ Đáp án B
Câu 14 :
Phản ứng giữa 2 mol khí hydrogen và 1 mol khí oxygen tạo thành 2 mol H2O lỏng, giải phóng nhiệt lượng 571,68 kJ. Phương trình nhiệt hóa học được biểu diễn là
Đáp án : A Lời giải chi tiết :
Đáp án A
Câu 15 :
Ở điều kiện chuẩn, cần phải cung cấp 26,48 kJ nhiệt lượng cho quá trình ½ mol H2(g) phản ứng với ½ mol I2 (s) để thu được 1 mol HI(s). Ta nói enthalpy tạo thành của HI (g) ở điều kiện chuẩn là 26,48 kJ/mol. Phản ứng trên được biểu diễn như sau: \(\frac{1}{2}{H_2}(g) + \frac{1}{2}{I_2}(s) \to HI(g){\rm{ }}{\Delta _{\rm{f}}}{\rm{H}}_{298}^0 = 26,48kJ/mol\) ở cùng điều kiện phản ứng, nếu thu được 3 mol HI thì lượng nhiệt cần thu vào là:
Đáp án : D Phương pháp giải :
Dựa vào kiến thức về năng lượng hóa học Lời giải chi tiết :
Để thu được 3 mol HI thì lượng nhiệt cần thu vào là: 3.26,48 = 79,44 kJ Đáp án D
II. Tự luận
Lời giải chi tiết :
Khối lượng carbon trong 1,6 kg than là: 90%.1,6 = 1,44kg n C = 1,44 : 12 = 0,12 k.mol = 120 mol Lượng nhiệt cung cấp khi đốt cháy 120 mol carbon là: 120 . 393,5 = 47220 kJ Số điện tương đương với lượng nhiệt đốt cháy là: 47220 : 3600 = 13 số điện Lời giải chi tiết :
5CaC2O4 + 2KMnO4 + 8H2SO4 → 5CaSO4 + K2SO4 + 2MnSO4 + 8H2O + 10CO2 Số mol KMnO4 cần dùng để phản ứng hết với calcium oxalate kết tủa từ 1 mL máu là: 2,05.10-3.4,88.10-4 = 10-6 mol Số mol CaSO4 = 5/2. Số mol KMnO4 = 2,5x10-6 mol Khối lượng ion calcium (mg) trong 100 mL máu là: 2,5.10-6.40.103. 100 = 10mg/100 mL.
|















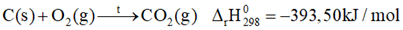
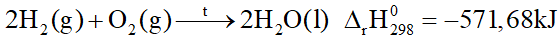








Danh sách bình luận