Đề thi giữa kì 1 Hóa 10 Chân trời sáng tạo - Đề số 9Tải về Câu 1: Hoà tan 6 gam kim loại X (hoá trị II) tác dụng vừa đủ 3,7185 lít khí Cl2 (ở 25oC, 1 bar). Kim loại X là A. Ca. B. Zn. C. Ba. D. Mg. Quảng cáo
Lựa chọn câu để xem lời giải nhanh hơn
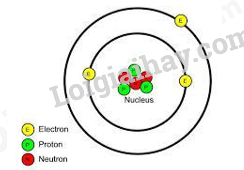
Đề thi I. TRẮC NGHIỆM Câu 1: Hoà tan 6 gam kim loại X (hoá trị II) tác dụng vừa đủ 3,7185 lít khí Cl2 (ở 25oC, 1 bar). Kim loại X là A. Ca. B. Zn. C. Ba. D. Mg. Câu 2: X, Y là 2 nguyên tố kế tiếp nhau, thuộc cùng một chu kì trong bảng tuần hoàn các nguyên tố hoá học. Tổng số hiệu nguyên tử của X, Y là 29. X, Y lần lượt thuộc nhóm A. IVA và VA. B. IIA và IIIA. C. IIIA và IVA. D. VA và VIA. Câu 3: Hai nguyên tố X và Y đứng kế tiếp nhau trong một chu kì và có tổng số proton trong hai hạt nhân là 25. X và Y thuộc chu kì và nhóm nào trong bảng tuần hoàn ? A. Chu kì 3, các nhóm IIA và IIIA. B. Chu kì 2, các nhóm IIIA và IVA. C. Chu kì 3, các nhóm IA và IIA. D. Chu kì 2, nhóm IIA Câu 4: Các ion nào sau đây có cấu hình electron giống nhau? A. Mg2+, Li+, Cl-. B. Mg2+, K+, F-. C. Mg2+, Ca2+, Cl-. D. Mg2+, F-, Na+ Câu 5: Nguyên tử của nguyên tố X có tổng số hạt electron trong các phân lớp p là 7. Số hạt mang điện của một nguyên tử Y nhiều hơn số hạt mang điện của một nguyên tử X là 8 hạt. Các nguyên tố X và Y lần lượt là A. Fe và Cl. B. Na và Cl. C. Al và Cl. D. Al và P. Câu 6: Tổng số hạt neutron, proton, electron trong ion .\({}_{17}^{35}C{l^ - }\). là A. 52. B. 35. C. 53. D. 51. Câu 7: Khẳng định nào sau đây là đúng khi so sánh kích thước của hạt nhân so với kích thước của nguyên tử? A. Kích thước hạt nhân rất nhỏ so với nguyên tử. B. Hạt nhân có kích thước bằng một nửa nguyên tử. C. Hạt nhân chiếm gần như toàn bộ kích thước nguyên tử. D. Hạt nhân có kích thước bằng 2/3 kích thước nguyên tử. Câu 8: Mô hình cấu tạo ở hình bên dưới thuộc về nguyên tử của nguyên tố nào?
A. Carbon (Z = 6). B. Hydrogen (Z = 1). C. Aluminium (Z = 13). D. Lithium (Z = 3). Câu 9: Phát biểu nào sau đây về sự chuyển động của e trong nguyên tử là đúng? A. các e chuyển động rất nhanh xung quanh hạt nhân theo quỹ đạo hình tròn. B. các e chuyển động rất nhanh xung quanh hạt nhân theo quỹ đạo hình bầu dục. C. các e chuyển động rất nhanh xung quanh hạt nhân không theo những quỹ đạo xác định. D. tất cả đều đúng. Câu 10: Để tạo thành ion \(_{{\rm{20}}}{\rm{C}}{{\rm{a}}^{{\rm{2 + }}}}\) thì nguyên tử Ca phải : A. Nhận 2 electron B. Cho 2 proton C. Nhận 2 proton D. Cho 2 electron II. TỰ LUẬN Câu 1: Chlorine là một trong những nguyên tố có trong thành phần của nhựa PVC, các chất dẻo hay cao su. Ngoài ra, với tính oxi hóa mạnh, hợp chất của Chlorine còn được dùng để khử trùng nước sinh hoạt, điều chế nước javen – sản phẩm được dùng để tẩy trắng quần áo, vải sợi, …Trong tự nhiên, Chlorine có hai đồng vị bền là 35Cl (khối lượng 34,96885 amu) và 37Cl (khối lượng 36,96590 amu). Nguyên tử khối trung bình của Chlorine được xác định là 35,453 amu. Tính thành phần phần trăm của từng đồng vị Chlorine? Câu 2: Hòa tan hoàn toàn 6,645 gam hỗn hợp muối chloride của 2 kim loại kiềm thuộc 2 chu kỳ kế tiếp nhau vào nước thu được dung dịch X. Cho toàn bộ dung dịch X tác dụng hoàn toàn với dung dịch AgNO3 (dư) thu được 18,655 gam kết tủa. Xác định 2 kim loại kiềm.
Đáp án Phần trắc nghiệm
Câu 1: Hoà tan 6 gam kim loại X (hoá trị II) tác dụng vừa đủ 3,7185 lít khí Cl2 (ở 25oC, 1 bar). Kim loại X là A. Ca. B. Zn. C. Ba. D. Mg. Phương pháp giải Viết phương trình hóa học, dựa vào số mol của khí Cl2 để xác định số mol của kim loại X Từ đó tính M X Lời giải chi tiết \(\begin{array}{l}{n_{Cl2}} = \frac{{3,7185}}{{24,79}} = 0,15{\rm{ mol}}\\{\rm{ X + C}}{{\rm{l}}_{\rm{2}}}{\rm{ }} \to {\rm{XC}}{{\rm{l}}_{\rm{2}}}\\0,15 \leftarrow {\rm{0,15}}\\{{\rm{M}}_X} = 6:0,15 = 40(Ca)\end{array}\) Đáp án A Câu 2: X, Y là 2 nguyên tố kế tiếp nhau, thuộc cùng một chu kì trong bảng tuần hoàn các nguyên tố hoá học. Tổng số hiệu nguyên tử của X, Y là 29. X, Y lần lượt thuộc nhóm A. IVA và VA. B. IIA và IIIA. C. IIIA và IVA. D. VA và VIA. Phương pháp giải (1) ZX + ZY = 29 (2) ZY – ZX = 1 Lời giải chi tiết (1) ZX + ZY = 29 (2) ZY – ZX = 1 => ZX = 14; ZY = 15 X là Si, Y là P Đáp án A Câu 3: Hai nguyên tố X và Y đứng kế tiếp nhau trong một chu kì và có tổng số proton trong hai hạt nhân là 25. X và Y thuộc chu kì và nhóm nào trong bảng tuần hoàn ? A. Chu kì 3, các nhóm IIA và IIIA. B. Chu kì 2, các nhóm IIIA và IVA. C. Chu kì 3, các nhóm IA và IIA. D. Chu kì 2, nhóm IIA Phương pháp giải (1) PX + PY =25 (2) PY – PX = 1 Lời giải chi tiết (1) PX + PY = 25 (2) PY – PX = 1 => PX = 12; PY = 13 X: Mg; Y: Al Đáp án A Câu 4: Các ion nào sau đây có cấu hình electron giống nhau? A. Mg2+, Li+, Cl-. B. Mg2+, K+, F-. C. Mg2+, Ca2+, Cl-. D. Mg2+, F-, Na+ Phương pháp giải Viết cấu hình của các ion Lời giải chi tiết Cấu hình Mg2+ : 1s22s22p6 Cấu hình F-: 1s22s22p6 Cấu hình Na+: 1s22s22p6 Câu 5: Nguyên tử của nguyên tố X có tổng số hạt electron trong các phân lớp p là 7. Số hạt mang điện của một nguyên tử Y nhiều hơn số hạt mang điện của một nguyên tử X là 8 hạt. Các nguyên tố X và Y lần lượt là A. Fe và Cl. B. Na và Cl. C. Al và Cl. D. Al và P. Lời giải chi tiết Nguyên tử nguyên tố X có tổng số hạt electron trong các phân lớp p là 7 ⇒ Cấu hình electron của X: 1s22s22p63s23p1. ⇒ Số hạt mang điện của X = 2.13 = 26. ⇒ Y có số hiệu nguyên tử Z = 34:2 = 17 Đáp án C Câu 6: Tổng số hạt neutron, proton, electron trong ion \({}_{17}^{35}C{l^ - }\) là A. 52. B. 35. C. 53. D. 51. Phương pháp giải Dựa vào kí hiệu ion Cl- Lời giải chi tiết Số proton = 17, số neutron = 18 Tổng số hạt trong ion Cl-: 17 + 18 + 18 = 53 Đáp án C Câu 7: Khẳng định nào sau đây là đúng khi so sánh kích thước của hạt nhân so với kích thước của nguyên tử? A. Kích thước hạt nhân rất nhỏ so với nguyên tử. B. Hạt nhân có kích thước bằng một nửa nguyên tử. C. Hạt nhân chiếm gần như toàn bộ kích thước nguyên tử. D. Hạt nhân có kích thước bằng 2/3 kích thước nguyên tử. Lời giải chi tiết Đáp án C vì khối lượng nguyên tử chủ yếu tập trung ở hạt nhân Câu 8: Mô hình cấu tạo ở hình bên dưới thuộc về nguyên tử của nguyên tố nào?
A. Carbon (Z = 6). B. Hydrogen (Z = 1). C. Aluminium (Z = 13). D. Lithium (Z = 3). Phương pháp giải Dựa vào tổng số electron có trong mô hình Lời giải chi tiết Vì có 3 electron => Z= 3 Đáp án D Câu 9: Phát biểu nào sau đây về sự chuyển động của e trong nguyên tử là đúng? A. các e chuyển động rất nhanh xung quanh hạt nhân theo quỹ đạo hình tròn. B. các e chuyển động rất nhanh xung quanh hạt nhân theo quỹ đạo hình bầu dục. C. các e chuyển động rất nhanh xung quanh hạt nhân không theo những quỹ đạo xác định. D. tất cả đều đúng. Lời giải chi tiết Đáp án C Câu 10: Để tạo thành ion \(_{{\rm{20}}}{\rm{C}}{{\rm{a}}^{{\rm{2 + }}}}\) thì nguyên tử Ca phải : A. Nhận 2 electron B. Cho 2 proton C. Nhận 2 proton D. Cho 2 electron Phương pháp giải Vì Ca có 2 electron lớp ngoài cùng nên Ca dễ dàng nhường đi 2 electron Lời giải chi tiết Đáp án D II. TỰ LUẬN Câu 1: Chlorine là một trong những nguyên tố có trong thành phần của nhựa PVC, các chất dẻo hay cao su. Ngoài ra, với tính oxi hóa mạnh, hợp chất của Chlorine còn được dùng để khử trùng nước sinh hoạt, điều chế nước javen – sản phẩm được dùng để tẩy trắng quần áo, vải sợi, …Trong tự nhiên, Chlorine có hai đồng vị bền là 35Cl (khối lượng 34,96885 amu) và 37Cl (khối lượng 36,96590 amu). Nguyên tử khối trung bình của Chlorine được xác định là 35,453 amu. Tính thành phần phần trăm của từng đồng vị Chlorine? Lời giải chi tiết \({\mathop A\limits^{\_\_} _{Cl}} = 35,453\); % 35Cl = a%; %37Cl = b% \(\left\{ \begin{array}{l}{\rm{a + b = 100}}\\{\mathop {\rm{A}}\limits^{{\rm{\_\_\_}}} _{{\rm{Cu}}}} = \frac{{{\rm{34,96885a + 36,96590b}}}}{{100}}{\rm{ = 35,453}}\end{array} \right. \Leftrightarrow \left\{ \begin{array}{l}{\rm{a = 75,76}}\\{\rm{b = 24,24}}\end{array} \right.\) Vậy % 35Cl = 75,76%; %37Cl = 24,24% Câu 2: Hòa tan hoàn toàn 6,645 gam hỗn hợp muối chloride của 2 kim loại kiềm thuộc 2 chu kỳ kế tiếp nhau vào nước thu được dung dịch X. Cho toàn bộ dung dịch X tác dụng hoàn toàn với dung dịch AgNO3 (dư) thu được 18,655 gam kết tủa. Xác định 2 kim loại kiềm. Lời giải chi tiết Gọi công thức chung của hai kim loại là A, hóa trị là n \(\begin{array}{l}AC{{\mathop{\rm l}\nolimits} _n} + nAgN{O_3} \to A{(N{O_3})_{_n}} + nAgCl\\{n_{AgCl}} = \frac{{18,655}}{{143,5}} = 0,13mol\\ \to {n_{AC\ln }} = \frac{{0,13}}{n}mol\\\overline M = \frac{{6,645}}{{\frac{{0,13}}{n}}} = 51,15n\\ \to \overline {{M_A}} = 51,15n - 35,5n = 15,65n\end{array}\) Vì A là kim loại nên n = 1 hoặc 2 hoặc 3 Lập bảng ta có
Vì 2 kim loại kiềm thuộc cùng chu kì liên tiếp nên n = 1 => \(\overline {{M_A}} = 51,15 - 35,5 = 15,65\)=> Kim loại là Li và Na
|




















Danh sách bình luận