Đề thi học kì 2 Hóa 10 Chân trời sáng tạo - Đề số 7Phản ứng nào sau đây có thể tự xảy ra ở điều kiện thường?Đề bài
I. Trắc nghiệm
Câu 1 :
Phản ứng nào sau đây có thể tự xảy ra ở điều kiện thường?
Câu 2 :
Dùng không khí nén thổi vào lò cao để đốt cháy than cốc (trong sản xuất gang), yếu tố ảnh hưởng tới tốc độ phản ứng là
Câu 3 :
Cho các phát biểu sau: (a) trong các phản ứng hóa học, flo chỉ thể hiện tính oxi hóa. (b) HF là acid mạnh. (c) trong hợp chất, các halogen (F, Cl, Br, I) đều có số oxi hóa: -1, +1, +3, +5 và +7. (d) tính khử của các ion halogenua tăng dần theo thứ tự: F-, Cl-, Br-, I-. Trong các phát biểu trên, số phát biểu đúng là:
Câu 4 :
Cho 100ml dung dịch FeCl3 1M tác dụng hoàn toàn với lượng dư dung dịch AgNO3, thì khối lượng kết tủa thu được là?
Câu 5 :
Thực hiện 2 thí nghiệm theo hình vẽ sau:
10mL dung dịch H2SO4 0,1M 10mL dung dịch Na2S2O3 0,1M 10mL dung dịch Na2S2O3 0,05M Ở thí nghiệm nào có kết tủa xuất hiện trước?
Câu 6 :
Phương trình nhiệt hóa học nào sau đây là phản ứng thu nhiệt ở điều kiện chuẩn, nhiệt độ 298K?
Câu 7 :
Cho các phản ứng sau : (1) Nung NH4Cl(s) tạo ra HCl(g) và NH3(g). (2) Cồn cháy trong không khí. (3) Phản ứng thủy phân collagen thành gelatin (là một loại protein dễ tiêu hóa) diễn ra khi hầm xương động vật. (4) Đốt cháy than là phản ứng. (5) Đốt cháy khí gas trên bếp gas. (6) Cho vôi sống vào nước là. (7) Phản ứng nung vôi. Các quá trình toả nhiệt hay thu nhiệt tương ứng là ?
Câu 8 :
Methane là thành phần chính của khí thiên nhiên. Xét phản ứng đốt cháy methane: CH4(g) + 2O2(g) → CO2(g) + 2H2O(l) \({\Delta _r}H_{298}^0\) = – 890,3 kJ Biết nhiệt tạo thành chuẩn của CO2(g) và H2O(l) tương ứng là –393,5 –285,8 kJ/mol. Nhiệt tạo thành chuẩn của khí methane là
Câu 9 :
Trường hợp nào không xảy ra phản ứng hóa học?
Câu 10 :
Thể tích khí Cl2 (đkc) vừa đủ để tác dụng hết với dung dịch KI thu được 2,54g I2 là
Câu 11 :
Đinh một mẩu giấy màu ẩm vào dây kim loại gần với nút đậy bình tam giác. Sau đó, đưa mẩu giấy vào bình tam giác có chứa khí chlorine. Hiện tượng quan sát được là
Câu 12 :
Chất xúc tác là chất
Câu 13 :
Nguyên tố nào sau đây không thuộc nhóm halogen?
Câu 14 :
Cho phản ứng hóa học sau: Mg(s) + 2HCl(aq) \( \to \) MgCl2(aq) + H2(g). Sau 40 giây, nồng độ của dung dịch HCl giảm từ 0,6M về còn 0,4M. Tốc độ trung bình của phản ứng theo HCl trong 40 giây là
Câu 15 :
Khi nhiệt độ tăng thêm 10oC, tốc độ phản ứng hóa học tăng lên 2 lần. Để tốc độ phản ứng đó (đang tiến hành ở 20oC) tăng lên 32 lần thì cần thực hiện phản ứng ở nhiệt độ bao nhiêu?
II. Câu hỏi đúng sai
Câu 1 :
Cho phương trình nhiệt hóa học của phản ứng: N2(g) + O2(g) \( \to \)2NO(g) \({\Delta _r}H_{298}^o > 0\) a) Phản ứng thu nhiệt
Đúng
Sai
b) Phản ứng xảy ra thuận lợi ở điều kiện thường
Đúng
Sai
c) Phản ứng hóa học xảy ra có sự hấp thụ nhiệt năng từ môi trường
Đúng
Sai
d) Nitrogen và oxygen phản ứng mạnh hơn khi ở nhiệt độ thấp.
Đúng
Sai
Câu 2 :
Trong tự nhiên và cuộc sống, có nhiều phản ứng hóa học xảy ra với tốc độ khác nhau phụ thuộc vào nồng độ chất phản ứng a) Khi cho que đóm còn tàn đỏ vào bình oxygen thì que đóm bùng cháy, để ở ngoài thì không có hiện tượng là do nồng độ oxygen trong bình khí oxygen cao hơn.
Đúng
Sai
b) Đám cháy xăng, dầu sẽ được dập tắt nhanh nếu chúng ta phun nước vào
Đúng
Sai
c) Khi làm sữa chua, nếu cho nhiều sữa chua thì quá trình lên men diễn ra nhanh hơn
Đúng
Sai
d) Khi làm bánh mì, nếu cho nhiều men vào bột thì quá trình lên men diễn ra nhanh hơn.
Đúng
Sai
Câu 3 :
Cho các phát biểu sau: a) Trong các phản ứng hóa học, fluorine chỉ thể hiện tính oxi hóa
Đúng
Sai
b) Hydrofluoric acid là acid yếu
Đúng
Sai
c) Dung dịch HF được dùng làm hóa chất để khắc thủy tinh
Đúng
Sai
d) Tính khử của các ion halogenua tăng dần theo thứ tự: Cl-, Br-, I-.
Đúng
Sai
Câu 4 :
Cho phản ứng hóa học có dạng: A + B \( \to \) C. Tốc độ phản ứng thay đổi như thế nào khi a) Nồng độ A tăng 2 lần, giữ nguyên nồng độ B thì tốc độ phản ứng tăng 2 lần
Đúng
Sai
b) Nồng độ của cả hai chất đều tăng lên 2 lần thì tốc độ phản ứng tăng lên 4 lần
Đúng
Sai
c) Nồng độ của chất này tăng lên 2 lần, nồng độ của chất kia giảm đi 2 lần thì tốc độ phản ứng tăng lên 2 lần
Đúng
Sai
d) Tăng áp suất lên 2 lần đối với hỗn hợp phản ứng, coi đây là phản ứng của các chất khí thì tốc độ phản ứng tăng lên 4 lần.
Đúng
Sai
III. Tự luận
Lời giải và đáp án
I. Trắc nghiệm
Câu 1 :
Phản ứng nào sau đây có thể tự xảy ra ở điều kiện thường?
Đáp án : C Phương pháp giải :
Phản ứng xảy ra ở nhiệt độ thường là phản ứng tỏa nhiệt Lời giải chi tiết :
Phản ứng giữa Zn và dung dịch H2SO4 Đáp án C
Câu 2 :
Dùng không khí nén thổi vào lò cao để đốt cháy than cốc (trong sản xuất gang), yếu tố ảnh hưởng tới tốc độ phản ứng là
Đáp án : A Phương pháp giải :
Dựa vào các yếu tố ảnh hưởng đến tốc độ phản ứng Lời giải chi tiết :
Dùng không khí nén thổi vào lò cao để đốt cháy than cốc, yếu tố nhiệt độ và áp suất làm ảnh hưởng tới tốc độ phản ứng.
Câu 3 :
Cho các phát biểu sau: (a) trong các phản ứng hóa học, flo chỉ thể hiện tính oxi hóa. (b) HF là acid mạnh. (c) trong hợp chất, các halogen (F, Cl, Br, I) đều có số oxi hóa: -1, +1, +3, +5 và +7. (d) tính khử của các ion halogenua tăng dần theo thứ tự: F-, Cl-, Br-, I-. Trong các phát biểu trên, số phát biểu đúng là:
Đáp án : C Phương pháp giải :
Dựa vào tính chất của nguyên tố halogen Lời giải chi tiết :
(a) đúng (b) sai, HF là một acid yếu (c) sai, fluorine không có số oxi hóa +1,+3,+5,+7 (d) đúng Đáp án C
Câu 4 :
Cho 100ml dung dịch FeCl3 1M tác dụng hoàn toàn với lượng dư dung dịch AgNO3, thì khối lượng kết tủa thu được là?
Đáp án : C Phương pháp giải :
Dựa vào phản ứng FeCl3 + 3AgNO3 \( \to \)Fe(NO3)3 + 3AgCl Lời giải chi tiết :
n FeCl3 = 0,1.1 = 0,1 mol FeCl3 + 3AgNO3 \( \to \)Fe(NO3)3 + 3AgCl 0,1\( \to \) 0,3 n AgCl = 0,3.143,5 = 43,05g Đáp án C
Câu 5 :
Thực hiện 2 thí nghiệm theo hình vẽ sau:
10mL dung dịch H2SO4 0,1M 10mL dung dịch Na2S2O3 0,1M 10mL dung dịch Na2S2O3 0,05M Ở thí nghiệm nào có kết tủa xuất hiện trước?
Đáp án : A Phương pháp giải :
Dựa vào các yếu tố ảnh hưởng đến tốc độ phản ứng Lời giải chi tiết :
ở thí nghiệm bến trái có xuất hiện kết tủa trước vì có nồng độ Na2S2O3 lớn hơn Đáp án A
Câu 6 :
Phương trình nhiệt hóa học nào sau đây là phản ứng thu nhiệt ở điều kiện chuẩn, nhiệt độ 298K?
Đáp án : A Phương pháp giải :
Dựa vào dấu của biến thiên enthalpy Lời giải chi tiết :
Phương trình nhiệt hóa học \(Cu{(OH)_{2\,}}_{(s)} \to Cu{O_{(s)}} + {H_2}{O_{(l)}}\,\,\,{\Delta _r}H_{298}^0 = + 9,0\,kJ.\)là phản ứng thu nhiệt vì có \({\Delta _r}H_{298}^o\)> 0 Đáp án A
Câu 7 :
Cho các phản ứng sau : (1) Nung NH4Cl(s) tạo ra HCl(g) và NH3(g). (2) Cồn cháy trong không khí. (3) Phản ứng thủy phân collagen thành gelatin (là một loại protein dễ tiêu hóa) diễn ra khi hầm xương động vật. (4) Đốt cháy than là phản ứng. (5) Đốt cháy khí gas trên bếp gas. (6) Cho vôi sống vào nước là. (7) Phản ứng nung vôi. Các quá trình toả nhiệt hay thu nhiệt tương ứng là ?
Đáp án : A Phương pháp giải :
Dựa vào khái niệm phản ứng thu nhiêt, phản ứng tỏa nhiệt Lời giải chi tiết :
Tỏa nhiệt: (2), (4), (5), (6) và thu nhiệt: (1), (3) và (7) Đáp án A
Câu 8 :
Methane là thành phần chính của khí thiên nhiên. Xét phản ứng đốt cháy methane: CH4(g) + 2O2(g) → CO2(g) + 2H2O(l) \({\Delta _r}H_{298}^0\) = – 890,3 kJ Biết nhiệt tạo thành chuẩn của CO2(g) và H2O(l) tương ứng là –393,5 –285,8 kJ/mol. Nhiệt tạo thành chuẩn của khí methane là
Đáp án : A Phương pháp giải :
Dựa vào công thức tính biến thiên enthalpy của phản ứng Lời giải chi tiết :
\(\begin{array}{l}{\Delta _r}H_{298}^o = {\Delta _f}H_{298}^o(C{O_2}) + 2.{\Delta _f}H_{298}^o({H_2}{\rm{O}}) - {\Delta _f}H_{298}^o(C{H_4}) = - 890,3\\ \to {\Delta _f}H_{298}^o(C{H_4}) = - 74,8kJ/mol\end{array}\) Đáp án A
Câu 9 :
Trường hợp nào không xảy ra phản ứng hóa học?
Đáp án : B Phương pháp giải :
Dựa vào tính chất hóa học của halogen Lời giải chi tiết :
I2 không tác dụng với NaBr do I2 có tính khử yếu hơn Br- Đáp án B
Câu 10 :
Thể tích khí Cl2 (đkc) vừa đủ để tác dụng hết với dung dịch KI thu được 2,54g I2 là
Đáp án : A Phương pháp giải :
Dựa vào phản ứng của Cl2 và KI Lời giải chi tiết :
n I2 = 2,54 : 254 = 0,01 mol Cl2 + 2KI \( \to \)2KCl + I2 0,01 0,01 V Cl2 = 0,01. 24,79 = 0,2479 L = 247,9 ml Đáp án A
Câu 11 :
Đinh một mẩu giấy màu ẩm vào dây kim loại gần với nút đậy bình tam giác. Sau đó, đưa mẩu giấy vào bình tam giác có chứa khí chlorine. Hiện tượng quan sát được là
Đáp án : B Phương pháp giải :
Dựa vào tính oxi hóa của khí chlorine Lời giải chi tiết :
Khi đưa mẩu giấy màu ẩm vào bình đựng khí chlorine, mẩu giấy bị nhạt màu dần rồi mất màu do khả năng tẩy màu khi Cl2 tác dụng với H2O Đáp án B
Câu 12 :
Chất xúc tác là chất
Đáp án : D Phương pháp giải :
Dựa vào khái niệm của chất xúc tác Lời giải chi tiết :
Chất xúc tác làm tăng tốc độ phản ứng và không bị mất đi sau phản ứng Đáp án D
Câu 13 :
Nguyên tố nào sau đây không thuộc nhóm halogen?
Đáp án : C Phương pháp giải :
Dựa vào kiến thức về nhóm halogen Lời giải chi tiết :
Chlromium (Cr) không thuộc nhóm halogen Đáp án C
Câu 14 :
Cho phản ứng hóa học sau: Mg(s) + 2HCl(aq) \( \to \) MgCl2(aq) + H2(g). Sau 40 giây, nồng độ của dung dịch HCl giảm từ 0,6M về còn 0,4M. Tốc độ trung bình của phản ứng theo HCl trong 40 giây là
Đáp án : C Phương pháp giải :
Dựa vào công thức tính tốc độ phản ứng Lời giải chi tiết :
\(v = \frac{1}{2}.\frac{{0,6 - 0,4}}{{40}} = 0,0025M/s\) Đáp án C
Câu 15 :
Khi nhiệt độ tăng thêm 10oC, tốc độ phản ứng hóa học tăng lên 2 lần. Để tốc độ phản ứng đó (đang tiến hành ở 20oC) tăng lên 32 lần thì cần thực hiện phản ứng ở nhiệt độ bao nhiêu?
Đáp án : D Phương pháp giải :
Dựa vào hệ số nhiệt độ Van’t Hoff Lời giải chi tiết :
\(\begin{array}{l}\frac{{{v_T}}}{{{v_{{{20}^o}C}}}} = {\gamma ^{\frac{{(T - 20)}}{{10}}}}\\ \to 32 = {2^{\frac{{(T - 20)}}{{10}}}}\\ \to T = {70^o}C\end{array}\)
II. Câu hỏi đúng sai
Câu 1 :
Cho phương trình nhiệt hóa học của phản ứng: N2(g) + O2(g) \( \to \)2NO(g) \({\Delta _r}H_{298}^o > 0\) a) Phản ứng thu nhiệt
Đúng
Sai
b) Phản ứng xảy ra thuận lợi ở điều kiện thường
Đúng
Sai
c) Phản ứng hóa học xảy ra có sự hấp thụ nhiệt năng từ môi trường
Đúng
Sai
d) Nitrogen và oxygen phản ứng mạnh hơn khi ở nhiệt độ thấp.
Đúng
Sai
Đáp án
a) Phản ứng thu nhiệt
Đúng
Sai
b) Phản ứng xảy ra thuận lợi ở điều kiện thường
Đúng
Sai
c) Phản ứng hóa học xảy ra có sự hấp thụ nhiệt năng từ môi trường
Đúng
Sai
d) Nitrogen và oxygen phản ứng mạnh hơn khi ở nhiệt độ thấp.
Đúng
Sai
Lời giải chi tiết :
a) đúng, phản ứng trên có \({\Delta _r}H_{298}^o > 0\) b) sai, phản ứng xảy ra khó khăn ở điều kiện thường c) đúng d) đúng
Câu 2 :
Trong tự nhiên và cuộc sống, có nhiều phản ứng hóa học xảy ra với tốc độ khác nhau phụ thuộc vào nồng độ chất phản ứng a) Khi cho que đóm còn tàn đỏ vào bình oxygen thì que đóm bùng cháy, để ở ngoài thì không có hiện tượng là do nồng độ oxygen trong bình khí oxygen cao hơn.
Đúng
Sai
b) Đám cháy xăng, dầu sẽ được dập tắt nhanh nếu chúng ta phun nước vào
Đúng
Sai
c) Khi làm sữa chua, nếu cho nhiều sữa chua thì quá trình lên men diễn ra nhanh hơn
Đúng
Sai
d) Khi làm bánh mì, nếu cho nhiều men vào bột thì quá trình lên men diễn ra nhanh hơn.
Đúng
Sai
Đáp án
a) Khi cho que đóm còn tàn đỏ vào bình oxygen thì que đóm bùng cháy, để ở ngoài thì không có hiện tượng là do nồng độ oxygen trong bình khí oxygen cao hơn.
Đúng
Sai
b) Đám cháy xăng, dầu sẽ được dập tắt nhanh nếu chúng ta phun nước vào
Đúng
Sai
c) Khi làm sữa chua, nếu cho nhiều sữa chua thì quá trình lên men diễn ra nhanh hơn
Đúng
Sai
d) Khi làm bánh mì, nếu cho nhiều men vào bột thì quá trình lên men diễn ra nhanh hơn.
Đúng
Sai
Lời giải chi tiết :
a) đúng b) sai, xăng nhẹ hơn nước, nếu phun nước sẽ làm đám cháy lan rộng hơn c) đúng d) đúng
Câu 3 :
Cho các phát biểu sau: a) Trong các phản ứng hóa học, fluorine chỉ thể hiện tính oxi hóa
Đúng
Sai
b) Hydrofluoric acid là acid yếu
Đúng
Sai
c) Dung dịch HF được dùng làm hóa chất để khắc thủy tinh
Đúng
Sai
d) Tính khử của các ion halogenua tăng dần theo thứ tự: Cl-, Br-, I-.
Đúng
Sai
Đáp án
a) Trong các phản ứng hóa học, fluorine chỉ thể hiện tính oxi hóa
Đúng
Sai
b) Hydrofluoric acid là acid yếu
Đúng
Sai
c) Dung dịch HF được dùng làm hóa chất để khắc thủy tinh
Đúng
Sai
d) Tính khử của các ion halogenua tăng dần theo thứ tự: Cl-, Br-, I-.
Đúng
Sai
Lời giải chi tiết :
a) Đúng b) đúng c) đúng, HF phản ứng với SiO2 d) đúng
Câu 4 :
Cho phản ứng hóa học có dạng: A + B \( \to \) C. Tốc độ phản ứng thay đổi như thế nào khi a) Nồng độ A tăng 2 lần, giữ nguyên nồng độ B thì tốc độ phản ứng tăng 2 lần
Đúng
Sai
b) Nồng độ của cả hai chất đều tăng lên 2 lần thì tốc độ phản ứng tăng lên 4 lần
Đúng
Sai
c) Nồng độ của chất này tăng lên 2 lần, nồng độ của chất kia giảm đi 2 lần thì tốc độ phản ứng tăng lên 2 lần
Đúng
Sai
d) Tăng áp suất lên 2 lần đối với hỗn hợp phản ứng, coi đây là phản ứng của các chất khí thì tốc độ phản ứng tăng lên 4 lần.
Đúng
Sai
Đáp án
a) Nồng độ A tăng 2 lần, giữ nguyên nồng độ B thì tốc độ phản ứng tăng 2 lần
Đúng
Sai
b) Nồng độ của cả hai chất đều tăng lên 2 lần thì tốc độ phản ứng tăng lên 4 lần
Đúng
Sai
c) Nồng độ của chất này tăng lên 2 lần, nồng độ của chất kia giảm đi 2 lần thì tốc độ phản ứng tăng lên 2 lần
Đúng
Sai
d) Tăng áp suất lên 2 lần đối với hỗn hợp phản ứng, coi đây là phản ứng của các chất khí thì tốc độ phản ứng tăng lên 4 lần.
Đúng
Sai
Lời giải chi tiết :
Biểu thức tính tốc độ phản ứng trên là: v = k.[A][B] a) Đúng b) Đúng c) sai, tốc độ phản ứng giữ nguyên d) sai, tốc độ phản ứng tăng 2 lần
III. Tự luận
Lời giải chi tiết :
Các biện pháp được sử dụng để làm tăng tốc độ phản ứng: dùng chất xúc tác manganese dioxide (MnO2); nung hỗn hợp potassium chlorate và manganese dioxide ở nhiệt độ cao. Lời giải chi tiết :
\(\begin{array}{l}\bar v = - \frac{{\Delta {C_{B{r_2}}}}}{t} = - \frac{{(0,01 - a)}}{{50}} = {4.10^{ - 5}}\\ \to a = 0,012M\end{array}\) Lời giải chi tiết :
Số ống nghiệm cho kết tủa với dung dịch AgNO3 là: 2 PTHH: HCl + AgNO3 \( \to \)AgCl\( \downarrow \) + HNO3 NaBr + AgNO3 \( \to \)AgBr \( \downarrow \)+ NaNO3 Lời giải chi tiết :
KIO3 + 5KI + 3H2SO4 → 3K2SO4 + 3I2 + 3H2O 0,1 mol ← 0,3 mol \({m_{KI{O_{_3}}}} = 0,1.(39 + 127 + 16.3) = 21,4gam\) Lời giải chi tiết :
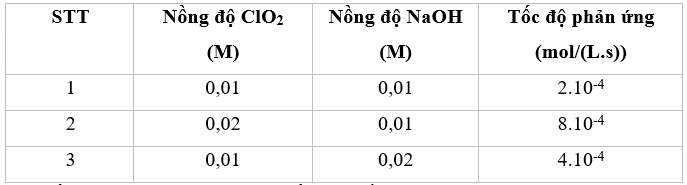
\(\begin{array}{l}{v_1} = k.C_{Cl{O_2}}^x.C_{NaOH}^y = k.0,{01^x}.0,{01^y} = {2.10^{ - 4}}\\{v_2} = k.C_{Cl{O_2}}^x.C_{NaOH}^y = k.0,{02^x}.0,{01^y} = {8.10^{ - 4}}\\ \to \frac{{{v_1}}}{{{v_2}}} = \frac{{k.0,{{01}^x}.0,{{01}^y}}}{{k.0,{{02}^x}.0,{{01}^y}}} = \frac{{{{2.10}^{ - 4}}}}{{{{8.10}^{ - 4}}}}\\ \to x = 2\end{array}\) \(\begin{array}{l}{v_1} = k.C_{Cl{O_2}}^x.C_{NaOH}^y = k.0,{01^x}.0,{01^y} = {2.10^{ - 4}}\\{v_3} = k.C_{Cl{O_2}}^x.C_{NaOH}^y = k.0,{01^x}.0,{02^y} = {4.10^{ - 4}}\\ \to \frac{{{v_1}}}{{{v_3}}} = \frac{{k.0,{{01}^x}.0,{{01}^y}}}{{k.0,{{01}^x}.0,{{02}^y}}} = \frac{{{{2.10}^{ - 4}}}}{{{{4.10}^{ - 4}}}}\\ \to y = 1\end{array}\) Tổng x + y = 1 + 2 = 3 Phương pháp giải :
HCl đóng vai trò là chất khử khi tăng số oxi hóa Lời giải chi tiết :
(a); (c) đóng vai trò là chất khử.
|

























Danh sách bình luận