Đề thi học kì 2 Hóa 10 - Đề số 4Đề bài
Câu 1 :
Cấu hình electron lớp ngoài cùng của các nguyên tố nhóm VIIA (halogen) là
Câu 2 :
Cho axit H2SO4 đặc, dư tác dụng vừa đủ với 29,25 gam NaCl đun nóng. Khí thu được hòa tan vào 73 gam H2O. Nồng độ phần trăm của HCl trong dung dịch thu được là
Câu 3 :
Cho 200 ml dung dịch AgNO3 0,1M tác dụng với 100 ml dung dịch FeCl2 0,1M thu được chất rắn có khối lượng là
Câu 4 :
Nung 0,2 mol KMnO4 ở nhiệt độ cao thu được chất rắn X và 1,68 lít khí O2 (đktc). Cho chất rắn X vào dung dịch HCl đặc, dư thu được V lít khí Cl2 (đktc). Giá trị của V là
Câu 5 :
Trong các câu sau đây, câu nào sai ?
Câu 6 :
Dãy kim loại phản ứng được với dung dịch H2SO4 loãng là
Câu 7 :
Cho 0,52 gam hỗn hợp 2 kim loại Mg, Al tan hoàn toàn trong dung dịch H2SO4 loãng dư thu được 0,336 lít khí ở đktc. Khối lượng muối sunfat thu được là:
Câu 8 :
Các khí sinh ra trong thí nghiệm phản ứng của saccarozơ với dung dịch H2SO4 đặc bao gồm
Câu 9 :
Trộn 676 gam oleum với 360 gam dung dịch H2SO4 80% thu được một loại oleum chứa 15,44% khối lượng SO3. Xác định công thức oleum ban đầu
Câu 10 :
Cho 10,3 gam hỗn hợp Cu, Al, Fe vào dung dịch HCl dư thu được 5,6 lít khí (đktc) và 2 gam chất rắn không tan. Vậy % theo khối lượng của từng chất trong hỗn hợp ban đầu lần lượt là
Câu 11 :
Dẫn mẫu khí thải của một nhà máy qua dung dịch Pb(NO3)2 dư thì thấy xuất hiện kết tủa màu đen. Hiện tượng đó chứng tỏ trong khí thải nhà máy có khí nào sau đây?
Câu 12 :
Trộn 5,6 gam bột sắt với 2,4 gam bột lưu huỳnh rồi nung nóng (trong điều kiện không có không khí), thu được hỗn hợp rắn M. Cho M tác dụng với lượng dư dung dịch HCl, giải phóng hỗn hợp khí X và còn lại một phần không tan G. Để đốt cháy hoàn toàn X và G cần vừa đủ V lít khí O2 (ở đktc). Giá trị của V là
Câu 13 :
Cho hình vẽ mô tả thí nghiệm điều chế khí Y từ chất rắn X như sau
Hình vẽ trên minh họa cho phản ứng nào sau đây ?
Câu 14 :
Số electron lớp ngoài cùng của các nguyên tử nhóm halogen là
Câu 15 :
Ứng dụng không phải của clo là
Câu 16 :
Cho V lít Cl2 (đktc) tác dụng với dung dịch NaOH loãng nguội, dư thu được m1 gam tổng khối lượng 2 muối. Cho V lít Cl2 (đktc) tác dụng với NaOH đặc, nóng thu được m2 gam tổng khối lượng hai muối. Tỷ lệ m1 : m2 bằng
Câu 17 :
Dãy các chất nào sau đây đều tác dụng với axit clohiđric ?
Câu 18 :
Brom bị lẫn tạp chất là clo. Cách nào sau đây có thể thu được brom tinh khiết ?
Câu 19 :
Có các hóa chất sau đựng riêng biệt trong các lọ mất nhãn: KCl, MgCl2, FeCl2, FeCl3, AlCl3, NH4Cl, (NH4)2SO4. Thuốc thử có thể dùng để nhận biết các hóa chất trên là
Câu 20 :
H2S bị oxi hóa thành lưu huỳnh màu vàng khi: 1) Dẫn khí H2S qua dung dịch FeCl3 2) Để dung dịch H2S ngoài trời 3) Đốt khí H2S ở điều kiện thiếu oxi
Câu 21 :
Đun nóng 20 gam một hỗn hợp X gồm Fe và S trong điều kiện không có không khí thu được hỗn hợp rắn A. Hòa tan hỗn hợp rắn A vào dung dịch HCl thu được 6,72 lít (đktc) hỗn hợp khí Y. Thành phần phần trăm khối lượng Fe trong X là:
Câu 22 :
Trong những câu sau, câu nào sai khi nói về tính chất hóa học của ozon?
Câu 23 :
Trong phản ứng S + H2SO4 đặc -> SO2 + H2O, đơn chất S đã
Câu 24 :
Hấp thụ hết 4,48 lít SO2 (đktc) vào dung dịch chứa x mol KOH và y mol K2CO3 thu được 200 ml dung dịch X. Mặt khác, 100 ml dung dịch X tác dụng với dung dịch Ba(OH)2 dư thu được 39,4 gam kết tủa. Nếu thay SO2bằng CO2, K2SO3 bằng K2CO3 ta được 200 ml dung dịch Y. Lấy 200 ml dung dịch Y cho từ từ vào 600 ml dung dịch HCl 0,5M thu được 5,376 lít khí (đktc). Giá trị của x là:
Câu 25 :
Cho m gam hỗn hợp kim loại A gồm Mg, Al, Zn bằng dung dịch H2SO4 loãng, dư thu được 1,344 lít khí ở đktc. Mặt khác, khi hòa tan hoàn toàn hỗn hợp A bằng dung dịch H2SO4 đặc, nóng dư thu được V lít khí SO2 (đktc). Tìm giá trị của V
Câu 26 :
Người ta nghiền nguyên liệu trước khi đưa vào lò nung để sản xuất clanhke (trong quá trình sản xuất xi măng) là đã tăng yếu tố nào sau đây để tăng tốc độ của phản ứng?
Câu 27 :
Yếu tố nào dưới đây đã được sử dụng để làm tăng tốc độ phản ứng khi rắc men vào tinh bột đã được nấu chín (cơm, ngô, khoai, sắn) để ủ rượu?
Câu 28 :
Yếu tố nào sau đây không gây ra sự chuyển dịch cân bằng của phản ứng thuận nghịch nói chung ?
Câu 29 :
Chọn khẳng định không đúng:
Câu 30 :
Đổ một lượng dung dịch H2SO4 vào cốc đựng dung dịch Na2S2O3 được 40 ml dung dịch X. Nồng độ ban đầu của H2SO4 trong dung dịch X bằng 0,05M. Sau 20 giây quan sát phản ứng, thấy nồng độ H2SO4 chỉ còn 15% so với ban đầu và trong cốc xuất hiện m gam kết tủa vàng. Tốc độ trung bình của phản ứng trong 20 giây quan sát (tính theo H2SO4) và giá trị của m lần lượt là
Lời giải và đáp án
Câu 1 :
Cấu hình electron lớp ngoài cùng của các nguyên tố nhóm VIIA (halogen) là
Đáp án : B Lời giải chi tiết :
Cấu hình electron lớp ngoài cùng của các nguyên tố nhóm VIIA (halogen) là ns2np5.
Câu 2 :
Cho axit H2SO4 đặc, dư tác dụng vừa đủ với 29,25 gam NaCl đun nóng. Khí thu được hòa tan vào 73 gam H2O. Nồng độ phần trăm của HCl trong dung dịch thu được là
Đáp án : A Phương pháp giải :
+) Bảo toàn nguyên tố Cl: nHCl = nNaCl +) Tính $C\% = \dfrac{{{m_{ct}}}}{{{m_{dd}}}}.100\% $ Lời giải chi tiết :
nNaCl = 0,5 mol Bảo toàn nguyên tố Cl: nHCl = nNaCl = 0,5 mol Khối lượng dung dịch thu được: mdd = mHCl + mH2O = 0,5 . 35,5 + 73 (gam) Hòa tan HCl vào nước => $C{\% _{HCl}} = \dfrac{{{m_{HCl}}}}{{{m_{{\rm{dd}}}}}} = \dfrac{{0,5.36,5}}{{73 + 0,5.36,5}}.100\% = 20\% $
Câu 3 :
Cho 200 ml dung dịch AgNO3 0,1M tác dụng với 100 ml dung dịch FeCl2 0,1M thu được chất rắn có khối lượng là
Đáp án : D Phương pháp giải :
Xảy ra các phản ứng: Fe2+ + Ag+ → Fe3+ + Ag↓ Cl- + Ag+ → AgCl↓ => mkết tủa = mAg + mAgCl Lời giải chi tiết :
nAgNO3 = 0,02 mol; nFeCl2 = 0,01 mol FeCl2 + 2AgNO3 → Fe(NO3)2+ 2AgCl↓ 0,01 → 0,02 → 0,02 => mkết tủa = mAgCl = 0,02.143,5 = 2,87 gam
Câu 4 :
Nung 0,2 mol KMnO4 ở nhiệt độ cao thu được chất rắn X và 1,68 lít khí O2 (đktc). Cho chất rắn X vào dung dịch HCl đặc, dư thu được V lít khí Cl2 (đktc). Giá trị của V là
Đáp án : B Phương pháp giải :
+) Chất rắn X gồm K2MnO4, MnO2 và KMnO4 còn dư +) Cho chất rắn X vào dung dịch HCl đặc thu được muối là KCl, MnCl2 +) Bảo toàn electron: $5.{n_{KMn{O_4}}} = 4.{n_{{O_2}}} + 2.{n_{C{l_2}}}$ Lời giải chi tiết :
2KMnO4 → K2MnO4 + MnO2 + O2 => Chất rắn X gồm K2MnO4, MnO2 và KMnO4 còn dư => Cho chất rắn X vào dung dịch HCl đặc thu được muối là KCl, MnCl2 Bảo toàn electron: $5.{n_{KMn{O_4}}} = 4.{n_{{O_2}}} + 2.{n_{C{l_2}}} = > \,\,{n_{C{l_2}}} = 0,35\,\,mol$ $ = > {\text{ }}{{\text{V}}_{C{l_2}}} = {\text{ }}0,35.22,4 = 7,84\,\,lít $
Câu 5 :
Trong các câu sau đây, câu nào sai ?
Đáp án : B Phương pháp giải :
Xem lại lí thuyết tính chất hóa học (tính chất của oxit axit và tính oxi hóa - khử) của SO2 Lời giải chi tiết :
Câu sai là: Sục SO2 vào dung dịch K2CO3 tạo khí CO2. SO2 không đẩy được CO2 ra khỏi dung dịch
Câu 6 :
Dãy kim loại phản ứng được với dung dịch H2SO4 loãng là
Đáp án : B Lời giải chi tiết :
Dãy kim loại phản ứng được với dung dịch H2SO4 loãng là K, Mg, Fe, Zn. Loại A vì Cu không phản ứng Loại C vì Ag không phản ứng Loại D vì Au và Pt không phản ứng
Câu 7 :
Cho 0,52 gam hỗn hợp 2 kim loại Mg, Al tan hoàn toàn trong dung dịch H2SO4 loãng dư thu được 0,336 lít khí ở đktc. Khối lượng muối sunfat thu được là:
Đáp án : C Phương pháp giải :
mmuối $ = {m_{KL}} + {m_{SO_4^{2 - }}}$ Lời giải chi tiết :
Áp dụng nhanh công thức : mmuối $ = {m_{KL}} + {m_{SO_4^{2 - }}}$= 0,52 + 0,015. 96 = 1,96 gam
Câu 8 :
Các khí sinh ra trong thí nghiệm phản ứng của saccarozơ với dung dịch H2SO4 đặc bao gồm
Đáp án : D Lời giải chi tiết :
C12H22O11 $\xrightarrow{{{H_2}S{O_4}}}$ 12C + 11H2O C + H2SO4 → CO2 + SO2 + H2O
Câu 9 :
Trộn 676 gam oleum với 360 gam dung dịch H2SO4 80% thu được một loại oleum chứa 15,44% khối lượng SO3. Xác định công thức oleum ban đầu
Đáp án : A Phương pháp giải :
+) Gọi oleum ban đầu là H2SO4.nSO3 => số mol SO3 trong oleum theo n +) Tính khối lượng H2SO4 và H2O trong dung dịch H2SO4 ban đầu +) Tính số mol SO3 dư : nSO3 dư = nSO3 trong oleum bđầu – nSO3 phản ứng +) Lượng SO3 dư này sẽ tạo ra oleum 15,44% SO3 => lập biểu thức %SO3 => n
Lời giải chi tiết :
Oleum ban đầu là H2SO4.nSO3 với số mol là: $\frac{676}{98+80n}\,mol$ $=>{{n}_{S{{O}_{3}}}}=\frac{676n}{98+80n}\,mol$ Dung dịch H2SO4 ban đầu chứa: \({{m}_{{{H}_{2}}S{{O}_{4}}}}=288\,gam ;\,\,{{m}_{{{H}_{2}}O}}=72\,gam\,=>{{n}_{{{H}_{2}}O}}=4\,mol\) SO3 + H2O → H2SO4 4mol ← 4mol → 4mol $=>{{n}_{S{{O}_{3}}\,du}}=\frac{676n}{98+80n}-4$ Lượng SO3 dư này sẽ tạo ra oleum 15,44% SO3 nên: $\%{{m}_{S{{O}_{3}}}}=\frac{80.\left[ \frac{676n}{98+80n}-4 \right]}{676+360}=15,44\%=>n=3$ Vậy oleum ban đầu là H2SO4.3SO3
Câu 10 :
Cho 10,3 gam hỗn hợp Cu, Al, Fe vào dung dịch HCl dư thu được 5,6 lít khí (đktc) và 2 gam chất rắn không tan. Vậy % theo khối lượng của từng chất trong hỗn hợp ban đầu lần lượt là
Đáp án : D Phương pháp giải :
+) Chất rắn không tan là Cu => mCu → %Cu
Lời giải chi tiết :
PTHH: 2Al + 6HCl -> 2AlCl3 + 3H2 Fe + 2HCl -> FeCl2 + H2 Vì Cu không tan nên mCu = 2g => %mCu = 19,4%
Câu 11 :
Dẫn mẫu khí thải của một nhà máy qua dung dịch Pb(NO3)2 dư thì thấy xuất hiện kết tủa màu đen. Hiện tượng đó chứng tỏ trong khí thải nhà máy có khí nào sau đây?
Đáp án : D Phương pháp giải :
+) Tra bảng tuần hoàn xem Pb2+ tạo kết tủa đen với ion nào => Ion => Khí tạo được ion Lời giải chi tiết :
Hợp chất của chì có kết tủa màu đen là PbS $ \to $Trong khí thải nhà máy có chứa khí H2S. PTHH : $Pb{(N{O_3})_2} + \,\,\,{H_2}S\xrightarrow{{}}PbS \downarrow \,\,\, + \,\,\,2HN{O_3}$
Câu 12 :
Trộn 5,6 gam bột sắt với 2,4 gam bột lưu huỳnh rồi nung nóng (trong điều kiện không có không khí), thu được hỗn hợp rắn M. Cho M tác dụng với lượng dư dung dịch HCl, giải phóng hỗn hợp khí X và còn lại một phần không tan G. Để đốt cháy hoàn toàn X và G cần vừa đủ V lít khí O2 (ở đktc). Giá trị của V là
Đáp án : A Phương pháp giải :
Ta có sơ đồ phản ứng : $Fe,\,\,S\xrightarrow{{{t^0}}}\left\{ \begin{gathered}Fe \hfill \\S \hfill \\FeS \hfill \\\end{gathered} \right.\xrightarrow{{ + HCl}}\left\{ \begin{gathered}FeC{l_2} \hfill \\S\,\,(G) \hfill \\{H_2}\,,\,\,{H_2}S\,\,(X) \hfill \\\end{gathered} \right.\xrightarrow{{ + {O_2}}}\left\{ \begin{gathered}S{O_2} \hfill \\{H_2}O \hfill \\\end{gathered} \right.$ Hỗn hợp khí X thu được gồm H2 , H2S. Chất rắn G là S dư. +) Ta thấy từ đầu đến cuối quá trình chỉ có Fe, S, O2 bị thay đổi số oxi hóa Sử dụng bảo toàn electron cho Fe, S, O2 => nO2 Lời giải chi tiết :
${n_{Fe}} = \frac{{5,6}}{{56}} = 0,1\,mol\,\,;\,\,{n_S} = \frac{{2,4}}{{32}} = 0,075\,mol$ Ta có sơ đồ phản ứng : $Fe,\,\,S\xrightarrow{{{t^0}}}\left\{ \begin{gathered}Fe \hfill \\S \hfill \\FeS \hfill \\\end{gathered} \right.\xrightarrow{{ + HCl}}\left\{ \begin{gathered}FeC{l_2} \hfill \\S\,\,(G) \hfill \\{H_2}\,,\,\,{H_2}S\,\,(X) \hfill \\\end{gathered} \right.\xrightarrow{{ + {O_2}}}\left\{ \begin{gathered}S{O_2} \hfill \\{H_2}O \hfill \\\end{gathered} \right.$ Hỗn hợp khí X thu được gồm H2 , H2S. Chất rắn G là S dư. Ta thấy từ đầu đến cuối quá trình chỉ có Fe, S, O2 bị thay đổi số oxi hóa Sử dụng bảo toàn electron cho Fe, S, O2 $\begin{gathered}Fe \to F{e^{2 + }} + 2e\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,{O_2} + 4e \to 2{O^{2 - }} \hfill \\\mathop S\limits^0 \to \mathop S\limits^{ + 4} + 4e \hfill \\\to {n_{{O_2}}} = \frac{{2.{n_{Fe}} + 4.{n_S}}}{4} = \frac{{2.0,1 + 4.0,075}}{4} = 0,125\,mol \to {V_{{O_2}}} = 0,125.22,4 = 2,8\,(l) \hfill \\\end{gathered} $
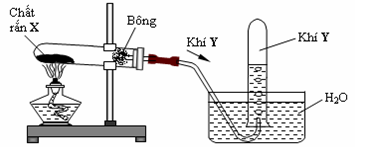
Câu 13 :
Cho hình vẽ mô tả thí nghiệm điều chế khí Y từ chất rắn X như sau
Hình vẽ trên minh họa cho phản ứng nào sau đây ?
Đáp án : B Phương pháp giải :
Thu được khí Y bằng phương pháp đẩy nước => Y không tan hoặc rất ít tan trong nước => chọn rắn X khi nhiệt phân tạo khí Y không tan hoặc rất ít tan trong nước Lời giải chi tiết :
Đun nóng rắn X thu được khí Y không bị hòa tan trong nước nên đáp án B vì khí tạo ra là O2 vì O2 không bị hòa tan trong nước còn NH3 và SO2 tan nhiều trong nước
Câu 14 :
Số electron lớp ngoài cùng của các nguyên tử nhóm halogen là
Đáp án : A Lời giải chi tiết :
Số electron lớp ngoài cùng của các nguyên tử nhóm halogen là 7
Câu 15 :
Ứng dụng không phải của clo là
Đáp án : D Lời giải chi tiết :
Ứng dụng không phải của clo là: Sản xuất chất dẻo teflon làm chất chống dính ở xoong, chảo
Câu 16 :
Cho V lít Cl2 (đktc) tác dụng với dung dịch NaOH loãng nguội, dư thu được m1 gam tổng khối lượng 2 muối. Cho V lít Cl2 (đktc) tác dụng với NaOH đặc, nóng thu được m2 gam tổng khối lượng hai muối. Tỷ lệ m1 : m2 bằng
Đáp án : C Phương pháp giải :
Dung dịch 1: Cl2 + 2NaOH → NaCl + NaClO + H2O Dung dịch 2: 3Cl2 + 6NaOH → 5NaCl + NaClO3 + 3H2O Lời giải chi tiết :
Giả sử V = 22,4 lít => nCl2 = 1 mol Cl2 + 2NaOH → NaCl + NaClO + H2O (mol) 1 1 1 m1 = mNaCl+ mNaClO = 133 gam 3Cl2 + 6NaOH → 5NaCl + NaClO3 + 3H2O (mol) 1 5/3 1/3 m2 = mNaCl+ mNaClO3 = 133 gam Tỷ lệ m1 : m2 bằng 1:1
Câu 17 :
Dãy các chất nào sau đây đều tác dụng với axit clohiđric ?
Đáp án : B Lời giải chi tiết :
Dãy các chất nào sau đây đều tác dụng với axit clohiđric là: Fe2O3, KMnO4, Fe, CuO, AgNO3
Câu 18 :
Brom bị lẫn tạp chất là clo. Cách nào sau đây có thể thu được brom tinh khiết ?
Đáp án : C Phương pháp giải :
Xem lại lí thuyết hợp chất không có oxi của halogen Lời giải chi tiết :
Dẫn hỗn hợp khí đi qua dung dịch NaBr 2NaBr + Cl2 → 2NaCl + Br2
Câu 19 :
Có các hóa chất sau đựng riêng biệt trong các lọ mất nhãn: KCl, MgCl2, FeCl2, FeCl3, AlCl3, NH4Cl, (NH4)2SO4. Thuốc thử có thể dùng để nhận biết các hóa chất trên là
Đáp án : B Phương pháp giải :
Gợi ý : Dùng Ba(OH)2 Lời giải chi tiết :
Dùng Ba(OH)2 dư cho từ từ vào các dung dịch mẫn nhãn trên KCl: không có hiện tượng gì MgCl2: xuất hiện kết tủa trắng MgCl2 + Ba(OH)2 → Mg(OH)2↓ + BaCl2 FeCl2: xuất hiện kết tủa trắng xanh sau đó một thời gian chuyển sang nâu đỏ FeCl2 + Ba(OH)2 → Fe(OH)2↓ + BaCl2 4Fe(OH)2 ↓trắng xanh + O2 + 2H2O → 4Fe(OH)3↓ nâu đỏ FeCl3: xuất hiện màu nâu đỏ 2FeCl3+ 3Ba(OH)2 → 2Fe(OH)3↓ + 3BaCl2 AlCl3: Ban đầu xuất hiện kết tủa trắng keo, sau đó kết tủa tan dần đến hết AlCl3+ Ba(OH)2 → Al(OH)3↓ + BaCl2 2Al(OH)3 + Ba(OH)2 → Ba(AlO2)2 + 4H2O NH4Cl: xuất hiện khí trong dung dịch 2NH4Cl + Ba(OH)2 → BaCl2 + 2NH3↑ + H2O (NH4)2SO4: đồng thời xuất hiện bọt khí và kết tủa trắng (NH4)2SO4 + Ba(OH)2 → BaSO4↓ + 2NH3↑ + 2H2O
Câu 20 :
H2S bị oxi hóa thành lưu huỳnh màu vàng khi: 1) Dẫn khí H2S qua dung dịch FeCl3 2) Để dung dịch H2S ngoài trời 3) Đốt khí H2S ở điều kiện thiếu oxi
Đáp án : B Phương pháp giải :
Xem lại tính chất hóa học của hiđro sunfua Lời giải chi tiết :
H2S + 2FeCl3 → 2FeCl2 + S↓ + 2HCl 2H2S + O2 → 2S↓ + 2H2O
Câu 21 :
Đun nóng 20 gam một hỗn hợp X gồm Fe và S trong điều kiện không có không khí thu được hỗn hợp rắn A. Hòa tan hỗn hợp rắn A vào dung dịch HCl thu được 6,72 lít (đktc) hỗn hợp khí Y. Thành phần phần trăm khối lượng Fe trong X là:
Đáp án : D Phương pháp giải :
Y gồm H2S : a mol và H2 b mol A gồm FeS và Fe dư nFe dư = nH2 = b nS = nFeS = nH2S = a mol BTNT Fe => nFe bđ = a + b Giải hệ pt 2 ẩn a, b => %Fe Lời giải chi tiết :
Y gồm H2S : a mol và H2 b mol => a+b = 0,3 (1) A gồm FeS và Fe dư nFe dư = nH2 = b nS = nFeS = nH2S = a mol BTNT Fe => nFe bđ = a + b Ta có: 56. (a+b) + 32. a = 20 (2) Từ (1)(2) => a = 0,1; b = 0,2 %Fe = (0,3.56.100): 20 =84%
Câu 22 :
Trong những câu sau, câu nào sai khi nói về tính chất hóa học của ozon?
Đáp án : A Phương pháp giải :
Xem lại tính chất hóa học của ozon Lời giải chi tiết :
Ozon oxi hóa được hầu hết các kim loại trừ Au và Pt
Câu 23 :
Trong phản ứng S + H2SO4 đặc -> SO2 + H2O, đơn chất S đã
Đáp án : C Lời giải chi tiết :
Trong phản ứng trên đơn chất S đã nhường đi 4e
Câu 24 :
Hấp thụ hết 4,48 lít SO2 (đktc) vào dung dịch chứa x mol KOH và y mol K2CO3 thu được 200 ml dung dịch X. Mặt khác, 100 ml dung dịch X tác dụng với dung dịch Ba(OH)2 dư thu được 39,4 gam kết tủa. Nếu thay SO2bằng CO2, K2SO3 bằng K2CO3 ta được 200 ml dung dịch Y. Lấy 200 ml dung dịch Y cho từ từ vào 600 ml dung dịch HCl 0,5M thu được 5,376 lít khí (đktc). Giá trị của x là:
Đáp án : B Phương pháp giải :
+) nBaCO3 = nC(100 ml X) = 0,2 mol +) Bảo toàn C : nCO2 bđ + nK2CO3 = nC(100 ml X) Giả sử trong 100 ml X có a mol K2CO3 và b mol KHCO3 Bảo toàn C: a + b = 0,2.2 = 0,4 mol Cho từ từ X vào nHCl = 0,3 mol tạo nCO2 = 0,24 mol => K2CO3 và KHCO3 phản ứng đồng thời (vì HCl lúc đầu dư) theo tỉ lệ mol a : b Gọi nK2CO3 pứ = ax và nKHCO3 pứ = bx => 2ax + bx = nHCl = 0,3 mol ; ax + bx = nCO2 = 0,24 mol +) Bảo toàn K : x + 2y = 2.(2a + b) Lời giải chi tiết :
nCO2 bđ = 0,4 mol 100 ml X + Ba(OH)2 => nBaCO3 = nC(100 ml X) = 0,2 mol => Trong 200 ml X có 0,8 mol C => Bảo toàn C : nCO2 bđ + nK2CO3 = nC(X) => nK2CO3 = y = 0,4 mol Giả sử trong 100 ml X có a mol K2CO3 và b mol KHCO3 Bảo toàn C: a + b = 0,2.2 = 0,4 mol Cho từ từ X vào nHCl = 0,3 mol tạo nCO2 = 0,24 mol => K2CO3 và KHCO3 phản ứng đồng thời (vì HCl lúc đầu dư) theo tỉ lệ mol a : b Gọi nK2CO3 pứ = ax và nKHCO3 pứ = bx => 2ax + bx = nHCl = 0,3 mol ; ax + bx = nCO2 = 0,24 mol => ax = 0,06 và bx = 0,18 mol => a : b = 1 : 3 => a = 0,1 ; b = 0,3 mol => Bảo toàn K : x + 2y = 2.(2a + b) => x = 0,2 mol
Câu 25 :
Cho m gam hỗn hợp kim loại A gồm Mg, Al, Zn bằng dung dịch H2SO4 loãng, dư thu được 1,344 lít khí ở đktc. Mặt khác, khi hòa tan hoàn toàn hỗn hợp A bằng dung dịch H2SO4 đặc, nóng dư thu được V lít khí SO2 (đktc). Tìm giá trị của V
Đáp án : A Phương pháp giải :
n ax loãng nhận = n ax đặc nhận Lời giải chi tiết :
Gọi số mol của SO2 là a mol n ax loãng nhận = n ax đặc nhận <=> 0,06. 2 = a. 2 => a = 0,06 mol V = 0,06. 22,4 = 1,344 lít
Câu 26 :
Người ta nghiền nguyên liệu trước khi đưa vào lò nung để sản xuất clanhke (trong quá trình sản xuất xi măng) là đã tăng yếu tố nào sau đây để tăng tốc độ của phản ứng?
Đáp án : C Phương pháp giải :
Dựa vào các phương pháp làm tăng tốc độ của phản ứng. Lời giải chi tiết :
Người ta nghiền nguyên liệu trước khi đưa vào lò nung để sản xuất clanhke (trong quá trình sản xuất xi măng) là đã tăng diện tích bề mặt chất phản ứng để tăng tốc độ của phản ứng
Câu 27 :
Yếu tố nào dưới đây đã được sử dụng để làm tăng tốc độ phản ứng khi rắc men vào tinh bột đã được nấu chín (cơm, ngô, khoai, sắn) để ủ rượu?
Đáp án : C Lời giải chi tiết :
Men là chất xúc tác để làm tăng tốc độ phản ứng lên men tinh bột thành rượu.
Câu 28 :
Yếu tố nào sau đây không gây ra sự chuyển dịch cân bằng của phản ứng thuận nghịch nói chung ?
Đáp án : D Phương pháp giải :
Các yếu tố gây ra sự chuyển dịch cân bằng của phản ứng thuận nghịch nói chung là: nhiệt độ, áp suất và nồng độ. Lời giải chi tiết :
Các yếu tố gây ra sự chuyển dịch cân bằng của phản ứng thuận nghịch nói chung là: nhiệt độ, áp suất và nồng độ. Yếu tố xúc tác không làm cân bằng chuyển dịch.
Câu 29 :
Chọn khẳng định không đúng:
Đáp án : D Lời giải chi tiết :
A, B, C đúng D sai vì chất xúc tác không làm chuyển dịch cân bằng
Câu 30 :
Đổ một lượng dung dịch H2SO4 vào cốc đựng dung dịch Na2S2O3 được 40 ml dung dịch X. Nồng độ ban đầu của H2SO4 trong dung dịch X bằng 0,05M. Sau 20 giây quan sát phản ứng, thấy nồng độ H2SO4 chỉ còn 15% so với ban đầu và trong cốc xuất hiện m gam kết tủa vàng. Tốc độ trung bình của phản ứng trong 20 giây quan sát (tính theo H2SO4) và giá trị của m lần lượt là
Đáp án : D Phương pháp giải :
Công thức tính tốc độ trung bình của phản ứng trong khoảng thời gian Δt (s) theo H2SO4 là \(\overline v = \dfrac{{\Delta {C_{{H_2}S{O_4}}}}}{{\Delta t}}\) PTHH của phản ứng xảy ra: Na2S2O3 + H2SO4 → S↓ + SO2 + H2O + Na2SO4 Lời giải chi tiết :
Sau 20 giây quan sát phản ứng, thấy nồng độ H2SO4 chỉ còn 15% so với ban đầu ⟹ Nồng độ H2SO4 đã phản ứng bằng 100% – 15% = 85% nồng độ ban đầu ⟹ ∆CH2SO4 = CH2SO4(pứ) = 0,05.85% = 0,0425 M. ⟹ nH2SO4 (pứ) = 0,0425.0,04 = 1,7.10-3 mol. Tốc độ trung bình của phản ứng trong khoảng thời gian 20 giây theo H2SO4 là \(\overline v = \dfrac{{0,0425}}{{20}} = 2,{125.10^{ - 3}}\) mol/(l.s) PTHH của phản ứng xảy ra: Na2S2O3 + H2SO4 → S↓ + SO2 + H2O + Na2SO4 ⟹ nS ↓ = nH2SO4 pứ = 1,7.10-3 mol Vậy khối lượng kết tủa vàng là m = mS = 1,7.10-3.32 = 0,0544 g. |




















Danh sách bình luận