Đề kiểm tra 15 phút Hóa 10 chương 4: Phản ứng oxi hóa - khử - Đề số 2Đề bài
Câu 1 :
Cho quá trình sau: $\overset{+\text{3}}{\mathop{\text{Fe}}}\,$ + 1e → $\overset{+\text{2}}{\mathop{\text{Fe}}}\,$. Trong các kết luận sau, kết luận nào là đúng?
Câu 2 :
Trong các phản ứng hóa học, SO2 có thể là chất oxi hoá hoặc chất khử vì
Câu 3 :
Hòa tan hoàn toàn 11,9 gam hỗn hợp gồm Al và Zn bằng H2SO4 đặc nóng thu được 7,616 lít SO2 (đktc), 0,64 gam S và dung dịch X. Khối lượng muối trong dung dịch X là:
Câu 4 :
Hòa tan hoàn toàn Fe3O4 trong dung dịch H2SO4 loãng dư thu được dung dịch X. Dung dịch tác dụng được với chất nào sau đây không xảy ra phản ứng oxi hóa khử:
Câu 5 :
Dấu hiệu để nhận biết một phản ứng oxi hóa khử:
Câu 6 :
Chọn phát biểu đúng trong các phát biểu sau ?
Câu 7 :
Cho phản ứng: KMnO4 + FeSO4 + H2SO4 → Fe2(SO4)3 + K2SO4 + MnSO4 + H2O Hệ số của chất oxi hóa và chất khử trong phản ứng trên lần lượt là
Câu 8 :
Trong phản ứng nào dưới đây HCl thể hiện tính oxi hoá?
Câu 9 :
Cho quá trình NO3- + 3e + 4H+ → NO + 2H2O, đây là quá trình
Câu 10 :
Dấu hiệu để nhận biết một phản ứng oxi hóa – khử là
Lời giải và đáp án
Câu 1 :
Cho quá trình sau: $\overset{+\text{3}}{\mathop{\text{Fe}}}\,$ + 1e → $\overset{+\text{2}}{\mathop{\text{Fe}}}\,$. Trong các kết luận sau, kết luận nào là đúng?
Đáp án : B Lời giải chi tiết :
Quá trình nhận electron gọi là quá trình khử (sự khử)
Câu 2 :
Trong các phản ứng hóa học, SO2 có thể là chất oxi hoá hoặc chất khử vì
Đáp án : C Phương pháp giải :
Chất khử cho e, chất oxi hóa nhận e => chất vừa có khả năng cho e, vừa có khả năng nhận e Lời giải chi tiết :
SO2 có thể là chất oxi hoá hoặc chất khử vì lưu huỳnh trong SO2 có số oxi hóa trung gian.
Câu 3 :
Hòa tan hoàn toàn 11,9 gam hỗn hợp gồm Al và Zn bằng H2SO4 đặc nóng thu được 7,616 lít SO2 (đktc), 0,64 gam S và dung dịch X. Khối lượng muối trong dung dịch X là:
Đáp án : A Lời giải chi tiết :
${{n}_{S{{O}_{2}}}}=0,34\,\,mol;\,\,{{n}_{S}}=0,02\,\,mol$ Nhận e: $\overset{+6}{\mathop{S}}\,$ + 2e → $\overset{+4}{\mathop{S}}\,$ (SO2) $\overset{+6}{\mathop{S}}\,$ + 6e → $\overset{0}{\mathop{S}}\,$ 0,68 ← 0,34 0,12 ← 0,02 Bảo toàn e: ne cho = ne nhận = 2.nSO2 + 6.nS = 0,68 + 0,12 = 0,8 mol => ${{m}_{SO_{4}^{2-}}}$ trong muối kim loại = $\frac{{{n}_{e\text{ }cho}}}{2}$ = 0,4 mol => mmuối = mKL + mgốc SO4 = 11,9 + 0,4.96 = 50,3 gam
Câu 4 :
Hòa tan hoàn toàn Fe3O4 trong dung dịch H2SO4 loãng dư thu được dung dịch X. Dung dịch tác dụng được với chất nào sau đây không xảy ra phản ứng oxi hóa khử:
Đáp án : B Phương pháp giải :
Định nghĩa phản ứng oxi hóa – khử: Phản ứng oxi hóa khử xảy ra khi có sự thay đổi số oxi hóa của các nguyên tố. Lời giải chi tiết :
Fe3O4 + 4H2SO4 → FeSO4 + Fe2(SO4)3 + 4H2O Dung dịch X gồm Fe2+, Fe3+, H+, SO42-. Phản ứng oxi hóa - khử là phản ứng có sự thay đổi số oxi hóa của các nguyên tố. Khi NaOH phản ứng với Fe2+, Fe3+ và H+ đều là phản ứng trao đổi (không có sự thay đổi số oxi hóa của các nguyên tố)
Câu 5 :
Dấu hiệu để nhận biết một phản ứng oxi hóa khử:
Đáp án : D Lời giải chi tiết :
Phản ứng oxi hóa - khử là phản ứng có sự thay đổi số oxi hóa của một số nguyên tố
Câu 6 :
Chọn phát biểu đúng trong các phát biểu sau ?
Đáp án : D Phương pháp giải :
- Ghi nhớ câu “khử cho – o nhận” + Chất khử là chất cho e (bị oxi hóa) + Chất oxi hóa là chất nhận e (bị khử) - Quá trình cho e là quá trình oxi hóa, quá trình nhận e là quá trình khử. Lời giải chi tiết :
Phát biểu đúng là “quá trình nhường electron là quá trình oxi hóa.”
Câu 7 :
Cho phản ứng: KMnO4 + FeSO4 + H2SO4 → Fe2(SO4)3 + K2SO4 + MnSO4 + H2O Hệ số của chất oxi hóa và chất khử trong phản ứng trên lần lượt là
Đáp án : B Phương pháp giải :
Cân bằng phản ứng oxi hóa khử bằng phương pháp thăng bằng electron. Chất khử là chất cho e, chất oxi hóa là chất nhận e. Lời giải chi tiết :
2KMnO4 + 10FeSO4 + 8H2SO4 → 5Fe2(SO4)3 + K2SO4 + 2MnSO4 + 8H2O Chất oxi hóa là KMnO4 có hệ số là 2 Chất khử là FeSO4 có hệ số là 10
Câu 8 :
Trong phản ứng nào dưới đây HCl thể hiện tính oxi hoá?
Đáp án : B Phương pháp giải :
Chất oxi hóa là chất nhận electron. Lời giải chi tiết :
Ở phản ứng: HCl + Mg → MgCl2 + H2 ta thấy HCl nhận e nên là chất oxi hóa: 2H+ + 2e → H2
Câu 9 :
Cho quá trình NO3- + 3e + 4H+ → NO + 2H2O, đây là quá trình
Đáp án : C Lời giải chi tiết :
Ta thấy quá trình trên là quá trình nhận e nên là quá trình khử.
Câu 10 :
Dấu hiệu để nhận biết một phản ứng oxi hóa – khử là
Đáp án : D Lời giải chi tiết :
Phản ứng oxi hóa khử là phản ứng có sự thay đổi số oxi hóa của một hay nhiều nguyên tố. |














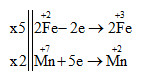






Danh sách bình luận