Đề kiểm tra 15 phút Hóa 10 chương 3: Liên kết hóa học - Đề số 1Đề bài
Câu 1 :
Để đạt đến trạng thái bền vững theo quy tắc bát tử, nguyên tử Al cần
Câu 2 :
Cho độ âm điện Ca (1,00), Cl (3,16). Liên kết trong phân tử CaCl2 thuộc loại
Câu 3 :
Cho các ion: Na+, Mg2+, Al3+, Ca2+, S2-, Cl-, O2-. Số ion có 10e là:
Câu 4 :
Nhận định nào sau đây là đúng về điện hoá trị:
Câu 5 :
Số oxi hóa của N, O, S, Cl, Br, Cr, Mn trong các chất và ion: NH4+, CH3COOH, SO42–, Cl2, KBrO3, K2Cr2O7, K2MnO4 lần lượt là:
Câu 6 :
Cho dãy các chất : N2, H2, NH3, CO2, HCl, H2O, C2H4. Số chất mà phân tử chỉ chứa liên kết đơn là :
Câu 7 :
Kiểu liên kết tạo nên giữa hai nguyên tử bằng một hay nhiều cặp electron chung được gọi là
Câu 8 :
Ion nào là ion đơn nguyên tử?
Câu 9 :
Liên kết ion là liên kết được hình thành bởi
Câu 10 :
Cộng hoá trị của 1 nguyên tố là:
Lời giải và đáp án
Câu 1 :
Để đạt đến trạng thái bền vững theo quy tắc bát tử, nguyên tử Al cần
Đáp án : A Lời giải chi tiết :
Cấu hình e của Al: 1s22s22p63s23p1 => nguyên tử Al cần cho 3e để đạt cấu hình bền vững của Ne (1s22s22p6)
Câu 2 :
Cho độ âm điện Ca (1,00), Cl (3,16). Liên kết trong phân tử CaCl2 thuộc loại
Đáp án : B Lời giải chi tiết :
∆x = 3,16 – 1 = 2,16 > 1,7 => liên kết ion
Câu 3 :
Cho các ion: Na+, Mg2+, Al3+, Ca2+, S2-, Cl-, O2-. Số ion có 10e là:
Đáp án : C Phương pháp giải :
+) Xác định số e trong từng nguyên tố, sau đó xác định số e của ion +) Số e của ion dương = số e nguyên tử - số đơn vị điện tích +) Số e của ion âm = số e nguyên tử + số đơn vị điện tích Lời giải chi tiết :
Na có Z = 11 => số e = 11 => ion Na+ có số e = 11 – 1 = 10 Mg có Z = 12 => số e = 12 => ion Mg2+ có số e = 12 – 2 = 10 Al có Z = 13 => số e = 13 => ion Al3+ có số e = 13 – 3 = 10 Ca có Z = 20 => số e = 20 => ion Ca2+ có số e = 20 – 2 = 18 S có Z = 16 => số e = 16 => ion S2- có số e = 16 + 2 = 18 Cl có Z = 17 => số e = 17 => ion Cl- có số e = 17 + 1 = 18 O có Z = 8 => số e = 8 => ion O2- có số e = 8 + 2 = 10 Vậy có 4 ion có 10e
Câu 4 :
Nhận định nào sau đây là đúng về điện hoá trị:
Đáp án : B Phương pháp giải :
Trong hợp chất ion, hóa trị của một nguyên tố bằng điện tích của ion và được gọi là điện hóa trị của nguyên tố đó. Lời giải chi tiết :
Trong hợp chất ion, hóa trị của một nguyên tố bằng điện tích của ion và được gọi là điện hóa trị của nguyên tố đó. => Nhận định đúng về điện hóa trị là: B
Câu 5 :
Số oxi hóa của N, O, S, Cl, Br, Cr, Mn trong các chất và ion: NH4+, CH3COOH, SO42–, Cl2, KBrO3, K2Cr2O7, K2MnO4 lần lượt là:
Đáp án : C Lời giải chi tiết :
\(\overset{-3}{\mathop{N}}\,{{\overset{+1}{\mathop{H}}\,}_{4}}^{+},\text{ }{{\text{C}}_{2}}{{\overset{{}}{\mathop{H}}\,}_{4}}{{\overset{-2}{\mathop{O}}\,}_{2}},\text{ }\overset{+6}{\mathop{S}}\,{{\overset{-2}{\mathop{O}}\,}_{4}}^{2-},\text{ }{{\overset{0}{\mathop{Cl}}\,}_{2}},\text{ }\overset{+1}{\mathop{K}}\,\overset{+5}{\mathop{Br}}\,{{\overset{-2}{\mathop{O}}\,}_{3}},\text{ }{{\overset{+1}{\mathop{K}}\,}_{2}}{{\overset{+6}{\mathop{Cr}}\,}_{2}}{{\overset{-2}{\mathop{O}}\,}_{7}},\text{ }{{\overset{+1}{\mathop{K}}\,}_{2}}\overset{+6}{\mathop{Mn}}\,{{\overset{-2}{\mathop{O}}\,}_{4}}\) => Số oxi hóa của N, O, S, Cl, Br, Cr, Mn lần lượt là: -3 ; -2; +6 ; 0 ; +5; +6 ; +6
Câu 6 :
Cho dãy các chất : N2, H2, NH3, CO2, HCl, H2O, C2H4. Số chất mà phân tử chỉ chứa liên kết đơn là :
Đáp án : A Lời giải chi tiết :
Các chất chỉ chứa liên kết đơn là: H2, NH3, HCl, H2O
Câu 7 :
Kiểu liên kết tạo nên giữa hai nguyên tử bằng một hay nhiều cặp electron chung được gọi là
Đáp án : A Lời giải chi tiết :
Liên kết cộng hóa trị được hình thành giữa hai nguyên tử bằng một hay nhiều cặp electron dùng chung.
Câu 8 :
Ion nào là ion đơn nguyên tử?
Đáp án : C Phương pháp giải :
Ion đơn nguyên tử là ion được cấu tạo từ 1 nguyên tử. Lời giải chi tiết :
Cl- là ion đơn nguyên tử.
Câu 9 :
Liên kết ion là liên kết được hình thành bởi
Đáp án : A Lời giải chi tiết :
Liên kết ion là liên kết được hình thành bởi lực hút tĩnh điện giữa các ion mang điện tích trái dấu.
Câu 10 :
Cộng hoá trị của 1 nguyên tố là:
Đáp án : D Lời giải chi tiết :
Cộng hoá trị của 1 nguyên tố là số liên kết của nguyên tử nguyên tố đó trong phân tử. |














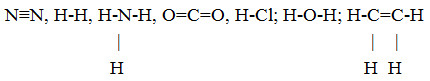






Danh sách bình luận