Đề kiểm tra 1 tiết Hóa 10 chương 3: Liên kết hóa học - Đề số 1Đề bài
Câu 1 :
Liên kết ion là liên kết được tạo thành bởi
Câu 2 :
Các nguyên tử kết hợp lại với nhau nhằm mục đích tạo thành cấu trúc mới
Câu 3 :
Khi tạo thành liên kết ion, nguyên tử dễ nhường electron là nguyên tử
Câu 4 :
Công thức electron của Cl2 là :
Câu 5 :
Trong phân tử CH4 có bao nhiêu liên kết ?
Câu 6 :
Cho độ âm điện Ca (1,00), Cl (3,16). Liên kết trong phân tử CaCl2 thuộc loại
Câu 7 :
Cho độ âm điện các chất : Be (1,57), Al (1,61), Mg (1,31), Cl (3,16), N (3,04), H (2,2), S (2,58), O (3,44). Chất có liên kết ion là
Câu 8 :
Cho các nguyên tố : Na (0,93), Ca (1,00), H (2,2), O (3,44), S (2,58) có thể tạo ra bao nhiêu phân tử hợp chất có khối lượng phân tử nhỏ hơn 82 mà trong phân tử chỉ có liên kết cộng hóa trị?
Câu 9 :
Điện hóa trị của Al trong hợp chất AlCl3 là
Câu 10 :
Chỉ ra nội dung sai khi hoàn thành câu sau : “Trong tất cả các hợp chất,...”
Câu 11 :
Hợp chất mà nguyên tố clo có số oxi hoá +3 là :
Câu 12 :
Số oxi hóa của nguyên tử C trong CO2, H2CO3, HCOOH, CH4 lần lượt là
Câu 13 :
Nhận định không chính xác về liên kết ion là:
Câu 14 :
Cấu hình e lớp ngoài cùng của ion K+ (Z = 19) là:
Câu 15 :
Cho các ion: Na+, Mg2+, Al3+, Ca2+, S2-, Cl-, O2-. Số ion có 10e là:
Câu 16 :
Nhận định nào sau đây chưa chính xác về hoá trị trong hợp chất cộng hoá trị:
Câu 17 :
Ion nào sau đây là ion đa nguyên tử
Câu 18 :
Chất nào chỉ chứa liên kết đơn?
Câu 19 :
Hoá trị trong hợp chất ion được gọi là :
Câu 20 :
Kiểu liên kết tạo nên giữa hai nguyên tử bằng một hay nhiều cặp electron chung được gọi là
Câu 21 :
Trong phân tử sẽ có liên kết cộng hoá trị phân cực nếu cặp electron chung...
Câu 22 :
Cho các nguyên tố: X (Z= 11), Y (Z= 17). Liên kết hoá học giữa X và Y thuộc loại...
Câu 23 :
Nước đá khô thường được dùng để làm lạnh, giữ lạnh nhằm vận chuyển và bảo quản các sản phẩm dễ hư hỏng vì nhiệt độ. Nước đá khô được dùng nhiều trong các ngành công nghiệp thực phẩm, thủy hải sản và còn được dùng để bảo quản vắc xin, dược phẩm trong ngành Y tế – dược phẩm. Thành phàn nước đá khô là CO2, hãy chỉ ra nội dung sai.
Câu 24 :
Liên kết hóa học trong phân tử Br2 thuộc loại liên kết
Câu 25 :
Chỉ ra nội dung sai khi nói về ion:
Câu 26 :
Ion nào là ion đơn nguyên tử?
Câu 27 :
Cộng hoá trị của 1 nguyên tố là:
Câu 28 :
Quá trình hình thành liên kết nào dưới đây được mô tả đúng?
Câu 29 :
Trong số các chất sau: HF, CaO, CH4, N2, Số lượng các chất có liên kết cộng hóa trị và liên kết ion lần lượt là
Câu 30 :
Công thức hóa học của hợp chất tạo bởi nhôm và nhóm nitrat (NO3-) là:
Lời giải và đáp án
Câu 1 :
Liên kết ion là liên kết được tạo thành bởi
Đáp án : D Lời giải chi tiết :
Liên kết ion là liên kết được hình thành bởi lực hút tĩnh điện giữa các ion mang điện trái dấu
Câu 2 :
Các nguyên tử kết hợp lại với nhau nhằm mục đích tạo thành cấu trúc mới
Đáp án : C Lời giải chi tiết :
Các nguyên tử kết hợp lại với nhau nhằm mục đích tạo thành cấu trúc mới bền vững hơn cấu trúc ban đầu.
Câu 3 :
Khi tạo thành liên kết ion, nguyên tử dễ nhường electron là nguyên tử
Đáp án : C Phương pháp giải :
+) Độ âm điện biểu hiện khả năng hút e mạnh hay yếu của nguyên tử => ảnh hưởng đến sự nhường e + Năng lượng ion hóa là năng lượng cần để tách 1 electron ra khỏi nguyên tử => ảnh hưởng đến sự nhường e +) Số khối và số hiệu nguyên tử không ảnh hưởng đến sự nhường e Lời giải chi tiết :
Khi tạo thành liên kết ion, nguyên tử dễ nhường electron là nguyên tử có năng lượng ion hóa nhỏ hơn.
Câu 4 :
Công thức electron của Cl2 là :
Đáp án : A Phương pháp giải :
Bước 1: Xác định cấu hình electron các nguyên tử Bước 2: Xác định số e thiếu để đạt cấu hình bền của khí hiếm => số e góp chung = số e thiếu Bước 3: Viết công thức electron thỏa mãn quy tắc bát tử Lời giải chi tiết :
Clo có cấu hình e: 1s22s22p63s23p5 => mỗi nguyên tử góp chung 1e tạo cấu hình bền => Công thức electron của Cl2 là : $:\underset{.\,\,.}{\overset{.\,\,.}{\mathop{Cl}}}\,:\underset{.\,\,.}{\overset{.\,\,.}{\mathop{Cl}}}\,:$
Câu 5 :
Trong phân tử CH4 có bao nhiêu liên kết ?
Đáp án : A Phương pháp giải :
Bước 1: Xác định cấu hình electron các nguyên tử Bước 2: Xác định số e thiếu để đạt cấu hình bền của khí hiếm => số e góp chung = số e thiếu Bước 3: Viết công thức electron thỏa mãn quy tắc bát tử => công thức cấu tạo => số liên kết Lời giải chi tiết :
C: 1s22s22p2 => góp chung 4e H: 1s1 => góp chung 1e => 1 nguyên tử C liên kết với 4 nguyên tử H $H:\underset{\overset{.\,\,.}{\mathop{H}}\,}{\overset{\underset{.\,\,.}{\mathop{H}}\,}{\mathop{C}}}\,:H\,\,\,\,hay\,\,\,\,\,H-\underset{\overset{|}{\mathop{H}}\,}{\overset{\underset{|}{\mathop{H}}\,}{\mathop{C}}}\,-H$ => trong phân tử CH4 có 4 liên kết đơn (4 liên kết )
Câu 6 :
Cho độ âm điện Ca (1,00), Cl (3,16). Liên kết trong phân tử CaCl2 thuộc loại
Đáp án : B Lời giải chi tiết :
∆x = 3,16 – 1 = 2,16 > 1,7 => liên kết ion
Câu 7 :
Cho độ âm điện các chất : Be (1,57), Al (1,61), Mg (1,31), Cl (3,16), N (3,04), H (2,2), S (2,58), O (3,44). Chất có liên kết ion là
Đáp án : C Phương pháp giải :
Xem lại lí thuyết liên kết cộng hóa trị Lời giải chi tiết :
Hợp chất có liên kết ion là hợp chất có hiệu độ âm điện ∆x ≥ 1,7 A loại vì H2S có ∆x = 2,58 – 2,2 = 0,38 B loại vì BeCl2 có ∆x = 3,16 – 1,57 = 1,59 < 1,7 C thỏa mãn vì MgO có ∆x = 3,44 – 1,31 = 2,13 > 1,7 và Al2O3 có ∆x = 3,44 – 1,61 = 1,83 > 1,7 D loại vì AlCl3 có ∆x = 3,16 – 1,61 = 1,55 < 1,7
Câu 8 :
Cho các nguyên tố : Na (0,93), Ca (1,00), H (2,2), O (3,44), S (2,58) có thể tạo ra bao nhiêu phân tử hợp chất có khối lượng phân tử nhỏ hơn 82 mà trong phân tử chỉ có liên kết cộng hóa trị?
Đáp án : A Lời giải chi tiết :
Các chất có liên kết cộng hóa trị hình thành giữa các phi kim với nhau => Có thể là H2O, H2O2, H2S, SO2, SO3, H2SO3 Xét khối lượng phân tử của chúng chỉ có H2SO3 có khối lượng phân tử bằng 82 => các chất thỏa mãn yêu cầu là: H2O, H2O2, H2S, SO2, SO3
Câu 9 :
Điện hóa trị của Al trong hợp chất AlCl3 là
Đáp án : D Lời giải chi tiết :
Điện hóa trị của Al trong hợp chất AlCl3 là 3+
Câu 10 :
Chỉ ra nội dung sai khi hoàn thành câu sau : “Trong tất cả các hợp chất,...”
Đáp án : B Lời giải chi tiết :
Câu sai là: “Trong tất cả các hợp chất, halogen luôn có số oxi hoá –1” Ví dụ trong hợp chất NaBrO thì Br có số oxi hóa +1
Câu 11 :
Hợp chất mà nguyên tố clo có số oxi hoá +3 là :
Đáp án : B Lời giải chi tiết :
Gọi số oxi hóa của Cl là x Xét NaClO: +1 + x + (-2) = 0 => x = +1 Xét NaClO2: +1 + x + 2.(-2) = 0 => x = +3 Xét NaClO3: +1 + x + 3.(-2) = 0 => x = +5 Xét NaClO4 : +1 + x + 4.(-2) = 0 => x = +7 => Hợp chất mà nguyên tố clo có số oxi hoá +3 là NaClO2
Câu 12 :
Số oxi hóa của nguyên tử C trong CO2, H2CO3, HCOOH, CH4 lần lượt là
Đáp án : C Lời giải chi tiết :
$\overset{+4}{\mathop{C}}\,{{\overset{-2}{\mathop{O}}\,}_{2}},\text{ }{{\overset{+1}{\mathop{H}}\,}_{2}}\overset{+4}{\mathop{C}}\,{{\overset{-2}{\mathop{O}}\,}_{3}},\text{ }\overset{+1}{\mathop{H}}\,\overset{+2}{\mathop{C}}\,\overset{-2}{\mathop{O}}\,\overset{-2}{\mathop{O}}\,\overset{+1}{\mathop{H}}\,,\text{ }\overset{-4}{\mathop{C}}\,{{\overset{+1}{\mathop{H}}\,}_{4}}$
Câu 13 :
Nhận định không chính xác về liên kết ion là:
Đáp án : D Lời giải chi tiết :
Nhận định không chính xác về liên kết ion là: Được hình thành bởi các cặp e chung. Liên kết ion là liên kết được hình thành bởi lực hút tĩnh điện giữa các ion mang điện trái dấu
Câu 14 :
Cấu hình e lớp ngoài cùng của ion K+ (Z = 19) là:
Đáp án : D Phương pháp giải :
+) Viết cấu hình e của K (Z = 19) +) Nguyên tử K cho 1e để tạo thành ion K+ => Cấu hình e của ion K+ => Cấu hình e lớp ngoài cùng của ion K+ Lời giải chi tiết :
Cấu hình e của K (Z = 19) là: 1s22s22p63s23p64s1 Nguyên tử K cho 1e để tạo thành ion K+ => Cấu hình e của ion K+ là: 1s22s22p63s23p6 => Cấu hình e lớp ngoài cùng của ion K+ : 3s23p6.
Câu 15 :
Cho các ion: Na+, Mg2+, Al3+, Ca2+, S2-, Cl-, O2-. Số ion có 10e là:
Đáp án : C Phương pháp giải :
+) Xác định số e trong từng nguyên tố, sau đó xác định số e của ion +) Số e của ion dương = số e nguyên tử - số đơn vị điện tích +) Số e của ion âm = số e nguyên tử + số đơn vị điện tích Lời giải chi tiết :
Na có Z = 11 => số e = 11 => ion Na+ có số e = 11 – 1 = 10 Mg có Z = 12 => số e = 12 => ion Mg2+ có số e = 12 – 2 = 10 Al có Z = 13 => số e = 13 => ion Al3+ có số e = 13 – 3 = 10 Ca có Z = 20 => số e = 20 => ion Ca2+ có số e = 20 – 2 = 18 S có Z = 16 => số e = 16 => ion S2- có số e = 16 + 2 = 18 Cl có Z = 17 => số e = 17 => ion Cl- có số e = 17 + 1 = 18 O có Z = 8 => số e = 8 => ion O2- có số e = 8 + 2 = 10 Vậy có 4 ion có 10e
Câu 16 :
Nhận định nào sau đây chưa chính xác về hoá trị trong hợp chất cộng hoá trị:
Đáp án : B Lời giải chi tiết :
Nhận định chưa chính xác về hóa trị trong hợp chất cộng hóa trị là: Trong hợp chất cộng hoá trị, hoá trị của một nguyên tố có thể là số âm hoặc số dương. Vì hóa trị của các nguyên tố không mang dấu
Câu 17 :
Ion nào sau đây là ion đa nguyên tử
Đáp án : C Phương pháp giải :
Ion đa nguyên tử được tạo thành từ nhiều nguyên tử. Lời giải chi tiết :
- S2-: được tạo bởi nguyên tử S - Al3+: được tạo bởi nguyên tử Al - NH4+: được tạo bởi nguyên tử N và H - Ca2+: được tạo bởi nguyên tử Ca Vậy NH4+ là ion đa nguyên tử
Câu 18 :
Chất nào chỉ chứa liên kết đơn?
Đáp án : B Lời giải chi tiết :
A. \(N \equiv N\) C. O=C=O D. O=O
Câu 19 :
Hoá trị trong hợp chất ion được gọi là :
Đáp án : C Lời giải chi tiết :
Hóa trị trong hợp chất ion được gọi là điện hóa trị.
Câu 20 :
Kiểu liên kết tạo nên giữa hai nguyên tử bằng một hay nhiều cặp electron chung được gọi là
Đáp án : A Lời giải chi tiết :
Liên kết cộng hóa trị được hình thành giữa hai nguyên tử bằng một hay nhiều cặp electron dùng chung.
Câu 21 :
Trong phân tử sẽ có liên kết cộng hoá trị phân cực nếu cặp electron chung...
Đáp án : B Lời giải chi tiết :
Liên kết cộng hoá trị trong đó cặp e chung bị lệch về một phía của nguyên tử được gọi là liên kết cộng hóa trị phân cực
Câu 22 :
Cho các nguyên tố: X (Z= 11), Y (Z= 17). Liên kết hoá học giữa X và Y thuộc loại...
Đáp án : B Phương pháp giải :
Bước 1: Xác định tính kim loại, phi kim của X, Y Viết cấu hình đầy đủ của X, Y. Từ cấu hình xác định vị trí của X, Y trong bảng tuần hoàn. Bước 2: Xác định liên kết giữa X, Y - Liên kết giữa kim loại điển hình và phi kim điển hình là liên kết ion - Liên kết giữa 2 nguyên tử giống hệt nhau là liên kết cộng hóa trị không phân cực - Liên kết giữa hai nguyên tố phi kim khác nhau thường thuộc liên kết CHT có cực. Lời giải chi tiết :
Bước 1: Xác định tính kim loại, phi kim của X, Y 11X: 1s22s22p63s1 => X là kim loại điển hình (nhóm IA) 17Y: 1s22s22p63s23p5 => Y là phi kim điển hình (nhóm VIIA) Bước 2: Xác định liên kết giữa X, Y Như vậy liên kết giữa X và Y là liên kết ion
Câu 23 :
Nước đá khô thường được dùng để làm lạnh, giữ lạnh nhằm vận chuyển và bảo quản các sản phẩm dễ hư hỏng vì nhiệt độ. Nước đá khô được dùng nhiều trong các ngành công nghiệp thực phẩm, thủy hải sản và còn được dùng để bảo quản vắc xin, dược phẩm trong ngành Y tế – dược phẩm. Thành phàn nước đá khô là CO2, hãy chỉ ra nội dung sai.
Đáp án : D Lời giải chi tiết :
A, B, C đúng D sai vì CO2 là phân tử có cấu trúc thẳng Chú ý: Liên kết C=O là liên kết phân cực nhưng do phân tử CO2 có cấu trúc thẳng O=C=O nên phân tử CO2 không phân cực.
Câu 24 :
Liên kết hóa học trong phân tử Br2 thuộc loại liên kết
Đáp án : D Phương pháp giải :
Liên kết giữa 2 nguyên tử cùng loại là liên kết cộng hóa trị không cực. Lời giải chi tiết :
Liên kết giữa 2 nguyên tử cùng loại là liên kết cộng hóa trị không cực.
Câu 25 :
Chỉ ra nội dung sai khi nói về ion:
Đáp án : A Lời giải chi tiết :
A sai vì ion âm được gọi là anion còn ion dương được gọi là cation.
Câu 26 :
Ion nào là ion đơn nguyên tử?
Đáp án : C Phương pháp giải :
Ion đơn nguyên tử là ion được cấu tạo từ 1 nguyên tử. Lời giải chi tiết :
Cl- là ion đơn nguyên tử.
Câu 27 :
Cộng hoá trị của 1 nguyên tố là:
Đáp án : D Lời giải chi tiết :
Cộng hoá trị của 1 nguyên tố là số liên kết của nguyên tử nguyên tố đó trong phân tử.
Câu 28 :
Quá trình hình thành liên kết nào dưới đây được mô tả đúng?
Đáp án : D Lời giải chi tiết :
Câu 29 :
Trong số các chất sau: HF, CaO, CH4, N2, Số lượng các chất có liên kết cộng hóa trị và liên kết ion lần lượt là
Đáp án : B Lời giải chi tiết :
Chất có liên kết cộng hóa trị: HF, CH4, N2 Chất có liên kết ion: CaO
Câu 30 :
Công thức hóa học của hợp chất tạo bởi nhôm và nhóm nitrat (NO3-) là:
Đáp án : B Lời giải chi tiết :
Công thức của hợp chất tạo bởi nhôm và nhóm nitrat là Al(NO3)3 |














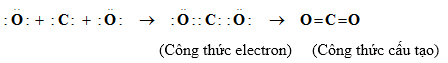






Danh sách bình luận