Đề thi học kì 2 Hóa 10 - Đề số 1Đề bài
Câu 1 :
Để điều chế khí HCl trong công nghiệp, người ta sử dụng phương pháp:
Câu 2 :
Thuốc thử đặc trưng để nhận biết hợp chất halogenua trong dung dịch là
Câu 3 :
Số oxi hoá của S trong các hợp chất sau: Cu2S, FeS, NaHSO4, (NH4)2S2O8, Na2SO3 lần lượt là:
Câu 4 :
Với các nguyên tố nhóm VIA, nhận xét nào sau đây sai ?
Câu 5 :
Thuốc thử nào sau đây dùng để phân biệt khí H2S với khí CO2 ?
Câu 6 :
Hấp thụ hoàn toàn 2,8 lít khí SO2 (đktc) vào dung dịch KMnO4 thu được dung dịch không màu có pH = 1,0. Thể tích dung dịch KMnO4 là
Câu 7 :
Cho hỗn hợp A gồm BaCl2 và BaCO3 tác dụng vừa đủ với m gam dung dịch H2SO4 4,9% thu được 58,25 gam kết tủa. Giá trị của m là
Câu 8 :
Các khí sinh ra trong thí nghiệm phản ứng của saccarozơ với dung dịch H2SO4 đặc bao gồm
Câu 9 :
Hòa tan hết 1,69 gam oleum có công thức H2SO4.3SO3 vào nước dư. Trung hòa dung dịch thu được cần V ml dung dịch KOH 1M . Giá trị của V là
Câu 10 :
Tốc độ phản ứng là
Câu 11 :
Một hỗn hợp gồm 3 muối NaF, NaCl, NaBr nặng 4,82 gam. Hoà tan hoàn toàn trong nước được dung dịch A. Sục khí clo dư vào dung dịch A rồi cô cạn hoàn toàn dung dịch sau phản ứng thu được 3,93 gam muối khan. Lấy 1/2 lượng muối khan này hoà tan vào nước rồi cho sản phẩm phản ứng với dung dịch AgNO3 dư thì thu được 4,305 gam kết tủa. Phần trăm khối lượng NaF ban đầu là
Câu 12 :
Axit pecloric có công thức là:
Câu 13 :
Trong phòng thí nghiệm, khi điều chế Cl2 từ MnO2 và HCl, để tránh khí Cl2 thoát ra phòng, ta đậy nắp ống nghiệm bằng bông có tẩm chất nào sau đây là hợp lý nhất:
Câu 14 :
Cho các phản ứng hóa học sau: (a) S + O2 $\xrightarrow{{{t^ \circ }}}$ SO2 (b) S + 3F2 $\xrightarrow{{{t^ \circ }}}$ SF6 (c) S + Hg $\xrightarrow{{}}$ HgS (d) S + 6HNO3 (đặc) $\xrightarrow{{{t^ \circ }}}$ H2SO4 + 6NO2 + 2H2O Số phản ứng trong đó S thể hiện tính khử là :
Câu 15 :
Chỉ từ các chất: Fe, S, dung dịch FeSO4 và dung dịch H2SO4 có thể có bao nhiêu phương pháp điều chế khí H2S bằng 2 phản ứng?
Câu 16 :
Đun nóng hỗn hợp gồm 8,4 gam bột sắt và 1,6 gam bột lưu huỳnh
Câu 17 :
Tính oxi hóa của lưu huỳnh thể hiện qua phản ứng nào sau đây
Câu 18 :
Một số cơ sở sản xuất thuốc bắc thường đốt một chất bột rắn màu vàng (là một đơn chất) để tạo ra khí X nhằm mục đích tẩy trắng, chống mốc. Tuy nhiên, theo các nghiên cứu khoa học thì khí X có ảnh hưởng không tốt đến cơ quan nội tạng và khí X cũng là một trong những nguyên nhân gây ra mưa axit. Khí X là
Câu 19 :
Cho a gam kim loại R phản ứng vừa đủ với 28,4 gam khí Clo thì thu được 43,52 gam muối clorua với hiệu suất 80%. Khối lượng a và tên của Kim loại R là:
Câu 20 :
Dãy các chất nào sau đây đều tác dụng với axit clohiđric ?
Câu 21 :
Cho 25 gam nước clo vào một dung dịch có chứa 2,163 gam NaBr thấy dung dịch chuyển sang màu vàng đậm và NaBr vẫn còn dư. Sau thí nghiệm, cô cạn dung dịch thu được 1,273 gam chất rắn khan. Biết hiệu suất phản ứng 100%, nồng độ % của nước clo là
Câu 22 :
Một chất dùng để làm sạch nước, dùng để chữa sâu răng và có tác dụng bảo vệ các sinh vật trên trái đất không bị bức xạ cực tím. Chất này là
Câu 23 :
Oxi hóa hoàn toàn m gam hỗn hợp X gồm Cu và Al có tỷ lệ mol 1:1 thu được 13,1 gam hỗn hợp Y gồm các oxit. Giá trị của m là
Câu 24 :
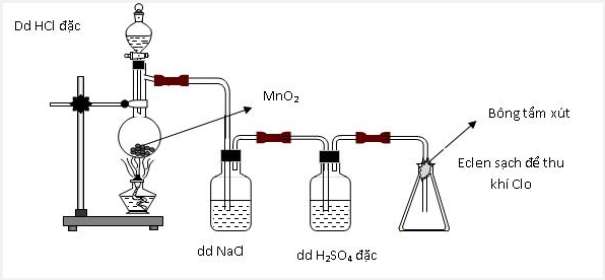
Thực hiện thí nghiệm điều chế clo theo sơ đồ sau: Cho các nhận định sau: (a) Bình chứa dung dịch NaCl dùng để giữ khí HCl. (b) Bình chứa dung dịch H2SO4 đặc để giữ hơi nước. (c) Bông tẩm dung dịch xút có thể thay bằng tẩm nước. (d) Có thể thay chất rắn trong bình cầu thành thuốc tím. Số nhận định chính xác là:
Câu 25 :
Hỗn hợp a gồm Cu và CuO Hòa tan hoàn toàn 20,8 gam hỗn hợp a vào 73,5 gam dung dịch H2SO4 80% chỉ thu được dung dịch x và khí SO2 là sản phẩm khử duy nhất cho x tác dụng hoàn toàn với 900 ml dung dịch NaOH 1M sau đó lọc bỏ kết tủa được dung dịch y cô cạn y thu được chất rắn z nặng 60,8 g nồng độ phần trăm của CuSO4 trong x.
Câu 26 :
Sự chuyển dịch cân bằng là:
Câu 27 :
Cho phản ứng: \({I_{\text{2}}}\left( {\text{k}} \right)\, + {{\text{H}}_{\text{2}}}\left( {\text{k}} \right)\overset {{t^o},xt,p} \leftrightarrows {\text{2 HI(k)}}\). Ở nhiệt độ 4300C, hằng số cân bằng KC của phản ứng trên bằng 53,96. Đun nóng một bình kín dung tích không đổi 10 lít chứa 4,0 gam H2 và 406,4 gam I2. Khi hệ phản ứng đạt trạng thái cân bằng ở 4300C, nồng đọ của HI là:
Câu 28 :
Nhận xét nào đúng khi so sánh tính phi kim của các nguyên tố halogen
Câu 29 :
Hấp thụ hoàn toàn 3,36 lít H2S vào 200ml dung dịch NaOH 1,5M, muối tạo thành sau phản ứng là
Câu 30 :
Cho các phát biểu sau về cân bằng hóa học: (1) Cân bằng hóa học là trạng thái của phản ứng thuận nghịch khi tốc độ phản ứng thuận bằng tốc độ phản ứng nghịch. (2) Ở trạng thái cân bằng hóa học, phản ứng dừng lại. (3) Trong hệ đạt trạng thái cân bằng hóa học, luôn có mặt của các chất sản phầm, các chất phản ứng có thể không có. (4) Ở trạng thái cân bằng hóa học, nồng độ các chất phản ứng giảm đi bao nhiêu theo phản ứng thuận lại được tạo ra bấy nhiêu theo phản ứng nghịch. (5) Trong tất cả các cân bằng hóa học trong pha khí, khi thay đổi áp suất của hệ, cân bằng bị chuyển dịch. Số phát biểu đúng là
Lời giải và đáp án
Câu 1 :
Để điều chế khí HCl trong công nghiệp, người ta sử dụng phương pháp:
Đáp án : B Lời giải chi tiết :
Điều chế khí HCl trong công nghiệp bằng phương pháp tổng hợp: H2 + Cl2 $\xrightarrow{{{t^o}}}$ 2HCl
Câu 2 :
Thuốc thử đặc trưng để nhận biết hợp chất halogenua trong dung dịch là
Đáp án : C Phương pháp giải :
Xem lại lí thuyết hợp chất không có oxi của halogen Lời giải chi tiết :
Thuốc thử đặc trưng để nhận biết hợp chất halogenua trong dung dịch là AgNO3. Vì AgNO3 tạo kết tủa với các halogen (trừ F)
Câu 3 :
Số oxi hoá của S trong các hợp chất sau: Cu2S, FeS, NaHSO4, (NH4)2S2O8, Na2SO3 lần lượt là:
Đáp án : A Phương pháp giải :
Bước 1: Đặt ẩn cho số oxi hóa các nguyên tố trong hợp chất Bước 2: Áp dụng các quy tắc xác định số oxi hóa các nguyên tố trong hợp chất. Lời giải chi tiết :
$\mathop {Cu}\limits^{ + 1} $$_2\mathop S\limits^{ - 2} ,{\text{ }}\mathop {Fe}\limits^{ + 2} \mathop S\limits^{ - 2} ,{\text{ }}\mathop {Na}\limits^{ + 1} \mathop H\limits^{ + 1} \mathop S\limits^{ + 6} $$\mathop O\limits^{ - 2} $$_4,{\text{ }}{\left( {\mathop N\limits^{ - 3} {{\mathop H\limits^{ + 1} }_4}} \right)_2}\mathop S\limits^{ + 7} $$_2\mathop O\limits^{ - 2}$$_8,{\text{ }}N{a_2}\mathop S\limits^{ + 4} {O_3}$
Câu 4 :
Với các nguyên tố nhóm VIA, nhận xét nào sau đây sai ?
Đáp án : D Lời giải chi tiết :
Nhận xét sai là: Tính axit tăng dần: H2SO4 < H2SeO4 <H2TeO4. Vì tính axit giảm dần: H2SO4 > H2SeO4 > H2TeO4.
Câu 5 :
Thuốc thử nào sau đây dùng để phân biệt khí H2S với khí CO2 ?
Đáp án : B Phương pháp giải :
Cần nắm được tính chất hóa học của H2S và của CO2 => so sánh sự khác biệt và tìm thuốc thử phù hợp Lời giải chi tiết :
Thuốc thử để phân biệt H2S với CO2 là dung dịch Pb(NO3)2. H2S tạo kết tủa đen còn CO2 không hiện tượng.
Câu 6 :
Hấp thụ hoàn toàn 2,8 lít khí SO2 (đktc) vào dung dịch KMnO4 thu được dung dịch không màu có pH = 1,0. Thể tích dung dịch KMnO4 là
Đáp án : C Phương pháp giải :
2KMnO4 + 5SO2 + 2H2O → 2H2SO4 + 2MnSO4 + K2SO4 => tính số mol H2SO4 => số mol H+ +) từ pH => tính nồng độ H+ => thể tích dung dịch Lời giải chi tiết :
2KMnO4 + 5SO2 + 2H2O → 2H2SO4 + 2MnSO4 + K2SO4 0,05 ← 0,125 → 0,05 pH = 1 => [H+] = 0,1M Mà ${n_{{H^ + }}} = 2.{n_{{H_2}S{O_4}}} = 0,1\,\,mol = > {\text{ }}{V_{dd}} = \frac{{{n_{{H^ + }}}}}{{{C_M}}} = \frac{{0,1}}{{0,1}} = 1$ lít
Câu 7 :
Cho hỗn hợp A gồm BaCl2 và BaCO3 tác dụng vừa đủ với m gam dung dịch H2SO4 4,9% thu được 58,25 gam kết tủa. Giá trị của m là
Đáp án : B Phương pháp giải :
+) ${n_{{H_2}S{O_4}}} = {n_{BaS{O_4}}}$ → ${m_{{H_2}S{O_4}}}$ +) $m = \frac{{{m_{{H_2}S{O_4}}}.100\% }}{{C\% }}$ Lời giải chi tiết :
PTHH BaCl2 + H2SO4 → BaSO4 ↓ + 2HCl (1) BaCO3 + H2SO4 → BaSO4 ↓ + CO2 + H2O (2) ${n_{BaS{O_4}}} = \frac{m}{M} = \frac{{58,25}}{{233}} = 0,25\,\,mol$ Từ (1) và (2) ta thấy: ${n_{{H_2}S{O_4}}} = {n_{BaS{O_4}}} = 0,25\,\,mol$ → ${m_{{H_2}S{O_4}}} = n.M = 0,25.98 = 24,5\,\,g$ $C\% = \frac{{{m_{ct}}}}{{{m_{{\text{dd}}}}}}.100\% $ → $m = \frac{{{m_{{H_2}S{O_4}}}.100\% }}{{C\% }} = \frac{{24,5.100\% }}{{4,9\% }} = 500\,\,g$
Câu 8 :
Các khí sinh ra trong thí nghiệm phản ứng của saccarozơ với dung dịch H2SO4 đặc bao gồm
Đáp án : D Lời giải chi tiết :
C12H22O11 $\xrightarrow{{{H_2}S{O_4}}}$ 12C + 11H2O C + H2SO4 → CO2 + SO2 + H2O
Câu 9 :
Hòa tan hết 1,69 gam oleum có công thức H2SO4.3SO3 vào nước dư. Trung hòa dung dịch thu được cần V ml dung dịch KOH 1M . Giá trị của V là
Đáp án : B Phương pháp giải :
+) Viết PTHH của oleum tan trong nước +) Từ phản ứng trung hòa => tính số mol H2SO4 sinh ra => số mol oleum => CTPT Lời giải chi tiết :
${n_{{H_2}S{O_4}.3S{O_3}}} = \frac{{1,69}}{{338}} = {5.10^{ - 3}}mol$ ${H_2}S{O_4}.3S{O_3} + 3{H_2}O\xrightarrow{{}}4{H_2}S{O_4}$ ${5.10^{ - 3}}\,\,\, \to \,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,0,02$ ${H_2}S{O_4} + 2KOH\xrightarrow{{}}{K_2}S{O_4}+2{H_2}O$ $0,02\,\,\, \to \,\,\,\,\,\,0,04$ $ \to {V_{KOH}} = \frac{{0,04}}{1} \cdot 1000 = 40\,ml$
Câu 10 :
Tốc độ phản ứng là
Đáp án : C Lời giải chi tiết :
Tốc độ phản ứng là độ biến thiên nồng độ của một trong các chất phản ứng hoặc sản phẩm phản ứng trong một đơn vị thời gian.
Câu 11 :
Một hỗn hợp gồm 3 muối NaF, NaCl, NaBr nặng 4,82 gam. Hoà tan hoàn toàn trong nước được dung dịch A. Sục khí clo dư vào dung dịch A rồi cô cạn hoàn toàn dung dịch sau phản ứng thu được 3,93 gam muối khan. Lấy 1/2 lượng muối khan này hoà tan vào nước rồi cho sản phẩm phản ứng với dung dịch AgNO3 dư thì thu được 4,305 gam kết tủa. Phần trăm khối lượng NaF ban đầu là
Đáp án : A Phương pháp giải :
Thay 1 mol NaBr bằng 1 mol NaCl ---------> khối lượng giảm 44,5 gam => số mol NaBr ban đầu và số mol NaCl sinh ra +) hh muối khan sau phản ứng gồm NaCl và NaF +) ∑nNaCl = nAgCl => tính số mol NaCl ban đầu +) mNaF = 4,82 – mNaBr – mNaCl Lời giải chi tiết :
Sục Cl2 vào dung dịch A thu được 3,93 gam muối Thay 1 mol NaBr bằng 1 mol NaCl ---------> khối lượng giảm 44,5 gam => ${{n}_{NaBr}}=\frac{{{m}_{giam}}}{{{M}_{Br}}-{{M}_{Cl}}}=\frac{0,89}{80-35,5}=0,02\text{ }mol$ => nNaBr ban đầu = 0,02 mol và nNaCl sinh ra = 0,02 mol Gọi hh muối khan sau phản ứng với Cl2 là hh B. B gồm NaCl và NaF Khi cho hh B vào AgNO3 thì AgF không kết tủa Xét trong 2 phần: ${{n}_{AgCl}}=2.\frac{4,305}{143,5}=0,06\,mol$ => ∑nNaCl = nAgCl = 0,06 mol => nNaCl ban đầu = 0,06 – 0,02 = 0,04 mol => mNaF = 4,82 – 0,02.103 – 0,04.58,5 = 0,42 gam => $\%{{m}_{NaF}}=\frac{0,42}{4,82}.100\%=8,71\%$
Câu 12 :
Axit pecloric có công thức là:
Đáp án : D Phương pháp giải :
Xem lại các hợp chất có oxi của Clo Lời giải chi tiết :
Axit pecloric có công thức là HClO4
Câu 13 :
Trong phòng thí nghiệm, khi điều chế Cl2 từ MnO2 và HCl, để tránh khí Cl2 thoát ra phòng, ta đậy nắp ống nghiệm bằng bông có tẩm chất nào sau đây là hợp lý nhất:
Đáp án : B Phương pháp giải :
+) Tính chất của Cl2 khi tan vào nước tạo ra axit => Cách loại bỏ.
Lời giải chi tiết :
Tính chất của Cl2 khi tan vào nước tạo ra axit: H2O+ Cl2 -> HCl + HClO => Dùng bazơ để loại bỏ => Dùng NaOH
Câu 14 :
Cho các phản ứng hóa học sau: (a) S + O2 $\xrightarrow{{{t^ \circ }}}$ SO2 (b) S + 3F2 $\xrightarrow{{{t^ \circ }}}$ SF6 (c) S + Hg $\xrightarrow{{}}$ HgS (d) S + 6HNO3 (đặc) $\xrightarrow{{{t^ \circ }}}$ H2SO4 + 6NO2 + 2H2O Số phản ứng trong đó S thể hiện tính khử là :
Đáp án : B Phương pháp giải :
+) Tính khử là khả năng nhường electron => Xác định số oxi hóa của S => Phản ứng Lời giải chi tiết :
\(\mathop S\limits^0 \;\; + \;\;{O_2}\;\;\;\xrightarrow{{{t^o}}}\;\;\mathop S\limits^{ + 4} {O_2}\) \(\mathop S\limits^0 \;\; + \;\;3{F_2}\;\;\;\xrightarrow{{{t^o}}}\;\;\mathop S\limits^{ + 6} {F_6}\) \(\mathop S\limits^0 \) + 6HNO3(đặc) \(\xrightarrow{{{t^o}}}\) \(\mathop{{H_2}S{O_4}}\limits^{ + 6} \) + 6NO2 + 2H2O
Câu 15 :
Chỉ từ các chất: Fe, S, dung dịch FeSO4 và dung dịch H2SO4 có thể có bao nhiêu phương pháp điều chế khí H2S bằng 2 phản ứng?
Đáp án : B Phương pháp giải :
+) Để tạo ra H2S ta có thể nghĩ đến Cách 1: Muối sufua axit Cách 2: Khí H2 + S
Lời giải chi tiết :
Cách 1: (1) Fe + S $\xrightarrow{{{t^o}}}$ FeS (2) FeS + H2SO4 $\xrightarrow{{}}$ FeSO4 + H2S↑ Cách 2: (1) Fe + H2SO4 $\xrightarrow{{}}$ FeSO4 + H2↑ (2) S + H2 $\xrightarrow{{{t^o}}}$ H2S↑
Câu 16 :
Đun nóng hỗn hợp gồm 8,4 gam bột sắt và 1,6 gam bột lưu huỳnh
Đáp án : B Phương pháp giải :
Fe + S → FeS +) hỗn hợp X gồm Fe (0,4 mol) và FeS (0,1 mol) Fe + 2HCl → FeCl2 + H2 FeS + 2HCl → FeCl2 + H2S => tính số mol mỗi khí theo Fe và FeS => % thể tích Lời giải chi tiết :
nFe = 0,15 mol; nS = 0,05 mol Fe + S → FeS 0,05 ← 0,05 → 0,05 => hỗn hợp X gồm Fe (0,1 mol) và FeS (0,05 mol) Fe + 2HCl → FeCl2 + H2 0,1 → 0,1 FeS + 2HCl → FeCl2 + H2S 0,05 → 0,05 => hỗn hợp X gồm H2 (0,1 mol) và H2S(0,05 mol) Thành phần % về thể tích cũng chính là % theo số mol $= > {\text{ }}\% {V_{{H_2}}} = \frac{{0,1}}{{0,15}}.100\% = 66,67\% ;\,\,\% {V_{{H_2}S}} = \frac{{0,05}}{{0,15}}.100\% = 33,33\% $
Câu 17 :
Tính oxi hóa của lưu huỳnh thể hiện qua phản ứng nào sau đây
Đáp án : D Lời giải chi tiết :
S thể hiện tính oxi hóa thông qua các phản ứng với kim loại và hiđro
Câu 18 :
Một số cơ sở sản xuất thuốc bắc thường đốt một chất bột rắn màu vàng (là một đơn chất) để tạo ra khí X nhằm mục đích tẩy trắng, chống mốc. Tuy nhiên, theo các nghiên cứu khoa học thì khí X có ảnh hưởng không tốt đến cơ quan nội tạng và khí X cũng là một trong những nguyên nhân gây ra mưa axit. Khí X là
Đáp án : C Phương pháp giải :
Xem lại các khí gây mưa axit Lời giải chi tiết :
Chất rắn vàng là S → X là SO2 do X có khả năng tẩy trắng chống mốc và là nguyên nhân gây mưa axit
Câu 19 :
Cho a gam kim loại R phản ứng vừa đủ với 28,4 gam khí Clo thì thu được 43,52 gam muối clorua với hiệu suất 80%. Khối lượng a và tên của Kim loại R là:
Đáp án : A Lời giải chi tiết :
nCl2 bđ = 28,4/71 = 0,4 mol => n Cl2 thực tế phản ứng = 0,4.80% = 0,32 mol Giả sử kim loại có hóa trị là n. 2R + nCl2 → 2RCln 0,32 → 0,64/n => m muối = 0,64/n.(R + 35,5n) = 43,52 => 0,64R = 20,8n => R = 32,5n + n = 1 => R = 32,5 (loại) + n = 2 => R = 65 (Zn) => m Zn bđ = nCl2 bđ = 0,4 mol => a = 0,4.65 = 26 gam
Câu 20 :
Dãy các chất nào sau đây đều tác dụng với axit clohiđric ?
Đáp án : B Lời giải chi tiết :
Dãy các chất nào sau đây đều tác dụng với axit clohiđric là: Fe2O3, KMnO4, Fe, CuO, AgNO3
Câu 21 :
Cho 25 gam nước clo vào một dung dịch có chứa 2,163 gam NaBr thấy dung dịch chuyển sang màu vàng đậm và NaBr vẫn còn dư. Sau thí nghiệm, cô cạn dung dịch thu được 1,273 gam chất rắn khan. Biết hiệu suất phản ứng 100%, nồng độ % của nước clo là
Đáp án : B Phương pháp giải :
Muối khan thu được gồm NaCl và NaBr còn dư nNaBr dư = 0,021 – 2x => mmuối = mNaBr dư + mNaCl = 1,609 Lời giải chi tiết :
Gọi nCl2 = x mol Cl2 + 2NaBr → 2NaCl + Br2 x → 2x → 2x Muối khan thu được gồm NaCl và NaBr còn dư nNaBr dư = 0,021 – 2x => mmuối = mNaBr dư + mNaCl = 103.(0,021 – 2x) + 2x. 58,5 = 1,273=> x = 0,01 \( \Rightarrow C\% {m_{C{l_2}}} = \frac{{0,01.71}}{{25}}.100\% = 2,84\% \)
Câu 22 :
Một chất dùng để làm sạch nước, dùng để chữa sâu răng và có tác dụng bảo vệ các sinh vật trên trái đất không bị bức xạ cực tím. Chất này là
Đáp án : A Phương pháp giải :
Xem lại ứng dụng của ozon Lời giải chi tiết :
- Không khí chứa một lượng rất nhỏ ozon có tác dụng làm cho không khí trong lành. Với lượng ozon lớn hơn sẽ gây độc hại với con người. - Trong thương mại, người ta dùng ozon để tẩy trắng các loại tinh bột, dầu ăn và nhiều chất khác. - Trong đời sống, người ta dùng ozon để khử trùng nước ăn, khử mùi, bảo quản hoa quả. Trong y khoa, ozon được dùng chữa sâu răng.
Câu 23 :
Oxi hóa hoàn toàn m gam hỗn hợp X gồm Cu và Al có tỷ lệ mol 1:1 thu được 13,1 gam hỗn hợp Y gồm các oxit. Giá trị của m là
Đáp án : C Phương pháp giải :
Áp dụng định luật bảo toàn e và bảo toàn khối lượng Lời giải chi tiết :
Gọi nCu = nAl = a (mol) \(BTe:4.\,{n_{{O_2}}} = 2{n_{Cu}} + 3{n_{Al}} = > {n_{{O_2}}} = \dfrac{{2a + 3a}}{4}(mol)\) BTKL: mKL + mO2 = mY <=> 64a+ 27a + 8. 5a = 13,1 <=> 131a = 13,1 <=> a = 0,1 mol m= mCu + mAl = 64a + 27a = 9,1 gam
Câu 24 :
Thực hiện thí nghiệm điều chế clo theo sơ đồ sau: Cho các nhận định sau: (a) Bình chứa dung dịch NaCl dùng để giữ khí HCl. (b) Bình chứa dung dịch H2SO4 đặc để giữ hơi nước. (c) Bông tẩm dung dịch xút có thể thay bằng tẩm nước. (d) Có thể thay chất rắn trong bình cầu thành thuốc tím. Số nhận định chính xác là:
Đáp án : C Lời giải chi tiết :
(a) Bình chứa dung dịch NaCl dùng để giữ khí HCl. => đúng (b) Bình chứa dung dịch H2SO4 đặc để giữ hơi nước. => đúng (c) Bông tẩm dung dịch xút có thể thay bằng tẩm nước. => sai vì nước không giữ được khí clo vì nước phản ứng rất yếu với clo (d) Có thể thay chất rắn trong bình cầu thành thuốc tím. => đúng vì thuốc tím cũng là một chất oxi hóa mạnh tương tự như MnO2 Vậy có 3 phát biểu đúng.
Câu 25 :
Hỗn hợp a gồm Cu và CuO Hòa tan hoàn toàn 20,8 gam hỗn hợp a vào 73,5 gam dung dịch H2SO4 80% chỉ thu được dung dịch x và khí SO2 là sản phẩm khử duy nhất cho x tác dụng hoàn toàn với 900 ml dung dịch NaOH 1M sau đó lọc bỏ kết tủa được dung dịch y cô cạn y thu được chất rắn z nặng 60,8 g nồng độ phần trăm của CuSO4 trong x.
Đáp án : B Phương pháp giải :
Sử dụng bảo toàn e và bảo toàn nguyên tố. Lời giải chi tiết :
Tóm tắt bài toán: \(20,8\,(g)\,A\left\{ \begin{array}{l}Cu\\CuO\end{array} \right. + 73,5\,g\,dd\,\underbrace {{H_2}S{O_4}}_{0,6\,(mol)} \to \left\langle \begin{array}{l}S{O_2}:\\\left. {X\left\{ \begin{array}{l}CuS{O_4}:\\{H_2}S{O_4}\,du\end{array} \right.} \right\} + \underbrace {NaOH}_{0,9\,(mol)} \to \left\{ \begin{array}{l} \downarrow Cu{(OH)_2}\\60,8\,(g)\,Z\left\{ \begin{array}{l}N{a_2}S{O_4}:a\,(mol)\\NaOH\,du:\,b(mol)\end{array} \right.\end{array} \right.\end{array} \right.\) Đặt trong Z số mol Na2SO4 và NaOH dư lần lượt là a và b (mol) Ta có hệ phương trình: \(\left\{ \begin{array}{l}{m_{N{a_2}S{O_4}}} + {m_{NaOH\,du}} = {m_Z}\\BT:Na = > 2{n_{N{a_2}S{O_4}}} + {n_{NaOHdu}} = {n_{NaOH\,bd}}\end{array} \right. \Rightarrow \left\{ \begin{array}{l}142a + 40b = 60,8\\2a + b = 0,9\end{array} \right. \Rightarrow \left\{ \begin{array}{l}a = 0,4\\b = 0,1\end{array} \right.\) BTNT “S”: nH2SO4 bđ = nSO2 + nNa2SO4 ⟹ 0,6 = nSO2 + 0,4 ⟹ nSO2 = 0,6 – 0,4 = 0,2 (mol) BT e ta có: nCu = nSO2 = 0,2 (mol) (Do Cu từ số oxh 0 lên +2, còn S từ số oxi hóa +6 xuống +4) ⟹ mCu = 0,2.64 = 12,8 (g) ⟹ mCuO = mA – mCu = 20,8 – 12,8 = 8 (g) ⟹ nCuO = mCuO : MCuO = 8 : 80 = 0,1 (mol) BTNT “Cu”: nCuSO4 = nCu + nCuO = 0,2 + 0,1 = 0,3 (mol) ⟹ mCuSO4 = nCuSO4×MCuSO4 = 0,3×160 = 48 (g) Ta có: mA + mdd H2SO4 = mdd X + mSO2 ⟹ mdd X = mA + mdd H2SO4 - mSO2 = 20,8 + 73,5 – 0,2.64 = 81,5 (g) Phần trăm khối lượng CuSO4 có trong dd X là: \(C\% = \frac{{{m_{CuS{O_4}}}}}{{{m_{dd\,X}}}}.100\% = \frac{{48}}{{81,5}}.100\% = 58,90\% \)
Câu 26 :
Sự chuyển dịch cân bằng là:
Đáp án : C Lời giải chi tiết :
Sự chuyển dịch cân bằng là: chuyển từ trạng thái cân bằng này sang trạng thái cân bằng khác.
Câu 27 :
Cho phản ứng: \({I_{\text{2}}}\left( {\text{k}} \right)\, + {{\text{H}}_{\text{2}}}\left( {\text{k}} \right)\overset {{t^o},xt,p} \leftrightarrows {\text{2 HI(k)}}\). Ở nhiệt độ 4300C, hằng số cân bằng KC của phản ứng trên bằng 53,96. Đun nóng một bình kín dung tích không đổi 10 lít chứa 4,0 gam H2 và 406,4 gam I2. Khi hệ phản ứng đạt trạng thái cân bằng ở 4300C, nồng đọ của HI là:
Đáp án : A Phương pháp giải :
\({{\rm{K}}_{\rm{C}}}{\rm{ = }}\frac{{{{{\rm{[HI]}}}^2}}}{{{\rm{[}}{{\rm{H}}_{\rm{2}}}{\rm{] \times [}}{{\rm{I}}_{\rm{2}}}{\rm{]}}}}\) Lời giải chi tiết :
n H2 = 4 : 2 = 2 mol => [H2] = 2 : 10 = 0,2 M n I2 = 1,6 mol => [I2 ] = 1,6 : 10 = 0,16 M H2 + I2 → 2 HI Ban đầu 0,2 0,16 Phản ứng x x 2x Kết thúc 0,2 – x 0,16 – x 2x \({{\text{K}}_{\text{C}}}{\text{ = }}\frac{{{{{\text{[HI]}}}^2}}}{{{\text{[}}{{\text{H}}_{\text{2}}}{\text{]}}{\text{.[}}{{\text{I}}_{\text{2}}}{\text{]}}}} \to {\text{53,69 = }}\frac{{{{{\text{[2x]}}}^2}}}{{{\text{[0,2 - x]}}{\text{.[0,16 - x]}}}}\) => x = 0,2515 ( loại vì lớn hơn cả 0,16 ) hoặc x = 0,1375 (chọn) => [HI] = 0,1375 . 2 = 0,275 M
Câu 28 :
Nhận xét nào đúng khi so sánh tính phi kim của các nguyên tố halogen
Đáp án : C Phương pháp giải :
Trong nhóm VIIA đi từ trên xuống dưới tính phi kim giảm dần. Lời giải chi tiết :
Tính phi kim: F>Cl>Br>I
Câu 29 :
Hấp thụ hoàn toàn 3,36 lít H2S vào 200ml dung dịch NaOH 1,5M, muối tạo thành sau phản ứng là
Đáp án : D Phương pháp giải :
- Lập tỉ lệ \(T = \frac{{{n_{NaOH}}}}{{{n_{{H_2}S}}}}\)để xác định loại muối tạo thành Lời giải chi tiết :
\(\begin{array}{l}{n_{{H_2}S}} = \frac{{3,36}}{{22,4}} = 0,15\,(mol)\\{n_{NaOH}} = {V_{NaOH \times }}{C_M} = 0,2 \times 1,5 = 0,3\,(mol)\end{array}\) Xét tỉ lệ ta thấy: \(T = \frac{{{n_{NaOH}}}}{{{n_{{H_2}S}}}} = \frac{{0,3}}{{0,15}} = 2\), phản ứng tạo thành hai muối Na2S
Câu 30 :
Cho các phát biểu sau về cân bằng hóa học: (1) Cân bằng hóa học là trạng thái của phản ứng thuận nghịch khi tốc độ phản ứng thuận bằng tốc độ phản ứng nghịch. (2) Ở trạng thái cân bằng hóa học, phản ứng dừng lại. (3) Trong hệ đạt trạng thái cân bằng hóa học, luôn có mặt của các chất sản phầm, các chất phản ứng có thể không có. (4) Ở trạng thái cân bằng hóa học, nồng độ các chất phản ứng giảm đi bao nhiêu theo phản ứng thuận lại được tạo ra bấy nhiêu theo phản ứng nghịch. (5) Trong tất cả các cân bằng hóa học trong pha khí, khi thay đổi áp suất của hệ, cân bằng bị chuyển dịch. Số phát biểu đúng là
Đáp án : B Phương pháp giải :
Dựa vào lý thuyết cân bằng hóa học. Lời giải chi tiết :
- (1) đúng, đây là định nghĩa cân bằng hóa học. - (2) sai, ở trạng thái cân bằng hóa học, phản ứng thuận và phản ứng nghịch vẫn xảy ra nhưng với tốc độ bằng nhau (vt = vn). - (3) sai, trong hệ đạt trạng thái cân bằng hóa học, luôn có mặt của các chất sản phẩm và cả các chất phản ứng. - (4) đúng, do ở trạng thái cân bằng hóa học, tốc độ phản ứng thuận bằng tốc độ phản ứng nghịch. - (5) sai, đối với những cân bằng hóa học trong pha khí mà số mol khí ở vế trái bằng số mol khí ở vế phải sẽ không chịu ảnh hưởng của áp suất ⟹ Khi thay đổi áp suất của hệ thì cân bằng không bị chuyển dịch. Vậy có 2 nhận định đúng là (1) và (4). |




















Danh sách bình luận