Trắc nghiệm Bài 9: Base Khoa học tự nhiên 8 Cánh diều có đáp ánĐề bài
Câu 1 :
Tên gọi của NaOH là:
Câu 2 :
Có thể nhận biết các dung dịch: NaOH, HCl, H2O đây bằng cách nào?
Câu 3 :
Phản ứng nào sau đây đúng?
Câu 4 :
Tính thể tích của dung dịch H2SO4 0,4M cần dùng để phản ứng hết với 100ml dung dịch NaOH 0,2 M?
Câu 5 :
Trong sản xuất nhôm có giai đoạn nhiệt phân Al(OH)3 để thu được Al2O3. Phản ứng nhiệt phân xảy ra như sau: 2\(Al{(OH)_3} \to A{l_2}{O_3} + 3{H_2}O\) Để thu được 1 tấn Al2O3 thì cần bao nhiêu tấn Al(OH)3, biết hiệu suất phản ứng đạt 90% (các giá trị được làm tròn đến hàng trăm)
Câu 6 :
Nhỏ từ từ dung dịch HCl 1M vào 100g dung dịch kiềm M(OH)n có nồng độ 1,71%. Để M(OH)n phản ứng hết thì cần dùng 20ml dung dịch HCl. Xác định kim loại trong hydroxide biết rằng hóa trị của kim loại có thể là I, II hoặc III
Câu 7 :
Để điều chế dung dịch nước vôi trong người ta cho calcium oxide tác dụng với nước. Phản ứng xảy ra như sau: CaO + H2O 🡪 Ca(OH)2 Cho 0,28g CaO tác dụng hoàn toàn với 100g nước. Nồng độ C% của dung dịch Ca(OH)2 thu được:
Câu 8 :
Có thể dùng chất nào sau đây để khử độ chua của đất?
Câu 9 :
Nhỏ dung dịch phenolphtalein vào hai dung dịch không màu X và Y thấy dung dịch X không thay đổi màu còn dung dịch Y chuyển sang màu hồng. Kết luận nào sau đây về dung dịch X và Y là đúng?
Câu 10 :
Dung dịch NaOH có thể tác dụng với dung dịch nào sau đây
Câu 11 :
Dãy chất nào sau đây chỉ gồm các base tan?
Câu 12 :
Cặp chất không thể tồn tại trong một dung dịch (tác dụng được với nhau) là:
Câu 13 :
Phương trình nào sau đây là sai?
Câu 14 :
Cặp chất đều làm đục nước vôi trong Ca(OH)2
Câu 15 :
Cặp chất khi phản ứng với nhau tạo thành chất kết tủa trắng:
Câu 16 :
Hòa tan 30 g NaOH vào 170 g nước thì thu được dung dịch NaOH có nồng độ là:
Câu 17 :
Hòa tan 80 g NaOH vào nước thu được dung dịch có nồng độ 1M. Thể tích dung dịch NaOH là:
Câu 18 :
Cho 200ml dung dịch NaOH 3M tác dụng với 100ml dung dịch FeCl3 1M thu được a gam kết tủa. Giá trị của a là :
Câu 19 :
Trộn 200ml dung dịch NaOH 1M với 300ml dung dịch NaOH 0,5M thì thu được dung dịch mới có nồng độ mol là?
Câu 20 :
Để trung hòa V ml dung dịch NaOH nồng độ 1,0M cần 200 ml dung dịch H2SO4 nồng độ 1,5M. Giá trị của V là
Câu 21 :
Trung hòa 200 gam dung dịch NaOH 10% bằng dung dịch HCl 3,65%. Khối lượng dung dịch HCl cần dùng là
Lời giải và đáp án
Câu 1 :
Tên gọi của NaOH là:
Đáp án : C Phương pháp giải :
Dựa vào danh pháp quốc tế IUPAC Lời giải chi tiết :
Đáp án C
Câu 2 :
Có thể nhận biết các dung dịch: NaOH, HCl, H2O đây bằng cách nào?
Đáp án : A Phương pháp giải :
Các dung dịch đã cho có pH khác nhau nên có thể dùng chất chỉ thị để phân biệt Lời giải chi tiết :
Đáp án A
Câu 3 :
Phản ứng nào sau đây đúng?
Đáp án : B Phương pháp giải :
Dựa vào các hệ số cân bằng và hóa trị của nguyên tố trong các phản ứng Lời giải chi tiết :
Đáp án B
Câu 4 :
Tính thể tích của dung dịch H2SO4 0,4M cần dùng để phản ứng hết với 100ml dung dịch NaOH 0,2 M?
Đáp án : A Phương pháp giải :
Dựa vào tính chất hóa học của base. Lời giải chi tiết :
Số mol của NaOH là: nNaOH = 0,2 x 0,1 = 0,02 (mol). Phương trình hóa học: 2NaOH + H2SO4 🡪 Na2SO4 + 2H2O 0,02 --> 0,01 CM = n : V => V = n : CM = 0,01 : 0,4 = 0,025 lít Từ đó, tính được thể tích dung dịch H2SO4 0,4 M cần dùng là 25ml
Câu 5 :
Trong sản xuất nhôm có giai đoạn nhiệt phân Al(OH)3 để thu được Al2O3. Phản ứng nhiệt phân xảy ra như sau: 2\(Al{(OH)_3} \to A{l_2}{O_3} + 3{H_2}O\) Để thu được 1 tấn Al2O3 thì cần bao nhiêu tấn Al(OH)3, biết hiệu suất phản ứng đạt 90% (các giá trị được làm tròn đến hàng trăm)
Đáp án : A Phương pháp giải :
Tính số mol của Al2O3, dựa vào hiệu suất của phản ứng Lời giải chi tiết :
\({n_{A{l_2}{O_3}}} = \frac{{{{10}^6}}}{{102}}mol\) Theo PTHH: 2Al(OH)3 🡪 Al2O3 + 3H2O Số mol: \(\frac{{{{10}^6}}}{{51}}\) \( \leftarrow \frac{{{{10}^6}}}{{102}}\) Vì hiệu suất phản ứng đạt 90% nên mAl(OH)3 = \(\frac{{{{10}^6}}}{{51}}x102:90\% = 1700400(g) \approx 1,7\tan \)
Câu 6 :
Nhỏ từ từ dung dịch HCl 1M vào 100g dung dịch kiềm M(OH)n có nồng độ 1,71%. Để M(OH)n phản ứng hết thì cần dùng 20ml dung dịch HCl. Xác định kim loại trong hydroxide biết rằng hóa trị của kim loại có thể là I, II hoặc III
Đáp án : A Phương pháp giải :
Dựa vào số mol của dung dịch HCl Lời giải chi tiết :
\({n_{HCl}} = {C_M}.{V_{HCl}} = 0,02x1 = 0,02mol\) HCl + M(OH)n 🡪 MCln + nH2O 0,02 🡪 \(\frac{{0,02}}{n}\) Khối lượng của M(OH)n đã phản ứng: \({m_{Mg(OH)2}} = {m_{{\rm{dd}}}}.\frac{{C\% }}{{100}} = 100.\frac{{1,71}}{{100}} = 1,71g\) Ta có: \(\begin{array}{l}\frac{{0,02}}{n}.({M_M} + 17n) = 1,71\\ \to 0,02{M_M} = 1,37n\end{array}\) Vì M có hóa trị I, II hoặc III. Thay n = 1, 2, 3 vào phương trình ta được: n = 2 và M = 137 (Ba)
Câu 7 :
Để điều chế dung dịch nước vôi trong người ta cho calcium oxide tác dụng với nước. Phản ứng xảy ra như sau: CaO + H2O 🡪 Ca(OH)2 Cho 0,28g CaO tác dụng hoàn toàn với 100g nước. Nồng độ C% của dung dịch Ca(OH)2 thu được:
Đáp án : D Phương pháp giải :
Dựa vào công thức tính C% Lời giải chi tiết :
nCaO = 0,005 mol n CaO = n Ca(OH)2 = 0,005 mol m Ca(OH)2 = 0,005 . 74 = 0,37g m dung dịch = 100 + 0,28 = 100,28g \(C\% = \frac{{0,37}}{{100,28}}.100 = 0,369\% \)
Câu 8 :
Có thể dùng chất nào sau đây để khử độ chua của đất?
Đáp án : A Phương pháp giải :
Để khử độ chua của đất ta dùng các dung dịch có tính base Lời giải chi tiết :
Đáp án A
Câu 9 :
Nhỏ dung dịch phenolphtalein vào hai dung dịch không màu X và Y thấy dung dịch X không thay đổi màu còn dung dịch Y chuyển sang màu hồng. Kết luận nào sau đây về dung dịch X và Y là đúng?
Đáp án : D Phương pháp giải :
Dựa vào tính chất hóa học của base. Lời giải chi tiết :
Base làm dung dịch phenolphtalein chuyển sang màu hồng
Câu 10 :
Dung dịch NaOH có thể tác dụng với dung dịch nào sau đây
Đáp án : C Phương pháp giải :
Dựa vào tính chất hóa học của dung dịch base Lời giải chi tiết :
Đáp án: C
Câu 11 :
Dãy chất nào sau đây chỉ gồm các base tan?
Đáp án : A Phương pháp giải :
Dựa vào độ tan của các chất base. Lời giải chi tiết :
Mg(OH)2 và Cu(OH)2 là hai base không tan. Đáp án: A
Câu 12 :
Cặp chất không thể tồn tại trong một dung dịch (tác dụng được với nhau) là:
Đáp án : A Phương pháp giải :
Cặp chất có tác dụng với nhau sinh ra chất mới thì không thể cùng tồn tại được với nhau trong một dung dịch. Lời giải chi tiết :
Cặp chất không thể tồn tại trong một dung dịch (tác dụng được với nhau) là: Ca(OH)2, Na2CO3 vì xảy ra phản ứng: Ca(OH)2 + Na2CO3 → CaCO3 ↓ + 2NaOH
Câu 13 :
Phương trình nào sau đây là sai?
Đáp án : A Phương pháp giải :
Dựa vào tính chất hóa học của bazơ tan và không tan. Lời giải chi tiết :
A. Sai, sửa: 2Fe(OH)3 \(\xrightarrow{{{t^0}}}\) Fe2O3 + 3H2O B,C,D đúng
Câu 14 :
Cặp chất đều làm đục nước vôi trong Ca(OH)2
Đáp án : B Phương pháp giải :
Dựa vào tính chất hóa học của dd Ca(OH)2 Lời giải chi tiết :
CO2 và SO2 làm đục dung dịch Ca(OH)2 do sinh ra CaCO3, CaSO3 kết tủa. PTHH: Ca(OH)2 + CO2 → CaCO3↓ + H2O Ca(OH)2 + SO2 → CaSO3↓ + H2O
Câu 15 :
Cặp chất khi phản ứng với nhau tạo thành chất kết tủa trắng:
Đáp án : A Phương pháp giải :
Chọn cặp chất có tác dụng với nhau sinh ra sản phẩm muối kết tủa trắng. Lời giải chi tiết :
A. Thỏa mãn vì phản ứng được với nhau sinh ra kết tủa trắng. PTHH: Ca(OH)2 + Na2SO3 → CaSO3↓ + 2NaOH B,C,D loại vì không xảy ra phản ứng
Câu 16 :
Hòa tan 30 g NaOH vào 170 g nước thì thu được dung dịch NaOH có nồng độ là:
Đáp án : C Phương pháp giải :
Ghi nhớ công thức tính nồng độ phần trăm: \(C\% = \frac{{mc\tan }}{{m\,dd}}.100\% \) Lời giải chi tiết :
mdd = m nước + mNaOH = 170 + 30 = 200g
Câu 17 :
Hòa tan 80 g NaOH vào nước thu được dung dịch có nồng độ 1M. Thể tích dung dịch NaOH là:
Đáp án : B Phương pháp giải :
Ghi nhớ công thức tính nồng độ mol:\({C_M} = \frac{{{n_{NaOH}}}}{V} \to V = ?\) Lời giải chi tiết :
nNaOH = mNaOH : MNaOH = 80 : (23 + 16 + 1) = 2 mol VNaOH = nNaOH : CM NaOH = 2 : 1 = 2 lít
Câu 18 :
Cho 200ml dung dịch NaOH 3M tác dụng với 100ml dung dịch FeCl3 1M thu được a gam kết tủa. Giá trị của a là :
Đáp án : C Phương pháp giải :
Đổi số mol NaOH; FeCl3 Viết PTHH xảy ra: 3NaOH + FeCl3 → 3NaCl + Fe(OH)3 Dựa vào PTHH so sánh NaOH và FeCl3 chất nào phản ứng hết, chất nào dư. Mọi tính toán theo số mol của chất phản ứng hết. Lời giải chi tiết :
Số mol của NaOH là 0,2.3=0,6 mol số mol của FeCl3 là 0,1.1=0,1mol Ta có PTHH : 3NaOH + FeCl3 → 3NaCl + Fe(OH)3 Trước PƯ 0,6 mol 0,1 mol PƯ 0,3 mol 0,1 mol Sau PƯ 0,3 mol 0 0,1 mol Kết tủa là 0,1 mol Fe(OH)3 => a= 0,1.107=10,7(g)
Câu 19 :
Trộn 200ml dung dịch NaOH 1M với 300ml dung dịch NaOH 0,5M thì thu được dung dịch mới có nồng độ mol là?
Đáp án : D Phương pháp giải :
Công thức nồng độ mol: CM NaOH = nNaOH : VNaOH Lời giải chi tiết :
Tống số mol NaOH có trong cả 2 dung dịch là nNaOH = 0,2.1+ 0,3.0,5= 0,35 mol Nồng độ mol của dung dịch thu được là \({C_M}NaOH = \frac{{0,35}}{{0,5}} = 0,7\,(M)\)
Câu 20 :
Để trung hòa V ml dung dịch NaOH nồng độ 1,0M cần 200 ml dung dịch H2SO4 nồng độ 1,5M. Giá trị của V là
Đáp án : A Phương pháp giải :
Bước 1: Đổi số mol H2SO4 theo công thức: nH2SO4 = VH2SO4 × CM H2SO4 Bước 2: Viết PTHH xảy ra, tính số mol NaOH theo số mol H2SO4 Bước 3: Tính VNaOH = nNaOH : CM NaOH = ? Lời giải chi tiết :
200 ml = 0,2 (lít) ⟹ nH2SO4 = VH2SO4 × CM H2SO4 = 0,2 × 1,5 = 0,3 (mol) PTHH: 2NaOH + H2SO4 → Na2SO4 + 2H2O Theo PTHH: nNaOH = 2nH2SO4 = 2.0,3 = 0,6 (mol) ⟹ VNaOH = nNaOH : CM NaOH = 0,6 : 1,0 = 0,6 (lít) = 600 (ml) ⟹ V = 600 ml
Câu 21 :
Trung hòa 200 gam dung dịch NaOH 10% bằng dung dịch HCl 3,65%. Khối lượng dung dịch HCl cần dùng là
Đáp án : D Phương pháp giải :
NaOH + HCl → NaCl + H2O 0,5 → 0,5 mol +) tính mHCl $ = > {m_{dd\,\,HCl}}$ Lời giải chi tiết :
${m_{NaOH}} = \frac{{200.10\% }}{{100\% }} = 20\,\,gam\,\, = > \,\,{n_{NaOH}} = 0,5\,\,mol$ NaOH + HCl → NaCl + H2O 0,5 → 0,5 mol => mHCl = 0,5.36,5 = 18,25 gam $ = > {m_{dd\,\,HCl}} = \frac{{18,25.100\% }}{{3,65\% }} = 500\,\,gam$
|














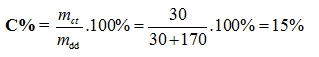





Danh sách bình luận