Trắc nghiệm Tổng hợp bài tập nhôm và hợp chất của nhôm tác dụng với dung dịch kiềm - Hóa 12Đề bài
Câu 1 :
Trộn dung dịch chứa a mol AlCl3 với dung dịch chứa b mol NaOH. Để thu được kết tủa thì cần có tỉ lệ
Câu 2 :
Dùng 200 ml dung dịch NaOH 1M để hòa tan hết tối đa m gam Al2O3. Giá trị của m là
Câu 3 :
Cho 500 ml dung dịch NaOH 1M vào 150 ml dung dịch AlCl3 1M. Sau khi phản ứng xảy ra hoàn toàn thu được m gam kết tủa. Giá trị của m là
Câu 4 :
Cho 200 ml dung dịch AlCl3 1,5M tác dụng với V lít dung dịch NaOH 0,5M, lượng kết tủa thu được là 15,6 gam. Giá trị lớn nhất của V là
Câu 5 :
Hòa tan 8,6 gam hỗn hợp kim loại K và Al vào nước, sau phản ứng xảy ra hoàn toàn, thu được 4,48 lít khí (đktc) và m gam chất không tan. Giá trị của m là
Câu 6 :
Cho m gam hỗn hợp gồm Al và Na vào nước dư, sau khi các phản ứng xảy ra hoàn toàn, thu được 2,24 lít khí H2 (đktc) và 2,35 gam chất rắn không tan. Giá trị của m là :
Câu 7 :
X gồm Ba và Al. Cho m gam X vào nước dư, sau khi các phản ứng xảy ra hoàn toàn, thu được 8,96 lít khí H2 (đktc). Mặt khác, hòa tan hoàn toàn m gam X bằng dung dịch NaOH, thu được 15,68 lít khí H2 (đktc). Giá trị của m là
Câu 8 :
Một hỗn hợp X gồm Na, Al và Fe (với tỉ lệ mol Na và Al tương ứng là 5 : 4) tác dụng với H2O dư thì thu được V lít khí, dung dịch Y và chất rắn Z. Cho Z tác dụng với dung dịch H2SO4 loãng dư thì thu được 0,25V lít khí (các khí đo ở cùng điều kiện). Thành phần % theo khối lượng của Fe trong hỗn hợp X là
Câu 9 :
Cho V lít dung dịch NaOH 1M vào dung dịch chứa 0,14 mol AlCl3, thu được m gam kết tủa. Mặt khác, cho 1,5V lít dung dịch NaOH 1M vào dung dịch chứa 0,14 mol AlCl3, thu được 0,75m gam kết tủa. Giá trị của V là
Câu 10 :
Tiến hành 2 thí nghiệm: Thí nghiệm 1: cho 100 ml dung dịch AlCl3 x (mol/l) tác dụng với 600 ml dung dịch NaOH 1M thu được 2y mol kết tủa. Thí nghiệm 2: Cho 100 ml dd AlCl3 x (mol/l) tác dụng với 660 ml dd NaOH 1M thu được y mol kết tủa. Giá trị của x là:
Câu 11 :
Cho 5,6 gam hỗn hợp NaOH và KOH (có thành phần thay đổi) hòa tan vào nước được dung dịch Z. Cho dung dịch Z phản ứng với dung dịch chứa 0,04 mol AlCl3, khối lượng kết tủa thu được lớn nhất và nhỏ nhất là:
Câu 12 :
Hoà tan hoàn toàn 0,15mol phèn chua KAl(SO4)2.12H2O vào nước, thu được dung dịch X. Cho toàn bộ X tác dụng với 200 ml dung dịch (Ba(OH)2 1M + NaOH 0,75M), sau phản ứng hoàn toàn thu được m gam kết tủa. Giá trị của m là
Câu 13 :
X là dung dịch Al2(SO4)3, Y là dung dịch Ba(OH)2. Trộn 200 ml dd X với 300 ml dung dịch Y thu được 8,55 gam kết tủa. Trộn 200 ml dd X với 500 ml dd Y thu được 12,045 gam kết tủa. Nồng độ mol/l của dd X là
Câu 14 :
Cho x gam Al tan hoàn toàn vào y mol HCl thu được dung dịch Z chứa 2 chất tan có cùng nồng độ mol. Thêm từ từ dung dịch NaOH vào dung dịch Z thì đồ thị biểu diễn lượng kết tủa phụ thuộc vào lượng OH- là 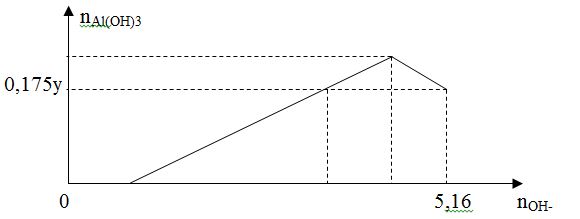 Giá trị của x là :
Câu 15 :
Nhỏ từ từ dung dịch đến dư Ba(OH)2 0,2M vào 100 ml dung dịch A chứa Al2(SO4)3 xM. Mối quan hệ giữa khối lượng kết tủa và số mol OH- được biểu diễn bằng đồ thị sau: 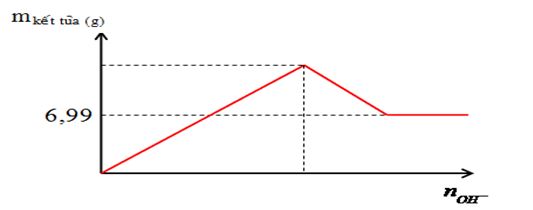 Nếu cho 100 ml dung dịch hỗn hợp Ba(OH)2 0,2M và NaOH 0,3M vào 100 ml dung dịch A thì khối lượng kết tủa thu được là bao nhiêu?
Câu 16 :
Dung dịch X chứa a mol AlCl3 và 2a mol HCl. Rót từ từ dung dịch NaOH vào dung dịch X ta có đồ thị sau 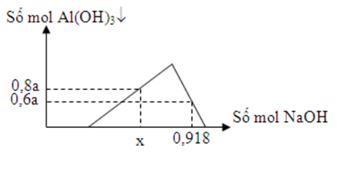 Giá trị của x là
Câu 17 :
Hòa tan hết a mol Al vào dung dịch chứa 2a mol NaOH thu được dung dịch X. Kết luận nào sau đây đúng ?
Câu 18 :
Hòa tan hoàn toàn m gam hỗn hợp gồm Al và Mg trong V ml dung dịch HNO3 2,5M. Kết thúc phản ứng thu được dung dịch X (không chứa muối amoni) và 0,084 mol hỗn hợp khí N2 và N2O có tỉ khối so với oxi là 31 : 24. Cho từ từ dung dịch NaOH 2M vào dung dịch X thì lượng kết tủa biến thiên theo đồ thị hình vẽ bên .
Giá trị của m và V lần lượt là :
Câu 19 :
Cho 46,6 gam hỗn hợp X gồm Na, K, Ba và Al2O3 ( trong đó oxi chiếm 30,9% về khối lượng) hòa tan hết trong nước thu được dung dịch Y và 8,96 lít H2 ( đktc). Cho 3,1 lít dung dịch HCl 0,5M vào dung dịch Y thu được m gam kết tủa. Giá trị của m là
Câu 20 :
Cho một mẫu hợp kim Na-Ba tác dụng với nước dư thu được dung dịch X và 3,36 lít khí (đktc). Cho dung dịch X tác dụng với 100 ml dung dịch hỗn hợp HCl 1M và AlCl3 0,6M. Khối lượng kết tủa thu được là
Câu 21 :
Hòa tan hoàn toàn 0,54 gam Al vào trong 200 ml dung dịch X chứa HCl 0,2M và H2SO4 0,1M thu được dung dịch Y. Thể tích dung dịch NaOH 1M cần thêm vào dung dịch Y để lượng kết tủa thu được lớn nhất là
Câu 22 :
Trộn 100 ml dung dịch AlCl3 1M với 350 ml dung dịch NaOH 1M. Khi phản ứng xảy ra hoàn toàn, khối lượng kết tủa thu được là
Câu 23 :
Cho lượng dư chất nào trong các chất sau vào dung dịch AlCl3 mà sau khi các phản ứng xảy ra hoàn toàn thu được kết tủa Al(OH)3?
Câu 24 :
Hỗn hợp X gồm Al và Al2O3. Hòa tan hoàn toàn 1,83 gam X trong 50 ml dung dịch NaOH 1M (vừa đủ), thu được V lít H2 (đktc). Giá trị của V là
Câu 25 :
Cho hỗn hợp kim loại gồm 5,4 gam Al và 2,3 gam Na tác dụng với nước dư. Sau khi các phản ứng xảy ra hoàn toàn khối lượng chất rắn còn lại là
Câu 26 :
Cho từ từ đến dư dung dịch Ba(OH)2 vào dung dịch Al2(SO4)3 hiện tượng quan sát được là
Câu 27 :
Hòa tan hết m gam nhôm vào dung dịch NaOH 1M, thu được 6,72 lít khí (đktc). Thể tích dung dịch NaOH tối thiểu cần dùng là
Câu 28 :
Cho 11,8 gam hỗn hợp X gồm Al và Cu vào dung dịch NaOH (loãng, dư). Khi phản ứng xảy ra hoàn toàn, thu được 6,72 lít khí H2 (đktc). Khối lượng của Cu trong hỗn hợp X là
Câu 29 :
Lần lượt tiến hành 2 thí nghiệm sau: - Thí nghiệm 1: Cho từ từ dd NH3 đến dư vào dd Al(NO3)3. - Thí nghiệm 2: Cho từ từ dd NaOH đến dư vào dd Al(NO3)3. Phát biểu nào sau đây đúng?
Câu 30 :
Cho 100 ml dung dịch NaOH x mol/l (x > 0,4M) vào dung dịch chứa 0,02 mol MgCl2 và 0,02 mol AlCl3. Lọc lấy kết tủa và nung đến khối lượng không đổi được m gam chất rắn. Để m nhỏ nhất thì giá trị của x tối thiểu là
Câu 31 :
Hoà tan 0,12 mol FeCl3, 0,15 mol MgSO4 và 0,16 mol Al2(SO4)3 vào dung dịch chứa 0,4 mol H2SO4 và 0,1 mol HCl được dung dịch X. Cho 254 ml dung dịch NaOH 10M vào X được m gam kết tủa. Giá trị của m là
Câu 32 :
Trường hợp nào sau đây thu được Al(OH)3?
Câu 33 :
Nhận định nào sau đây không đúng ?
Câu 34 :
Cho từ từ dung dịch Ba(OH)2 đến dư vào dung dịch chứa a mol hỗn hợp gồm HCl, AlCl3 và Al2(SO4)3. Số mol kết tủa thu được (y mol) phụ thuộc vào số mol Ba(OH)2 (x mol) được biểu diễn như đồ thị bên. Giá trị của a là:
Câu 35 :
Cho 0,85 lít dung dịch NaOH 1M vào dung dịch chứa 0,1 mol Al2(SO4)3 và 0,1 mol H2SO4 đến khi phản ứng hoàn toàn, thu được m gam kết tủa. Giá trị của m là:
Câu 36 :
Cho từ từ 350 ml dung dịch NaOH 1M vào 100 ml dung dịch AlCl3 x mol/l, sau khi các phản ứng xảy ra hoàn toàn thu được 3,9 gam kết tủa.Giá trị của x là
Câu 37 :
Hòa tan hoàn toàn m gam Al vào dung dịch loãng chứa 0,2 mol H2SO4, thu được khí H2 và dung dịch X. Cho từ từ dung dịch NaOH 2M vào X, kết quả thí nghiệm được ghi ở bảng sau:
Giá trị của m và a lần lượt là
Câu 38 :
Hỗn hợp X gồm Al và Al2O3. Cho m gam hỗn hợp X tác dụng với dung dịch NaOH vừa đủ thu được 1,344 lít H2 (đktc) và dung dịch Y. Cho dung dịch Y tác dụng với dung dịch HCl dư thu được dung dịch Z chứa 26,88 gam muối. Phần trăm khối lượng Al trong hỗn hợp X gần nhất với
Câu 39 :
Cho phản ứng sau: Al + H2O + NaOH → NaAlO2 + 1,5H2. Chất nào đóng vai trò là chất oxi hóa:
Kali alum là muối sulfat kép của kali và nhôm, tên Việt Nam gọi là “phèn chua”. Công thức hóa học của nó là KAl(SO4)2 và thông thường được tìm thấy ở dạng ngậm nước là KAl(SO4)2.12H2O. Phèn chua đó là loại muối có tinh thể to nhỏ không đều, không màu hoặc trắng, cũng có thể trong hoặc hơi đục.
Câu 40
Hòa tan hoàn toàn 94,8 gam phèn chua KAl(SO4)2.12H2O vào nước thu được dung dịch X. Cho toàn bộ X tác dụng với 350ml dung dịch chứa Ba(OH)2 0,5M và NaOH 1M, sau khi các phản ứng xảy ra hoàn toàn thu được m gam kết tủa. Giá trị của m là
Câu 41
Ở miền Trung thường xuyên bị mưa bão khiến nguồn nước sinh hoạt của người dân sẽ bị đục và ảnh hưởng đến chất lượng. Người dân thường dùng phèn chua làm trong nước sinh hoạt để sử dụng. Phương trình hóa học giải thích cho việc làm đó là
Câu 42
Phèn chua được sử dụng trong công nghiệp nhuộm vải vì sinh ra tác nhân X bị vải hấp thụ giữ chặt trên bề mặt sẽ kết hợp với phẩm nhuộm tạo nên màu bền. X là chất hay ion nào sau đây?
Lời giải và đáp án
Câu 1 :
Trộn dung dịch chứa a mol AlCl3 với dung dịch chứa b mol NaOH. Để thu được kết tủa thì cần có tỉ lệ
Đáp án : D Phương pháp giải :
xem lại lí thuyết nhôm và hợp chất tác dụng với dung dịch kiềm Lời giải chi tiết :
Nếu b ≥ 4a thì kết tủa bị hoà tan hoàn toàn => để thu được kết tủa thì b < 4a
Câu 2 :
Dùng 200 ml dung dịch NaOH 1M để hòa tan hết tối đa m gam Al2O3. Giá trị của m là
Đáp án : D Phương pháp giải :
2nNaOH = nAl2O3 Lời giải chi tiết :
2NaOH + Al2O3 → 2NaAlO2 + H2O 0,2 → 0,1 => mAl2O3 = 0,1.102 = 10,2 gam
Câu 3 :
Cho 500 ml dung dịch NaOH 1M vào 150 ml dung dịch AlCl3 1M. Sau khi phản ứng xảy ra hoàn toàn thu được m gam kết tủa. Giá trị của m là
Đáp án : C Phương pháp giải :
Bài toán muối nhôm tác dụng với dd kiềm + Nếu b/a ≤ 3 thì kết tủa chưa bị hoà tan và nAl(OH)3= b/3 + Nếu 3 < b/a < 4 thì kết tủa bị hoà tan 1 phần và nAl(OH)3= 4a-b + Nếu b/a ≥ 4 thì kết tủa bị hoà tan hoàn toàn Lời giải chi tiết :
nOH = 0,5 ; nAl3+ = 0,15 mol => nAl(OH)3 = 4nAl3+ - nOH = 0,1 mol => mkết tủa = 7,8 gam Cách khác: Al + 3OH- → Al(OH)3 0,15 → 0,45 → 0,15 Al(OH)3 + OH- → AlO2- + H2 0,05 \( \leftarrow \) 0,05 => nAl(OH)3 = 0,15- 0,05 = 0,1 mol
Câu 4 :
Cho 200 ml dung dịch AlCl3 1,5M tác dụng với V lít dung dịch NaOH 0,5M, lượng kết tủa thu được là 15,6 gam. Giá trị lớn nhất của V là
Đáp án : D Phương pháp giải :
+ Khả năng 1: Nếu Al3+ dư chỉ xảy ra 1 phản ứng: Al3+ + 3OH- → Al(OH)3 (1) 3b ← b => số mol OH- dùng nhỏ nhất = 3b mol + Khả năng thứ 2: Nếu Al3+ hết xảy ra 2 phản ứng: Al3+ + 3OH- → Al(OH)3 (1) a → 3a → a Al(OH)3 + OH- → [Al(OH)4]- (2) a – b → a –b => số mol OH- dùng lớn nhất = 4a – b mol Lời giải chi tiết :
nAlCl3 = 0,3 mol; nAl(OH)3 = 0,2 mol => số mol OH- dùng lớn nhất = 4a – b = 4.0,3 – 0,2 = 1 mol => VNaOH = 1 / 0,5 = 2 lít
Câu 5 :
Hòa tan 8,6 gam hỗn hợp kim loại K và Al vào nước, sau phản ứng xảy ra hoàn toàn, thu được 4,48 lít khí (đktc) và m gam chất không tan. Giá trị của m là
Đáp án : C Phương pháp giải :
Bảo toàn e: nK + 3nAl = 2nH2 Lời giải chi tiết :
Chất rắn không tan là Al còn dư Gọi nK = x mol => nAl phản ứng = x K → K+ + 1e 2H+ + 2e → H2 x x 4x → 2x Al → Al3+ + 3e x 3x => 2x = 0,2 => x = 0,1 mol => mAl dư = 8,6 - 39.0,1 - 27.0,1 = 2 gam
Câu 6 :
Cho m gam hỗn hợp gồm Al và Na vào nước dư, sau khi các phản ứng xảy ra hoàn toàn, thu được 2,24 lít khí H2 (đktc) và 2,35 gam chất rắn không tan. Giá trị của m là :
Đáp án : A Phương pháp giải :
+) nNa = x mol => nAl phản ứng = x mol +) Bảo toàn e: nNa + 3nAl = 2nH2 => x + 3x = 0,1.2 => x = 0,05 mol +) mhỗn hợp đầu = mAl dư + mAl pứ + mNa = 2,35 + 0,05.27 + 0,05.23 = 4,85 gam Lời giải chi tiết :
Chất rắn không tan là Al Gọi nNa = x mol => nAl phản ứng = x mol Bảo toàn e: nNa + 3nAl = 2nH2 mhỗn hợp đầu = mAl dư + mAl pứ + mNa = 2,35 + 0,05.27 + 0,05.23 = 4,85 gam
Câu 7 :
X gồm Ba và Al. Cho m gam X vào nước dư, sau khi các phản ứng xảy ra hoàn toàn, thu được 8,96 lít khí H2 (đktc). Mặt khác, hòa tan hoàn toàn m gam X bằng dung dịch NaOH, thu được 15,68 lít khí H2 (đktc). Giá trị của m là
Đáp án : C Lời giải chi tiết :
Ba + 2H2O → Ba(OH)2 + H2 Ba(OH)2 + 2Al + H2O → Ba(AlO2)2 + 3H2 => nH2 = 4nBa = 0,4 mol => nBa = 0,1 mol Vì X + NaOH tạo nH2 = 0,7 mol > 0,4 mol => chứng tỏ Al dư ở thí nghiệm đầu Phần 2 cả Al và Ba đều hết Ta có Ba → H2 0,1 0,1 Al → 3/2 H2 => nH2 do Al = nH2(2) – 0,1 = 0,6mol => nAl = 2/3.nH2 do Al = 0,4 mol => mX = 24,5 gam
Câu 8 :
Một hỗn hợp X gồm Na, Al và Fe (với tỉ lệ mol Na và Al tương ứng là 5 : 4) tác dụng với H2O dư thì thu được V lít khí, dung dịch Y và chất rắn Z. Cho Z tác dụng với dung dịch H2SO4 loãng dư thì thu được 0,25V lít khí (các khí đo ở cùng điều kiện). Thành phần % theo khối lượng của Fe trong hỗn hợp X là
Đáp án : D Phương pháp giải :
+) Gọi nNa = 5x => nAl = 4x +) Vì nNa > nAl => chất rắn chỉ còn Fe => nFe = nH2 sau = 0,25a +) Bảo toàn e: ${\text{ }}{n_{Na}} + {\text{ 3}}{n_{Al}}\, = 2{n_{{H_2}}}$ Lời giải chi tiết :
Giả sử V lít khí có a mol khí Gọi nNa = 5x => nAl = 4x Na + H2O → NaOH + ½ H2 NaOH + Al + H2O → NaAlO2 + 3/2H2 Vì nNa > nAl => chất rắn chỉ còn Fe => nFe = nH2 sau = 0,25a (mol) Bảo toàn e: => 5x + 3.4x = 2a => a = 8,5x => nFe = 0,25.8,5x = 2,125x $ \to \,\% {m_{Fe}} = \dfrac{{2,125x.56}}{{5x.23 + 4x.27 + 2,125.56x}}{\text{.100% }}\,\,{\text{ = }}34,80\% $
Câu 9 :
Cho V lít dung dịch NaOH 1M vào dung dịch chứa 0,14 mol AlCl3, thu được m gam kết tủa. Mặt khác, cho 1,5V lít dung dịch NaOH 1M vào dung dịch chứa 0,14 mol AlCl3, thu được 0,75m gam kết tủa. Giá trị của V là
Đáp án : A Phương pháp giải :
Bài toán muối nhôm tác dụng với dd kiềm + Nếu b/a ≤ 3 thì kết tủa chưa bị hoà tan và nAl(OH)3= b/3 + Nếu 3 < b/a < 4 thì kết tủa bị hoà tan 1 phần nAl(OH)3= 4a-b + Nếu b/a ≥ 4 thì kết tủa bị hoà tan hoàn toàn Lời giải chi tiết :
Giả sử thí nghiệm 1 Al3+ dư => nNaOH = 3nkết tủa (1) Thí ngiệm 2 : có sự hòa tan kết tủa vì NaOH tăng mà lượng kết tủa giảm => nkết tủa = 4.nAlCl3 – nOH- (2) Từ (1),(2) : $\left\{ \begin{gathered}V = 3.\dfrac{m}{{78}} \hfill \\\dfrac{{0,75m}}{{78}} = 4.0,14 - 1,5V \hfill \\ \end{gathered} \right.$ => V = 0,32 lit
Câu 10 :
Tiến hành 2 thí nghiệm: Thí nghiệm 1: cho 100 ml dung dịch AlCl3 x (mol/l) tác dụng với 600 ml dung dịch NaOH 1M thu được 2y mol kết tủa. Thí nghiệm 2: Cho 100 ml dd AlCl3 x (mol/l) tác dụng với 660 ml dd NaOH 1M thu được y mol kết tủa. Giá trị của x là:
Đáp án : C Phương pháp giải :
Bài toán muối nhôm tác dụng với dd kiềm + Nếu b/a ≤ 3 thì kết tủa chưa bị hoà tan và nAl(OH)3= b/3 + Nếu 3 < b/a < 4 thì kết tủa bị hoà tan 1 phần nAl(OH)3= 4a-b + Nếu b/a ≥ 4 thì kết tủa bị hoà tan hoàn toàn Lời giải chi tiết :
Al3+ như nhau; lượng NaOH tăng mà kết tủa lại giảm → có 2 TH xảy ra là : TH1: ở TN1 kết tủa chưa cực đại, TN2 kết tủa bị tan 1 phần TH2: cả 2 TN kết tủa bị tan 1 phần $(1)\left\{ \begin{gathered}{n_{A{l^{3 + }}}} = 0,1x\,mol \hfill \\{n_{O{H^ - }}} = 0,6\,mol \hfill \\ \end{gathered} \right. \to 2y = \dfrac{{0,6}}{3} = 0,2 \to y = 0,1\,mol$ $(2):0,66 = 3.0,1x + (0,1x - 2y) \to x = 1,9$ (vô lý vì thu được 0,2 gam kết tủa) $TH2:\left\{\begin{gathered}(1)0,6 = 0,3x + (0,1x - 2y) \hfill \\(2)0,66 = 0,1x.3 + (0,1x - y) \hfill \\ \end{gathered} \right. \to \left\{ \begin{gathered}x = 1,8 \hfill \\y = 0,06 \hfill \\ \end{gathered} \right.$
Câu 11 :
Cho 5,6 gam hỗn hợp NaOH và KOH (có thành phần thay đổi) hòa tan vào nước được dung dịch Z. Cho dung dịch Z phản ứng với dung dịch chứa 0,04 mol AlCl3, khối lượng kết tủa thu được lớn nhất và nhỏ nhất là:
Đáp án : B Phương pháp giải :
Bài toán muối nhôm tác dụng với dd kiềm + Nếu b/a ≤ 3 thì kết tủa chưa bị hoà tan và nAl(OH)3= b/3 + Nếu 3 < b/a < 4 thì kết tủa bị hoà tan 1 phần nAl(OH)3= 4a-b + Nếu b/a ≥ 4 thì kết tủa bị hoà tan hoàn toàn Lời giải chi tiết :
Quy hỗn hợp về từng chất: Nếu hỗn hợp là NaOH $ \to {n_{O{H^ - }}} = {n_{NaOH}} = \dfrac{{5,6}}{{40}} = 0,14\,mol$ Chú ý NaOH tạo thành kết tủa lớn nhất rồi tan $ \to \left\{ \begin{gathered}{n_{O{H^ - }}} = 0,14\,mol \hfill \\{n_{A{l^{3 + }}}} = 0,04\,mol \hfill \\ \end{gathered} \right. \to 0,14 = 3.0,04 + (0,04 - {n_ \downarrow }) \to {n_\downarrow } = 0,02\,mol$ Nếu hỗn hợp là KOH $ \to {n_{O{H^ - }}} = {n_{KOH}} = 0,1 \to \left\{ \begin{gathered}{n_{O{H^ - }}} = 0,1\,mol \hfill \\{n_{A{l^{3 + }}}} = 0,04\,mol \hfill \\ \end{gathered} \right. \to n \downarrow = \frac{{0,1}}{3}\,mol$ $1,56 \leqslant m \downarrow \leqslant 2,6$
Câu 12 :
Hoà tan hoàn toàn 0,15mol phèn chua KAl(SO4)2.12H2O vào nước, thu được dung dịch X. Cho toàn bộ X tác dụng với 200 ml dung dịch (Ba(OH)2 1M + NaOH 0,75M), sau phản ứng hoàn toàn thu được m gam kết tủa. Giá trị của m là
Đáp án : A Phương pháp giải :
Bài toán muối nhôm tác dụng với dd kiềm + Nếu b/a ≤ 3 thì kết tủa chưa bị hoà tan và nAl(OH)3= b/3 + Nếu 3 < b/a < 4 thì kết tủa bị hoà tan 1 phần nAl(OH)3= 4a-b + Nếu b/a ≥ 4 thì kết tủa bị hoà tan hoàn toàn Lời giải chi tiết :
Ta có: $\left\{ \begin{gathered}{n_{A{l^{3 + }}}} = 0,15\,mol \hfill \\{n_{SO_4^{2 - }}} = 0,3\,mol \hfill \\ \end{gathered} \right.\,\, + \,\,\left\{ \begin{gathered}{n_{B{a^{2 + }}}}\,\, = \,0,2\,mol \hfill \\{n_{O{H^ - }}} = 0,55\,mol \hfill \\ \end{gathered} \right.\,\,\, \to \left\{ \begin{gathered}{n_{B{\text{aS}}{O_4}}} = {n_{B{a^{2 + }}}} = 0,2\,mol \hfill \\{n_{Al{{(OH)}_3}}} = 4{n_{A{l^{3 + }}}} - {n_{O{H^ - }}} = 0,05\,mol \hfill \\ \end{gathered} \right. \to m = 50,5$
Câu 13 :
X là dung dịch Al2(SO4)3, Y là dung dịch Ba(OH)2. Trộn 200 ml dd X với 300 ml dung dịch Y thu được 8,55 gam kết tủa. Trộn 200 ml dd X với 500 ml dd Y thu được 12,045 gam kết tủa. Nồng độ mol/l của dd X là
Đáp án : B Phương pháp giải :
Bài toán muối nhôm tác dụng với dd kiềm + Nếu b/a ≤ 3 thì kết tủa chưa bị hoà tan và nAl(OH)3= b/3 + Nếu 3 < b/a < 4 thì kết tủa bị hoà tan 1 phần và nAl(OH)3= 4a-b + Nếu b/a ≥ 4 thì kết tủa bị hoà tan hoàn toàn Lời giải chi tiết :
Khi trộn 200ml X với 500ml Y thu được lượng kết tủa lớn hơn trộn 200ml X với 300ml Y => khi trộn với 300ml Y, Al2(SO4)3 vẫn còn dư, Ba(OH)2 phản ứng hết, kết tủa Al(OH)3 không bị hòa tan Gọi x, y là nồng độ của 2 dung dịch X và Y Trộn 200 ml X với 300 ml Y: nBa(OH)2 = 0,3y 3Ba(OH)2 + Al2(SO4)3 → 3BaSO4 + 2Al(OH)3 0,3y 0,1y 0,3y 0,2y mkết tủa = mBaSO4 + mAl(OH)3 = 233.0,3y + 78.0,2y = 8,55g => y = 0,1M Trộn 200 ml X với 500 ml Y: nAl2(SO4)3 = 0,2x Al2(SO4)3 + 3Ba(OH)2 → 3BaSO4 + 2Al(OH)3 0,2x 0,3x 0,3x 0,2x Ba(OH)2 + 2Al(OH)3 → Ba(AlO2)2 + 4H2O z 2z mkết tủa = mBaSO4 + mAl(OH)3 = 233.0,3x + 78.(0,2x - 2z) = 12,045 gam => 85,5x - 156z = 12,045 Số mol Ba(OH)2 tham gia pư: nBa(OH)2 = 0,3x + z = 0,5.y = 0,5.0,1 = 0,05 mol => x = 0,15M và z = 0,005 mol Vậy nồng độ của dung dịch X và Y lần lượt là 0,15M và 0,1M
Câu 14 :
Cho x gam Al tan hoàn toàn vào y mol HCl thu được dung dịch Z chứa 2 chất tan có cùng nồng độ mol. Thêm từ từ dung dịch NaOH vào dung dịch Z thì đồ thị biểu diễn lượng kết tủa phụ thuộc vào lượng OH- là  Giá trị của x là :
Đáp án : A Phương pháp giải :
Bài toán muối nhôm tác dụng với dd kiềm + Nếu b/a ≤ 3 thì kết tủa chưa bị hoà tan và nAl(OH)3= b/3 + Nếu 3 < b/a < 4 thì kết tủa bị hoà tan 1 phần và nAl(OH)3= 4a-b + Nếu b/a ≥ 4 thì kết tủa bị hoà tan hoàn toàn Lời giải chi tiết :
Vì Z có 2 chất tan cùng nồng độ mol => đó là AlCl3 và HCl => nAlCl3 = nHCl => n = y – 3n => y = 4n (1) Tại nOH = 5,16 mol thì kết tủa tan 1 phần => nAl(OH)3 = 4nAl3+ - (nOH – nHCl (Z)) => 0,175y = 4n – ( 5,16 – n) (2) Từ (1), (2) => n = 1,2 mol => x = 32,4 gam
Câu 15 :
Nhỏ từ từ dung dịch đến dư Ba(OH)2 0,2M vào 100 ml dung dịch A chứa Al2(SO4)3 xM. Mối quan hệ giữa khối lượng kết tủa và số mol OH- được biểu diễn bằng đồ thị sau:  Nếu cho 100 ml dung dịch hỗn hợp Ba(OH)2 0,2M và NaOH 0,3M vào 100 ml dung dịch A thì khối lượng kết tủa thu được là bao nhiêu?
Đáp án : A Phương pháp giải :
Bài toán muối nhôm tác dụng với dd kiềm + Nếu b/a ≤ 3 thì kết tủa chưa bị hoà tan và nAl(OH)3= b/3 + Nếu 3 < b/a < 4 thì kết tủa bị hoà tan 1 phần và nAl(OH)3= 4a-b + Nếu b/a ≥ 4 thì kết tủa bị hoà tan hoàn toàn Lời giải chi tiết :
Khi đường thẳng nằm ngang thì lúc này kết tủa ổn định chỉ còn duy nhất BaSO4 => nBaSO4 = nSO4 = 0,3x = 0,03 mol => x = 0,1M Nếu nBa(OH)2 = 0,02 ; nNaOH = 0,03 mol => nOH = 0,07 ; nAl3+ = 0,02 => nAl(OH)3 = 4nAl3+ - nOH = 0,01 mol và nBaSO4 = nBa2+ = 0,02 mol => mkết tủa = 5,44g
Câu 16 :
Dung dịch X chứa a mol AlCl3 và 2a mol HCl. Rót từ từ dung dịch NaOH vào dung dịch X ta có đồ thị sau  Giá trị của x là
Đáp án : B Phương pháp giải :
Bài toán muối nhôm tác dụng với dd kiềm + Nếu b/a ≤ 3 thì kết tủa chưa bị hoà tan và nAl(OH)3= b/3 + Nếu 3 < b/a < 4 thì kết tủa bị hoà tan 1 phần và nAl(OH)3= 4a-b + Nếu b/a ≥ 4 thì kết tủa bị hoà tan hoàn toàn Lời giải chi tiết :
Tại nNaOH = 0,918 mol thì đồ thị đi xuống => kết tủa tan dần => nAl(OH)3 = 4nAl3+ - (nOH – nH+) => 0,6a = 4a – (0,918 – 2a) => a = 0,17 mol Tại nNaOH = x mol đồ thị đi lên => Al3+ dư => 3nAl(OH)3 + nHCl = nNaOH => x = 3.0,8a + 2a = 0,748 mol
Câu 17 :
Hòa tan hết a mol Al vào dung dịch chứa 2a mol NaOH thu được dung dịch X. Kết luận nào sau đây đúng ?
Đáp án : B Lời giải chi tiết :
Al + NaOH + H2O → NaAlO2 + 1,5H2 Mol a → a → a → 1,5a + NaOH còn dư => X có pH > 7 => A sai + VH2 = 22,4.1,5a = 33,6a (lít) => C sai + X phản ứng được với dung dịch CuSO4: 2NaOH + CuSO4 → Cu(OH)2 + Na2SO4 => D sai => B đúng
Câu 18 :
Hòa tan hoàn toàn m gam hỗn hợp gồm Al và Mg trong V ml dung dịch HNO3 2,5M. Kết thúc phản ứng thu được dung dịch X (không chứa muối amoni) và 0,084 mol hỗn hợp khí N2 và N2O có tỉ khối so với oxi là 31 : 24. Cho từ từ dung dịch NaOH 2M vào dung dịch X thì lượng kết tủa biến thiên theo đồ thị hình vẽ bên .
Giá trị của m và V lần lượt là :
Đáp án : D Phương pháp giải :
- Công thức tính nhanh khi hỗn hợp KL + HNO3 ne = ne KL = nNO2 + 3nNO + 8nN2O + 10nN2 + 8nNH4NO3 nHNO3 = 2nNO2 + 4nNO + 10nN2O + 12nN2 + 10nNH4NO3 - Bài toán Al3+ + OH- : Cho biết nAl3+ = a và nOH- = b, tính số mol kết tủa: + Với muối nhôm Các phản ứng xảy ra: Al3+ + 3OH- → Al(OH)3 (1) Al(OH)3 + OH- → (Al(OH)4)- (2) Từ (1) và (2) ta rút ra kết luận: + Nếu b/a ≤ 3 thì kết tủa chưa bị hoà tan và nAl(OH)3= b/3 + Nếu 3 < b/a < 4 thì kết tủa bị hoà tan 1 phần Al3+ + 3OH- → Al(OH)3 (1) mol a → 3a → a Al(OH)3 + OH- (Al(OH)4)- (2) Mol b-3a b-3a nAl(OH)3= 4a-b + Nếu b/a ≥ 4 thì kết tủa bị hoà tan hoàn toàn Lời giải chi tiết :
- Xét hỗn hợp khí : Mkhí = 32.31/24 = 124/3 => nN2 + nN2O = 0,084 mol và 28nN2 + 44nN2O = 0,084.124/3 => nN2 = 0,014 ; nN2O = 0,07 mol - Xét phản ứng kim loại và HNO3 : ne = 3nAl + 2nMg = 10nN2 + 8nN2O = 0,7 mol (*) nHNO3 pứ = 12nN2 + 10nN2O = 0,868 mol - Xét đồ thị : +) Tại nNaOH = 0,05.2 = 0,1 mol thì bắt đầu có kết tủa => nHNO3 dư = nNaOH = 0,1 mol => ånHNO3 = 0,868 + 0,1 = 0,968 mol => VHNO3 = 0,968 : 2,5 = 0,3872 lit = 387,2 ml +) Tại nNaOH = 0,4125.2 = 0,825 mol (Lúc này lượng kết tủa giảm sau khi đạt max) => Al(OH)3 tan 1 phần => nNaOH pứ = nNaOH – nHNO3 dư – 2nMg(OH)2 Các phản ứng : H+ + OH- → H2O Mg2+ + 2OH- → Mg(OH)2 Al3+ + 3OH- → Al(OH)3 Al(OH)3 + OH- → AlO2- + 2H2O => mkết tủa = mMg(OH)2 + mAl(OH)3 = 58.nMg + 78.(4nAl - nOH-) => 17,45 = 58.nMg + 78.(4nAl – (0,825 – 0,1 – 2nMg)) (**) Từ (*) và (**) => nMg = 0,2 ; nAl = 0,1 mol => m = mAl + mMg = 27.0,1 + 24.0,2 = 7,5g
Câu 19 :
Cho 46,6 gam hỗn hợp X gồm Na, K, Ba và Al2O3 ( trong đó oxi chiếm 30,9% về khối lượng) hòa tan hết trong nước thu được dung dịch Y và 8,96 lít H2 ( đktc). Cho 3,1 lít dung dịch HCl 0,5M vào dung dịch Y thu được m gam kết tủa. Giá trị của m là
Đáp án : C Phương pháp giải :
mO(X) = 46,6 . 0,309 = 14,4 gam nên nO = ? → \({n_{A{l_2}{O_3}}} = ?\) mol X có nNa = x; nK = y; nBa = z mol X + H2O có : Na → Na+ +1e K → K+ +1e Ba → Ba2+ + 2e 2H+1 +2e → H2 Bảo toàn e có → x + y + 2z → nOH- 2OH- + Al2O3 → 2AlO2- + H2O → Sau phản ứng có X có : OH- : ? mol và AlO2- : ? mol, Ba2+, Na+, K+ Lời giải chi tiết :
mO(X) = 46,6 . 0,309 = 14,4 gam nên nO = 0,9 mol Lại có \({n_{O(X)}} = 3{n_{A{l_2}{O_3}}} \Rightarrow {n_{A{l_2}{O_3}}} = 0,3\) mol X có nNa = x; nK = y; nBa = z mol thì mX = 23x + 39y + 137z + 102.0,3 =46,6 X + H2O có : Na → Na+ +1e K → K+ +1e Ba → Ba2+ + 2e 2H+1 +2e → H2 Bảo toàn e có x + y + 2z = 0,4.2 =0,8 mol → nOH- = x + y + 2z = 0,8 mol 2OH- + Al2O3 → 2AlO2- + H2O → Sau phản ứng có X có : OH- : 0,2 mol và AlO2- : 0,6 mol, Ba2+, Na+, K+ X + 1,55 mol HCl có H+ + OH- → H2O H+ + AlO2- + H2O → Al(OH)3 → H+ dư : 1,55 – 0,8 = 0,75 mol Al(OH)3 + 3H+ → Al3+ + 3H2O 0,25 ← 0,75 → Al(OH)3 : 0,35 mol → mkết tủa = 0,35.78 = 27,3 (g)
Câu 20 :
Cho một mẫu hợp kim Na-Ba tác dụng với nước dư thu được dung dịch X và 3,36 lít khí (đktc). Cho dung dịch X tác dụng với 100 ml dung dịch hỗn hợp HCl 1M và AlCl3 0,6M. Khối lượng kết tủa thu được là
Đáp án : B Phương pháp giải :
2Na + 2H2O → 2NaOH + H2 Ba + 2H2O → Ba(OH)2 + H2 Dựa vào PTHH ta thấy: nOH- = 2nH2 = ? X{OH-} + {H+: 0,1 mol; Al3+: 0,06 mol} thì thứ tự các phản ứng xảy ra là: H+ + OH- → H2O Al3+ + 3OH- → Al(OH)3 Al(OH)3 + OH- → AlO2- + 2H2O Đặt số mol vào các PTHH suy ra số mol kết tủa thu được. Lời giải chi tiết :
nH2 = 0,15 mol; nH+ = nHCl = 0,1 mol; nAl3+ = nAlCl3 = 0,06 mol 2Na + 2H2O → 2NaOH + H2 Ba + 2H2O → Ba(OH)2 + H2 Dựa vào PTHH ta thấy: nOH- = 2nH2 = 0,3 mol X{OH-: 0,3 mol} + {H+: 0,1 mol; Al3+: 0,06 mol} thì thứ tự các phản ứng xảy ra là: H+ + OH- → H2O 0,1 → 0,1dư 0,2 Al3+ + 3OH- → Al(OH)3 0,06 → 0,18 dư 0,02 → 0,06 Al(OH)3 + OH- → AlO2- + 2H2O 0,02 ← 0,02 => nAl(OH)3 thu được = 0,06 - 0,02 = 0,04 mol => m kết tủa = 0,04.78 = 3,12 gam
Câu 21 :
Hòa tan hoàn toàn 0,54 gam Al vào trong 200 ml dung dịch X chứa HCl 0,2M và H2SO4 0,1M thu được dung dịch Y. Thể tích dung dịch NaOH 1M cần thêm vào dung dịch Y để lượng kết tủa thu được lớn nhất là
Đáp án : C Phương pháp giải :
So sánh thấy: 3nAl (mol e tối đa do Al nhường) < nH+ (mol e tối đa do H+ nhận) → Al hết, H+ dư *Cách 1: - Xác định thành phần của dung dịch Y dựa vào bảo toàn điện tích - Cho Y tác dụng với NaOH để đạt kết tủa max thì: H+ + OH- → H2O Al3+ + 3OH- → Al(OH)3 ↓ Từ đó tính được lượng NaOH cần dùng *Cách 2: Kết tủa cực đại tức là ion Al3+ nằm hết trong Al(OH)3 → dd cuối cùng thu được chứa các ion: Na+, Cl-; SO42- Bảo toàn điện tích tính được số mol Na+ (NaOH) → thể tích dung dịch NaOH Lời giải chi tiết :
Kết tủa cực đại tức là ion Al3+ nằm hết trong Al(OH)3 → dd cuối cùng thu được chứa các ion: Na+, Cl- (0,04 mol); SO42- (0,02 mol) BTĐT → nNa+ = 0,04 + 0,02.2 = 0,08 mol = nNaOH → Vdd NaOH = n : CM = 0,08 : 1 = 0,08 lít = 80 ml
Câu 22 :
Trộn 100 ml dung dịch AlCl3 1M với 350 ml dung dịch NaOH 1M. Khi phản ứng xảy ra hoàn toàn, khối lượng kết tủa thu được là
Đáp án : C Lời giải chi tiết :
Ta có: nOH- = 0,35 mol; nAl3+ = nAlCl3 = 0,1 mol Ta có tỉ lệ: k = nOH- / nAl3+ = 0,35 / 0,1 = 3,5 ⟹ 3 < k < 4 ⟹ Kết tủa tan 1 phần Áp dụng công thức tính nhanh: n↓ = 4.nAl3+ - nOH- = 4.0,1 - 0,35 = 0,05 (mol) Vậy mAl(OH)3 = 0,05.78 = 3,9 gam
Câu 23 :
Cho lượng dư chất nào trong các chất sau vào dung dịch AlCl3 mà sau khi các phản ứng xảy ra hoàn toàn thu được kết tủa Al(OH)3?
Đáp án : D Phương pháp giải :
Dựa vào TCHH của Al(OH)3 Lời giải chi tiết :
A loại vì AlCl3 không phản ứng với Na2SO4 B loại vì: AlCl3 + 3NaOH → Al(OH)3 + 3NaCl Al(OH)3 ↓ + NaOH → NaAlO2 + 2H2O C loại vì: 2AlCl3 + 3Ba(OH)2 → 2Al(OH)3 ↓ + 3BaCl2 2Al(OH)3 + Ba(OH)2 → Ba(AlO2)2 + 4H2O D thỏa mãn vì AlCl3 + 3NH3 + 3H2O → Al(OH)3 ↓ + 3NH4Cl (lưu ý: NH3 không hòa tan được Al(OH)3)
Câu 24 :
Hỗn hợp X gồm Al và Al2O3. Hòa tan hoàn toàn 1,83 gam X trong 50 ml dung dịch NaOH 1M (vừa đủ), thu được V lít H2 (đktc). Giá trị của V là
Đáp án : C Phương pháp giải :
Đặt ẩn số mol của Al và Al2O3 Từ khối lượng hỗn hợp ⟹ (1) Từ số mol NaOH ⟹ (2) Lời giải chi tiết :
nNaOH = 0,05 mol Đặt nAl = x và nAl2O3 = y (mol) +) mhh X = 27x + 102y = 1,83 (1) +) Hỗn hợp X tác dụng với NaOH: Al + NaOH + H2O → NaAlO2 + 1,5 H2 x → x → 1,5x Al2O3 + 2NaOH → 2NaAlO2 + H2O y → 2y → nNaOH = x + 2y = 0,05 (2) Giải hệ (1) (2) được x = 0,03 và y = 0,01 ⟹ VH2 = 22,4.1,5x = 1,008 lít
Câu 25 :
Cho hỗn hợp kim loại gồm 5,4 gam Al và 2,3 gam Na tác dụng với nước dư. Sau khi các phản ứng xảy ra hoàn toàn khối lượng chất rắn còn lại là
Đáp án : B Phương pháp giải :
Tính theo các PTHH: 2Na + 2H2O → 2NaOH + H2 2Al + 2NaOH + 2H2O → 2NaAlO2 + 3H2 Lời giải chi tiết :
nAl = 0,2 mol; nNa = 0,1 mol 2Na + 2H2O → 2NaOH + H2 0,1 → 0,1 2Al + 2NaOH + 2H2O → 2NaAlO2 + 3H2 Bđ: 0,2 0,1 Pư: 0,1 ← 0,1 Sau: 0,1 0 Vậy chất rắn sau pư chứa 0,1 mol Al → mAl = 0,1.27 = 2,7 gam
Câu 26 :
Cho từ từ đến dư dung dịch Ba(OH)2 vào dung dịch Al2(SO4)3 hiện tượng quan sát được là
Đáp án : D Phương pháp giải :
Dựa vào tính chất hóa học của nhôm và hợp chất của nhôm được học trong sgk hóa 12. Lời giải chi tiết :
PTHH: Ba(OH)2 + Al2(SO4)3 → BaSO4↓ + Al(OH)3↓ Ba(OH)2 + Al(OH)3 → Ba(AlO2)2 + H2O Vậy hiện tượng quan sát được là xuất hiện kết tủa trắng (gồm BaSO4↓ và Al(OH)3↓) sau đó tan một phần Al(OH)3.
Câu 27 :
Hòa tan hết m gam nhôm vào dung dịch NaOH 1M, thu được 6,72 lít khí (đktc). Thể tích dung dịch NaOH tối thiểu cần dùng là
Đáp án : B Phương pháp giải :
Đổi số mol H2 (đktc) = VH2/22,4 = ? Tính toán mol NaOH theo mol H2 dựa vào PTHH: 2Al + 2NaOH + 2H2O → 2NaAlO2 + 3H2↑ Lời giải chi tiết :
nH2(đktc) = VH2/22,4 = 6,72/22,4 = 0,3 (mol) PTHH: 2Al + 2NaOH + 2H2O → 2NaAlO2 + 3H2↑ (mol) 0,2 ← 0,3 Theo PTHH: nNaOH = 2/3 nH2 =2/3×0,3 =0,2 (mol) → VNaOH = nNaOH : CM = 0,2 : 1 = 0,2 (lít) = 200 (ml)
Câu 28 :
Cho 11,8 gam hỗn hợp X gồm Al và Cu vào dung dịch NaOH (loãng, dư). Khi phản ứng xảy ra hoàn toàn, thu được 6,72 lít khí H2 (đktc). Khối lượng của Cu trong hỗn hợp X là
Đáp án : B Phương pháp giải :
Khi cho hỗn hợp X gồm Al và Cu vào dung dịch NaOH loãng dư thì chỉ có Al phản ứng. Al + NaOH + H2O → NaAlO2 + 3/2 H2 Dựa vào số mol H2 tính được số mol Al và khối lượng Al, từ đó mCu = mX - mAl Lời giải chi tiết :
Khi cho hỗn hợp X gồm Al và Cu vào dung dịch NaOH loãng dư thì chỉ có Al phản ứng. Al + NaOH + H2O → NaAlO2 + 3/2 H2 Ta có: nAl = 2/3.nH2 = 2/3.0,3 = 0,2 (mol) → mCu = mX - mAl = 11,8 - 0,2. 27 = 6,4 (g)
Câu 29 :
Lần lượt tiến hành 2 thí nghiệm sau: - Thí nghiệm 1: Cho từ từ dd NH3 đến dư vào dd Al(NO3)3. - Thí nghiệm 2: Cho từ từ dd NaOH đến dư vào dd Al(NO3)3. Phát biểu nào sau đây đúng?
Đáp án : A Phương pháp giải :
Dựa vào tính chất hóa học của Al(OH)3 và muối nhôm để nêu hiện tượng xảy ra. Lời giải chi tiết :
Thí nghiệm 1: Al(NO3)3 + 3NH3 + 3H2O → Al(OH)3↓ + 3NH4NO3 Al(OH)3 không tan trong dung dịch NH3 dư. Thí nghiệm 2: Al(NO3)3 + 3NaOH→ Al(OH)3↓ + 3NaNO3 Al(OH)3 + NaOH → NaAlO2 + 2H2O Vậy hiện tượng của 2 thí nghiệm là: - Thí nghiệm 1 xuất hiện kết tủa keo trắng đến tối đa sau đó kết tủa giữ nguyên không tan. - Thí nghiệm 2 xuất hiện kết tủa keo trắng đến tối đa sau đó kết tủa tan.
Câu 30 :
Cho 100 ml dung dịch NaOH x mol/l (x > 0,4M) vào dung dịch chứa 0,02 mol MgCl2 và 0,02 mol AlCl3. Lọc lấy kết tủa và nung đến khối lượng không đổi được m gam chất rắn. Để m nhỏ nhất thì giá trị của x tối thiểu là
Đáp án : C Phương pháp giải :
Theo đề bài ta so sánh thấy \({n_{O{H^ - }}} > 2{n_{M{g^{2 + }}}}\) ⟹ MgCl2 hết, có phản ứng giữa AlCl3 và NaOH Như vậy m nhỏ nhất khi chất rắn sau nung chỉ có MgO, không có Al2O3 ⟹ Kết tủa Al(OH)3 bị tan hết. Viết các phương trình phản ứng có thể xảy ra. Tính số mol NaOH dựa vào phương trình phản ứng Tính được giá trị của x theo công thức tính CM Lời giải chi tiết :
Theo đề bài \(x > 0,4M \to {n_{O{H^ - }}} > 0,04(mol)\) ⟹ \({n_{O{H^ - }}} > 2{n_{M{g^{2 + }}}}\) ⟹ MgCl2 hết, có phản ứng giữa AlCl3 và NaOH Như vậy m nhỏ nhất khi chất rắn sau nung chỉ có MgO, không có Al2O3 ⟹ Kết tủa Al(OH)3 bị tan hết. MgCl2 + 2NaOH → Mg(OH)2↓ + 2NaCl 0,02 → 0,04 → 0,02 (mol) Al(OH)3 + 3NaOH → Al(OH)3↓ + 3NaCl 0,02 → 0,06 → 0,02 (mol) Al(OH)3 + NaOH → NaAlO2 + 2H2O 0,02 → 0,02 (mol) → nNaOH = 0,04 + 0,06 + 0,02 = 0,12 mol Vậy \(x = {{0,12} \over {0,1}} = 1,2M\).
Câu 31 :
Hoà tan 0,12 mol FeCl3, 0,15 mol MgSO4 và 0,16 mol Al2(SO4)3 vào dung dịch chứa 0,4 mol H2SO4 và 0,1 mol HCl được dung dịch X. Cho 254 ml dung dịch NaOH 10M vào X được m gam kết tủa. Giá trị của m là
Đáp án : A Phương pháp giải :
Tính số mol của các ion tham gia phản ứng: Fe3+, Mg2+, Al3+, H+, OH-. Thứ tự phản ứng: H+ + OH- → H2O Fe3+ + 3OH- → Fe(OH)3 Mg2+ + 2OH- → Mg(OH)2 Al3+ + 3OH- → Al(OH)3 Al(OH)3 + OH- → AlO2- + 2H2O Lời giải chi tiết :
n Fe3+ = 0,12 mol; n Mg2+ = 0,15 mol; n Al3+ = 0,32 mol nH+ = 0,9 mol n OH- = 2,54 mol Khi cho NaOH vào dd X thì: (1) H+ + OH- → H2O → n OH- = n H+ = 0,9 mol (2) Fe3+ + 3OH- → Fe(OH)3↓ → nOH- = 3nFe3+ = 3.0,12 = 0,36 mol (3) Mg2+ + 2OH- → Mg(OH)2 ↓ → nOH- = 2 nMg2+ = 2.0,15 = 0,3 mol Từ (1), (2) và (3) → nOH- (dư) =2,54 - 0,9 - 0,36 - 0,3 = 0,98 mol (4) Al3+ + 3OH- → Al(OH)3↓ → n OH- = 3n Al3+ = 3.0,32 = 0,96 mol Do OH- dư 0,02 mol nên tiếp tục có pứ: (5) Al(OH)3 + OH- → AlO2- + 2H2O → n Al(OH)3 = 0,32 - 0,02 = 0,3 mol Vậy kết tủa gồm Fe(OH)3: 0,12 mol, Mg(OH)2: 0,15 mol, Al(OH)3: 0,3 mol → m ↓= 0,12.107 + 0,15.58 + 0,3.78 = 44,94 g
Câu 32 :
Trường hợp nào sau đây thu được Al(OH)3?
Đáp án : D Phương pháp giải :
Viết phương trình phản ứng rồi kết luận Lời giải chi tiết :
Phương án A: \(A{l_2}{(S{O_4})_3} + 6NaOH \to 2Al{(OH)_3} + 3N{a_2}S{O_4}\) \(NaO{H_{dư}} + Al{(OH)_3} \to NaAl{O_2} + 2{H_2}O\) Phương án B: Không có phản ứng Phương án C: \(A{l_2}{(S{O_4})_3} + 3Ca{(OH)_2} \to 2Al{(OH)_3} + 3CaS{O_4}\) \(2Al{(OH)_3} + Ca{(OH)_{2dư}} \to Ca{(Al{O_2})_2} + 4{H_2}O\) Phương án D: \(A{l_2}{(S{O_4})_3} + 6N{H_3} + 6{H_2}O \to 2Al{(OH)_3} + 3{(N{H_4})_2}S{O_4}\)
Câu 33 :
Nhận định nào sau đây không đúng ?
Đáp án : A Phương pháp giải :
Từ lý thuyết về Al, chọn đáp án đúng. Lời giải chi tiết :
A sai, vì trong phản ứng giữa Al với dung dịch NaOH, chất đóng vai trò oxi hóa là H2O không phải NaOH 2Al + 2NaOH + 2H2O → 2NaAlO2 + 3H2 \(\mathop {Al}\limits^0 \to \mathop {Al}\limits^{ + 3} + 3{\rm{e}}\) ⟹ Al là chất khử \(2\mathop H\limits^{ + 1} + 2{\rm{e}} \to {H_2}\) ⟹ H2O là chất oxi hóa
Câu 34 :
Cho từ từ dung dịch Ba(OH)2 đến dư vào dung dịch chứa a mol hỗn hợp gồm HCl, AlCl3 và Al2(SO4)3. Số mol kết tủa thu được (y mol) phụ thuộc vào số mol Ba(OH)2 (x mol) được biểu diễn như đồ thị bên. Giá trị của a là:
Đáp án : A Phương pháp giải :
*Đoạn 1: OH- + H+ → H2O Ba2+ + SO42- → BaSO4 Từ đó tính được số mol H+. *Đoạn 2: Ba2+ + SO42- → BaSO4 Al3+ + 3OH- → Al(OH)3 Ta có: nSO4(2-) = nBa2+ = nBa(OH)2 *Đoạn 3: Al3+ + 3OH- → Al(OH)3 Ta có nOH- = nH+ + 3.nAl(OH)3 → nAl(OH)3 max Bảo toàn Al suy ra nAlCl3 → tổng a Lời giải chi tiết :
*Đoạn 1: OH- + H+ → H2O Ba2+ + SO42- → BaSO4 Ta có: nH+ = nOH- = 2.nBa(OH)2 = 2.0,15 = 0,3 mol *Đoạn 2: Ba2+ + SO42- → BaSO4 Al3+ + 3OH- → Al(OH)3 Ta có: nSO4(2-) = nBa2+ = nBa(OH)2 = 0,3 mol *Đoạn 3: Al3+ + 3OH- → Al(OH)3 Ta có nOH- = nH+ + 3.nAl(OH)3 → nAl(OH)3 max = 0,3 mol Vậy nHCl = nH+ = 0,3 mol ; nAl2(SO4)3 = 1/3.nSO4(2-) = 0,1 mol Bảo toàn Al suy ra nAlCl3 = 0,1 mol Vậy tổng a = 0,3 + 0,1 + 0,1 = 0,5 mol
Câu 35 :
Cho 0,85 lít dung dịch NaOH 1M vào dung dịch chứa 0,1 mol Al2(SO4)3 và 0,1 mol H2SO4 đến khi phản ứng hoàn toàn, thu được m gam kết tủa. Giá trị của m là:
Đáp án : A Phương pháp giải :
Thứ tự phản ứng khi cho OH- vào {H+; Al3+} là: (1) H+ + OH- → H2O (2) Al3+ + 3OH- → Al(OH)3 (3) Al(OH)3 + OH- → AlO2- + 2H2O - Tính được lượng OH- còn lại sau phản ứng (1): \({n_{O{H^ - }con\,lai}} = {n_{O{H^ - }}} - {n_{{H^ + }}}\) - Tính tỉ lệ: \((*) = \frac{{{n_{O{H^ - }}} - {n_{{H^ + }}}}}{{{n_{A{l^{3 + }}}}}}\) + Nếu (*) ≤ 3 thì Al3+ dư hoặc vừa đủ, lúc này Al(OH)3 chưa bị tan; (1) kết thúc, (2) đang xảy ra Khi đó: \({n_{O{H^ - }}} = {n_{{H^ + }}} + 3{n_{Al{{(OH)}_3}}}\) + Nếu 3 < (*) < 4 thì kết tủa tan 1 phần; (1) (2) đã kết thúc, (3) đang xảy ra Phản ứng (1): nOH- (1) = nH+ Phản ứng (2): nOH- (2) = 3nAl3+ Phản ứng (3): nOH- (3) = nAl(OH)3 bị tan = nAl3+ - nAl(OH)3 Vậy ta có: ∑nOH- = nH+ + 3nAl3+ + nAl3+ - nAl(OH)3 = nH+ + 4nAl3+ - nAl(OH)3 + Nếu (*) > 4 thì kết tủa tan hoàn toàn Lời giải chi tiết :
Ta có: nOH- = nNaOH = 0,85 mol; nAl3+ = 2.nAl2(SO4)3 = 0,2 mol; nH+ = 2.nH2SO4 = 0,2 mol Thứ tự phản ứng khi cho OH- vào {H+; Al3+} là: (1) H+ + OH- → H2O 0,2 0,2 mol Lượng OH- còn lại sau phản ứng (1): \({n_{O{H^ - }con\,lai}} = {n_{O{H^ - }}} - {n_{{H^ + }}} = 0,85 - 0,2 = 0,65(mol)\) Xét tỉ lệ (*) = 0,65 : 0,2 = 3,25 → 3< (*) < 4 → Kết tủa tan 1 phần; (1) (2) đã kết thúc, (3) đang xảy ra Áp dụng công thức tính nhanh (xem cách chứng minh ở mục phương pháp): nOH- = nH+ + 4nAl3+ - nAl(OH)3 → 0,85 = 0,2 + 4.0,2 - nAl(OH)3 → nAl(OH)3 = 0,15 mol → mkết tủa = 0,15.78 = 11,7 (g)
Câu 36 :
Cho từ từ 350 ml dung dịch NaOH 1M vào 100 ml dung dịch AlCl3 x mol/l, sau khi các phản ứng xảy ra hoàn toàn thu được 3,9 gam kết tủa.Giá trị của x là
Đáp án : D Phương pháp giải :
Ta thấy: nAl(OH)3 < 3nNaOH → xảy ra trường hợp tạo kết tủa cực đại, sau đó kết tủa tan 1 phần. Khi cho từ từ dd NaOH vào dd AlCl3 xảy ra phản ứng theo thứ tự sau: 3NaOH + AlCl3 → Al(OH)3↓ + 3NaCl (1) NaOH + Al(OH)3↓ → NaAlO2 + 2H2O (2) Đặt số mol của các chất, tính toán theo 2 PTHH trên. Lời giải chi tiết :
nNaOH = VNaOH×CM = 0,35×1 = 0,35 (mol) ; nAlCl3 = 0,1x (mol) nAl(OH)3 = 3,9 : 78 = 0,05 (mol) Ta thấy: nAl(OH)3 < 3nNaOH → xảy ra trường hợp tạo kết tủa cực đại, sau đó kết tủa tan 1 phần. Khi cho từ từ dd NaOH vào dd AlCl3 xảy ra phản ứng theo thứ tự sau: 3NaOH + AlCl3 → Al(OH)3↓ + 3NaCl (1) 0,3x ← 0,1x → 0,1x (mol) NaOH + Al(OH)3↓ → NaAlO2 + 2H2O (2) (0,1x – 0,05) ← (0,1x – 0,05) (mol) Theo PTHH (1): nAl(OH)3 cực đại = nAlCl3 = 0,1x (mol) → nAl(OH)3 bị hòa tan = nAl(OH)3 cực đại – nAl(OH)3 còn lại = 0,1x – 0,05 (mol) Ta có: ∑ nNaOH(1)+(2) = 0,3x + (0,1x – 0,05) → 0,4x - 0,05 = 0,35 → 0,4x = 0,4 → x = 1 (M) * Ta cũng có thể áp dụng công thức tính nhanh 4 * nAlCl3 - nNaOH = n Al(OH)3 4 * 0,1x - nNaOH = n Al(OH)3 => 4* 0,1 x = 0,05 + 0,35 => x = 1M
Câu 37 :
Hòa tan hoàn toàn m gam Al vào dung dịch loãng chứa 0,2 mol H2SO4, thu được khí H2 và dung dịch X. Cho từ từ dung dịch NaOH 2M vào X, kết quả thí nghiệm được ghi ở bảng sau:
Giá trị của m và a lần lượt là
Đáp án : D Phương pháp giải :
\(Al{\rm{ }} + {\rm{ }}\mathop {{H_2}S{O_4}}\limits_{0,2\,mol} \buildrel {} \over Khi cho NaOH vào dd X xảy ra theo thứ tự: H+ + OH- → H2O (1) Al3+ + 3OH-→ Al(OH)3↓ (2) Al(OH)3 + OH- → AlO2- + 2H2O (3) Tại mỗi thời điểm, khảo sát mức độ phản ứng => Lập hệ phương trình 3 ẩn => a Lời giải chi tiết :
\(Al{\rm{ }} + {\rm{ }}\mathop {{H_2}S{O_4}}\limits_{0,2\,mol} \buildrel {} \over + BT SO42-: 3x + y = 0,2 (1) Khi cho NaOH vào dd X xảy ra theo thứ tự: H+ + OH- → H2O Al3+ + 3OH-→ Al(OH)3↓ Al(OH)3 + OH- → AlO2- + 2H2O + Nếu như kết tủa đạt max: nNaOH = 3nAl3+ + nH+ = 6x + 2y = 0,4 mol Vậy đồ thị 1 điểm bên trái và 1 điểm bên phải + Xét điểm 0,28 mol: \(\left\{ \matrix{Al{(OH)_3}:{{2a + 1,56} \over {78}} \hfill \cr A{l^{3 + }} \hfill \cr} \right. \Rightarrow {{2a + 1,56}\over {78}}.3 + 2y = 0,28\,(2)\) + Xét đểm 0,48 mol \(\left\{ \matrix{Al{(OH)_3}:{a \over {78}} \hfill \cr Al{O_2}^ - :(2x - {a \over {78}}) \hfill \cr} \right. \Rightarrow 3{a \over {78}} + 4(2x - {a \over {78}}) + 2y = 0,48\,(3)\) \(\buildrel {(1)\,(2)\,(3)} \over
Câu 38 :
Hỗn hợp X gồm Al và Al2O3. Cho m gam hỗn hợp X tác dụng với dung dịch NaOH vừa đủ thu được 1,344 lít H2 (đktc) và dung dịch Y. Cho dung dịch Y tác dụng với dung dịch HCl dư thu được dung dịch Z chứa 26,88 gam muối. Phần trăm khối lượng Al trong hỗn hợp X gần nhất với
Đáp án : D Lời giải chi tiết :
nH2 = 0,06 mol - Khi cho X tác dụng với NaOH vừa đủ: BTe: 3nAl = 2nH2 => nAl = 2/3.nH2 = 0,04 mol Đặt nAl2O3 = a mol BTNT "Al": nNaAlO2 = nAl + 2nAl2O3 = 2a + 0,04 (mol) - Khi cho dd Y phản ứng với HCl dư thì muối gồm: Al3+ (2a + 0,04); Na+ (2a + 0,04) và Cl- BTĐT: nCl- = 3nAl3+ + nNa+ = 4(2a + 0,04) (mol) => m muối = mAl3+ + mNa+ + mCl- => 27(2a + 0,04) + 23(2a + 0,04) + 35,5.4.(2a + 0,04) = 26,88 => a = 0,05 => %mAl = (0,04.27)/(0,04.27 + 0,05.102) = 17,48% gần nhất với 17,5%
Câu 39 :
Cho phản ứng sau: Al + H2O + NaOH → NaAlO2 + 1,5H2. Chất nào đóng vai trò là chất oxi hóa:
Đáp án : C Phương pháp giải :
Chất oxi hóa là chất nhận electron (số oxi hóa giảm) trong phản ứng oxi hóa - khử. Lời giải chi tiết :
Thực chất quá trình phản ứng là: Al tác dụng với H2O tạo ra Al(OH)3 và H2. Sau đó Al(OH)3 phản ứng với NaOH. Như vậy H+ của H2O đã nhận electron để tạo H2.
Kali alum là muối sulfat kép của kali và nhôm, tên Việt Nam gọi là “phèn chua”. Công thức hóa học của nó là KAl(SO4)2 và thông thường được tìm thấy ở dạng ngậm nước là KAl(SO4)2.12H2O. Phèn chua đó là loại muối có tinh thể to nhỏ không đều, không màu hoặc trắng, cũng có thể trong hoặc hơi đục.
Câu 40
Hòa tan hoàn toàn 94,8 gam phèn chua KAl(SO4)2.12H2O vào nước thu được dung dịch X. Cho toàn bộ X tác dụng với 350ml dung dịch chứa Ba(OH)2 0,5M và NaOH 1M, sau khi các phản ứng xảy ra hoàn toàn thu được m gam kết tủa. Giá trị của m là
Đáp án : D Phương pháp giải :
Bước 1: Tính số mol Al3+, SO42- Từ số mol phèn chua ⟹ số mol Al3+, SO42-. Bước 2: Tính số mol Ba2+ và số mol OH- Từ số mol Ba(OH)2 và số mol NaOH ⟹ số mol Ba2+ và số mol OH-. Bước 3: Xác định kết tủa thu được - Kết tủa thu được chắc chắn có BaSO4 - So sánh số mol nAl3+ và nOH- để xác định có kết tủa Al(OH)3 hay không? Xem lại bài tập phản ứng của muối nhôm với dd kiềm – ID 144 Bước 4: Tính m Lời giải chi tiết :
Bước 1: Tính số mol Al3+, SO42- Ta có: nKAl(SO4)2.12H2O = 94,8/474 = 0,2 (mol) ⟹ nAl3+ = nKAl(SO4)2.12H2O = 0,2 (mol) ⟹ nSO42- = 2.nKAl(SO4)2.12H2O = 0,4 (mol) Bước 2: Tính số mol Ba2+ và số mol OH- Ta có: nBa(OH)2 = 0,35.0,5 = 0,175 mol; nNaOH = 0,35.1 = 0,35 mol ⟹ nBa2+ = nBa(OH)2 = 0,175 (mol) ⟹ nOH- = 2.nBa(OH)2 + nNaOH = 0,7 (mol). Bước 3: Xác định kết tủa thu được Al3+ + 3OH- ⟶ Al(OH)3↓ Al(OH)3 + OH- ⟶ AlO2- + 2H2O Nhận thấy 3.nAl3+ < nOH- < 4.nAl3+ ⟹ Kết tủa Al(OH)3 bị hòa tan một phần. ⟹ nAl(OH)3 = 4.nAl3+ - nOH- = 4. 0,2 - 0,7 = 0,1 (mol) Ba2+ + SO42- → BaSO4↓ 0,175 → 0,175 (mol) Bước 4: Tính m Kết tủa thu được gồm 0,175 mol BaSO4 và 0,1 mol Al(OH)3. ⟹ m = mBaSO4 + mAl(OH)3 = 48,575 (gam). Câu 41
Ở miền Trung thường xuyên bị mưa bão khiến nguồn nước sinh hoạt của người dân sẽ bị đục và ảnh hưởng đến chất lượng. Người dân thường dùng phèn chua làm trong nước sinh hoạt để sử dụng. Phương trình hóa học giải thích cho việc làm đó là
Đáp án : A Phương pháp giải :
Khi tan trong nước, phèn chua bị thủy phân tạo thành ion Al3+. Lời giải chi tiết :
Người dân sử dụng phèn chua để làm trong nước vì khi tan trong nước, phèn chua bị thủy phân và tạo thành Al(OH)3 ở dạng kết tủa keo lơ lửng trong nước. Những hạt kết tủa keo này sẽ kết dính với các hạt bụi bẩn, hạt đất nhỏ để trở thành hạt đất to hơn, nặng hơn và lắng xuống. Vì vậy mà nước trở nên trong hơn. PTHH: Al3+ + 3H2O → Al(OH)3↓ + 3H+. Câu 42
Phèn chua được sử dụng trong công nghiệp nhuộm vải vì sinh ra tác nhân X bị vải hấp thụ giữ chặt trên bề mặt sẽ kết hợp với phẩm nhuộm tạo nên màu bền. X là chất hay ion nào sau đây?
Đáp án : B Lời giải chi tiết :
Phèn chua được sử dụng trong công nghiệp nhuộm vải vì sinh ra tác nhân Al(OH)3 do Al3+ thủy phân sinh ra được sợi vải hấp thụ và giữ chặt trên bề mặt sẽ kết hợp với phẩm nhuộm tạo thành màu bền. PTHH: Al3+ + 3H2O → Al(OH)3↓ + 3H+.
|
























Danh sách bình luận