Trắc nghiệm Bài 9. Đốt cháy amin - Hóa 12Đề bài
Câu 1 :
Đốt cháy 1 amin A thu được ${{n}_{{{H}_{2}}O}}-{{n}_{C{{O}_{2}}}}=1,5{{n}_{a\min }}$ thì amin đó là
Câu 2 :
Khi đốt cháy a mol amin X no, mạch hở ta thu được x mol CO2; y mol H2O; z mol N2. Biểu thức đúng là
Câu 3 :
Đốt cháy hoàn toàn 1 amin no, mạch hở, đơn chức X bằng một lượng khí oxi vừa đủ, thu được 8,96 lít khí CO2 và 9,9 gam H2O. CTPT của X là
Câu 4 :
Khi đốt cháy hoàn toàn một amin đơn chức X, thu được 16,8 lít khí CO2; 2,8 lít khí N2 (các thể tích khí đo ở điều kiện tiêu chuẩn) và 20,25 gam H2O. CTPT của X là
Câu 5 :
Đốt cháy một hỗn hợp amin A cần V lít O2 (đktc) thu được N2 và 31,68 gam CO2 và 7,56 gam H2O. Giá trị V là
Câu 6 :
Đốt cháy hoàn toàn m gam một amin X bằng lượng không khí vừa đủ thu được 17,6 gam CO2, 12,6 gam H2O và 69,44 lít N2 (đktc). Giả thiết không khí chỉ gồm N2 và O2 trong đó oxi chiếm 20% thể tích không khí. X có công thức là :
Câu 7 :
Đốt cháy hoàn toàn amin X bằng oxi vừa đủ, dẫn toàn bộ sản phẩm qua bình chứa dungdịch Ca(OH)2 dư thấy có 4 gam kết tủa và khối lượng bình tăng 3,2 gam và có 0,448 lít khí (đktc) thoát ra khỏi bình. X có CTPT là
Câu 8 :
Đốt cháy hoàn toàn 6,2 gam một amin no, mạch hở đơn chức cần dùng 10,08 lít khí O2 (đktc). CTPT của amin là
Câu 9 :
Đốt cháy hoàn toàn hỗn hợp hai amin no, đơn chức, là đồng đẳng liên tiếp, thu được 2,24 lít khí CO2 (đktc) và 3,6 gam H2O. Công thức phân tử của 2 amin là :
Câu 10 :
Có hai amin bậc một gồm A (đồng đẳng của anilin) và B (đồng đẳng của metylamin). Đốt cháy hoàn toàn 3,21 gam amin A sinh ra khí CO2, hơi H2O và 336 cm3 khí N2 (đktc). Khi đốt cháy amin B thấy ${{V}_{C{{O}_{2}}}}:{{V}_{{{H}_{2}}O}}=2:3$. Biết rằng tên của A có tiếp đầu ngữ “para”. Công thức cấu tạo của A, B lần lượt là :
Câu 11 :
Hỗn hợp X gồm ba amin đơn chức là đồng đẳng kế tiếp nhau. Đốt cháy hoàn toàn 11,8 gam X thu được 16,2 gam H2O, 13,44 lít CO2 (đktc) và V lít khí N2 (đktc). Ba amin trên có công thức phân tử lần lượt là :
Câu 12 :
Hỗn hợp X gồm O2 và O3 có tỉ khối so với H2 là 22. Hỗn hợp khí Y gồm metylamin và etylamin có tỉ khối so với H2 là 17,833. Để đốt cháy hoàn toàn V1 lít Y cần vừa đủ V2 lít X (biết sản phẩm cháy gồm CO2, H2O và N2, các chất khí khi đo ở cùng điều kiện nhiệt độ, áp suất). Tỉ lệ V1 : V2 là :
Câu 13 :
Đốt cháy hoàn toàn hỗn hợp 2 amin no, đơn chức, bậc 1, là đồng đẳng kế tiếp nhau, thu được CO2 và H2O với tỉ lệ số mol là: ${n_{C{O_2}}}:{n_{{H_2}O}}$= 7 : 10. Hai amin trên là:
Câu 14 :
Đốt cháy hết 6,72 lít hỗn hợp khí (đktc) X gồm 2 amin đơn chức, bậc một A và B là đồng đẳng kế tiếp. Cho hỗn hợp khí và hơi sau khi đốt cháy lần lượt qua bình 1 đựng H2SO4 đặc, bình 2 đựng KOH dư, thấy khối lượng bình 2 tăng 21,12 gam. Tên gọi của 2 amin là :
Câu 15 :
Đốt cháy hoàn toàn 7,6 gam hỗn hợp X gồm 2 amin no, đơn chức , mạch hở bằng không khí, sau đó cho hỗn hợp qua NaOH dư thấy khối lượng dung dịch tăng 24 gam và thấy thoát ra V lít khí hỗn hợp Y(đktc) gồm 2 khí có tỉ lệ mol là 1:9. Giá trị của V là
Câu 16 :
Khi đốt cháy một trong các chất là đồng đẳng của metylamin thì tỉ lệ thể tích ${{V}_{C{{O}_{2}}}}:{{V}_{{{H}_{2}}O}}$ = a biến đổi như thế nào ?
Câu 17 :
Hỗn hợp M gồm một anken và hai amin no, đơn chức, mạch hở X và Y là đồng đẳng kế tiếp (MX< MY). Đốt cháy hoàn toàn một lượng M cần dùng 4,536 lít O2 (đktc) thu được H2O, N2 và 2,24 lít CO2 (đktc). Chất Y là
Câu 18 :
Đốt cháy hoàn toàn 12,95 gam hỗn hợp A (gồm amin no, mạch hở X và ankan Y) bằng oxi vừa đủ. Sau phản ứng thu được m gam H2O; 19,04 lít CO2 và 0,56 lít khí N2 (đktc). Giá trị của m là
Câu 19 :
Đốt cháy 50 ml hỗn hợp khí X gồm trimetylamin và 2 hiđrocacbon là đồng đẳng liên tiếp bằng oxi vừa đủ, thu được 375 ml hỗn hợp khí và hơi Y. Cho Y đi qua H2SO4 đặc dư thì còn lại 175 ml, các thể tích khí đo ở cùng điều kiện. CTPT của 2 hiđrocacbon là
Câu 20 :
Đốt cháy hoàn toàn hỗn hợp X gồm 1 amin no, mạch hở, đơn chức và 1 ancol no, mạch hở, đơn chức bằng 151,2 lít không khí (vừa đủ) thu được 17,92 lít khí CO2; 21,6 gam H2O; 123,2 lít khí N2 (các thể tích khí đo ở đktc). CTPT của ancol và amin là
Câu 21 :
Hỗn hợp X chứa 1 amin no mạch hở đơn chức, 1 ankan, 1 anken. Đốt cháy hoàn toàn 0,4 mol X cần dùng vừa đủ 1,03 mol O2. Sản phẩm cháy thu được có chứa 0,56 mol CO2 và 0,06 mol N2. Phần trăm khối lượng của anken có trong X gần nhất với :
Câu 22 :
Đốt cháy hòa toàn hỗn hợp hai amin no, đơn chức, kế tiếp nhau trong dãy đồng đẳng, thu được 1,568 lít khí CO2 (đktc) và 1,8 gam H2O. Số đồng phân cấu tạo thuộc loại amin bậc hai của hai amin đó là:
Câu 23 :
Đốt cháy hoàn toàn m gam C2H5NH2 thu được sản phẩm gồm H2O, CO2 và 1,12 lít khí N2 (đktc). Giá trị của m là
Câu 24 :
13,35 gam hỗn hợp X gồm 2 amin no đơn chức mạch hở đồng đẳng kế tiếp tác dụng với dung dịch HCl vừa đủ thu được dung dịch chứa 22,475 gam muối . Nếu đốt 13,35 gam hỗn hợp X thì trong sản phẩm cháy có VCO2/VH2O bằng
Câu 25 :
Đốt cháy hoàn toàn 6,2 gam metylamin rồi cho sản phẩm cháy qua dung dịch Ca(OH)2 dư. Khối lượng bình đựng dung dịch Ca(OH)2 tăng là
Câu 26 :
Đốt cháy hoàn toàn m gam 1 amin no đơn chức mạch hở người ta thu được 6,72 lít khí CO2 (đktc); 9,45 gam H2O và 1,68 lít khí N2 (đktc). Giá trị của m là:
Câu 27 :
Đốt cháy hoàn toàn hỗn hợp M gồm hai amin no, đơn chức, mạch hở X và Y (có số mol bằng nhau, MX < MY) cần lượng vừa đủ 13,44 lít O2, thu được H2O, N2 và 6,72 lít CO2. Chất Y là:
Câu 28 :
Đốt cháy hoàn toàn 1 amin no đơn chức bậc 2 mạch hở thu được tỉ lệ mol CO2 và H2O là 4 : 7. Tên của amin là:
Câu 29 :
Hỗn hợp khí E gồm một amin bậc III no, đơn chức, mạch hở và hai ankin X, Y (MX< MY). Đốt cháy hoàn toàn 0,15 mol hỗn hợp E cần dùng 11,2 lít O2 (đktc), thu được hỗn hợp F gồm CO2, H2O và N2. Dẫn toàn bộ F qua bình đựng dung dịch KOH đặc, dư đến phản ứng hoàn toàn thấy khối lượng bình bazơ nặng thêm 20,8 gam. Số cặp công thức cấu tạo ankin X, Y thỏa mãn là
Câu 30 :
Hỗn hợp X chứa etylamin và trimetylamin. Hỗn hợp Y chứa 2 hiđrocacbon mạch hở có số liên kết pi nhở hơn 3. Trộn X và Y theo tỉ lệ mol nX : nY = 1:5 thu được hỗn hợp Z. Đốt cháy hoàn toàn 3,17 gam hỗn hợp Z cần dùng vừa đủ 7,0 lít khí oxi (đktc), sản phẩm cháy gồm CO2, H2O và N2 được dẫn qua dung dịch NaOH đặc, dư thấy khối lượng dung dịch tăng 12,89 gam. Phần trăm khối lượng của etylamin trong X gần nhất với giá trị nào sau đây?
Câu 31 :
Cho 1,22 gam hỗn hợp X gồm hai amin bậc một (tỉ lệ mol là 1:2) tác dụng vừa đủ với 400 ml dung dịch HCl 0,1M thu được dung dịch Y. Mặt khác, khi đốt cháy hoàn toàn 0,09 mol hỗn hợp X thu được hỗn hợp khí và hơi. Dẫn toàn bộ hỗn hợp khí và hơi đó vào dung dịch Ba(OH)2 dư, lạnh thì thu được m gam kết tủa và thoát ra 1,344 lít (đktc) một khí duy nhất. Giá trị của m là
Câu 32 :
Hỗn hợp E chứa axetilen, propin và một amin no, đơn chức, mạch hở. Đốt cháy hoàn toàn 5,46 gam hỗn hợp E cần dùng 11,088 lít O2 (đktc) thu được hỗn hợp F gồm CO2, H2O và khí N2, trong đó tỉ lệ mol CO2: H2O là 1:1. Phân tử khối của amin là
Lời giải và đáp án
Câu 1 :
Đốt cháy 1 amin A thu được ${{n}_{{{H}_{2}}O}}-{{n}_{C{{O}_{2}}}}=1,5{{n}_{a\min }}$ thì amin đó là
Đáp án : C Lời giải chi tiết :
Đốt cháy 1 amin A thu được ${{n}_{{{H}_{2}}O}}-{{n}_{C{{O}_{2}}}}=1,5{{n}_{a\min }}$ thì amin đó là amin no, đơn chức, mạch hở
Câu 2 :
Khi đốt cháy a mol amin X no, mạch hở ta thu được x mol CO2; y mol H2O; z mol N2. Biểu thức đúng là
Đáp án : A Phương pháp giải :
Bảo toàn nguyên tố : ${{n}_{C}}=\text{ }{{n}_{C{{O}_{2}}}};~~{{n}_{H}}=\text{ }2{{n}_{{{H}_{2}}O}};~~{{n}_{N}}=\text{ }2{{n}_{{{N}_{2}}}}$ Lời giải chi tiết :
Amin X no, mạch hở có CTPT dạng CnH2n+2+kNk (k là số chức amin) Bảo toàn nguyên tố ta có : \({n_{C{O_2}}} = {n_C}\,\, \to \,\,x = \,na (mol)\) \({n_{{H_2}O}} = \dfrac{{{n_H}}}{2}\,\, \to \,\,y = \,na + a + a. \dfrac{k}{2}\,\,\,mol;\,\) \({n_{{N_2}}} = \dfrac{{{n_N}}}{2} \to \,\,\,z = a. \dfrac{k}{2}\,\,mol\) → y = x + a + z hay a = y – x – z
Câu 3 :
Đốt cháy hoàn toàn 1 amin no, mạch hở, đơn chức X bằng một lượng khí oxi vừa đủ, thu được 8,96 lít khí CO2 và 9,9 gam H2O. CTPT của X là
Đáp án : B Phương pháp giải :
- Đốt amin no, đơn chức, mạch hở: n amin = (nH2O – nCO2)/1,5 - Bảo toàn nguyên tố: nC = nCO2; nH = 2nH2O - Số C = nCO2/namin, số H = 2nH2O/namin Lời giải chi tiết :
Cách 1: lập tỉ lệ nc : nH Theo giả thiết ta có \({n_C} = {n_{C{O_2}}} = \dfrac{{8,96}}{{22,4}} = 0,4\,\,mol;\,\,{n_H} = 2.{n_{{H_2}O}} = 2.\dfrac{{9,9}}{{18}} = 1,1\,\,mol;\,\,\) → nC : nH = 0,4 : 1,1 = 4 : 11 Dựa vào đáp án → CTPT của amin là C4H11N Cách 2: Vì amin no, mạch hở, đơn chức nên \({n_{{H_2}O}} - {n_{C{O_2}}} = 1,5{n_{a\min }}\) \( \to {n_{a\min }} = \dfrac{{{n_{{H_2}O}} - {n_{C{O_2}}}}}{{1,5}} = \dfrac{{0,55 - 0,4}}{{1,5}} = 0,1\,\,mol\) → Số C trong amin =\(\dfrac{{{n_{C{O_2}}}}}{{{n_X}}} = \dfrac{{0,4}}{{0,1}} = 4\) Số H trong amin = \(\frac{{2{n_{{H_2}O}}}}{{{n_X}}} = \dfrac{{0,55.2}}{{0,1}} = 11\). Vậy CTPT của X là C4H11N
Câu 4 :
Khi đốt cháy hoàn toàn một amin đơn chức X, thu được 16,8 lít khí CO2; 2,8 lít khí N2 (các thể tích khí đo ở điều kiện tiêu chuẩn) và 20,25 gam H2O. CTPT của X là
Đáp án : D Phương pháp giải :
nC = nCO2 nH = 2nH2O nN = 2nN2 Amin đơn chức => n amin = nN => Số C = nCO2/namin, số H = 2nH2O/namin Lời giải chi tiết :
Cách 1 : lập tỉ lệ mol nC : nH : nN Theo giả thiết ta có : \(\begin{array}{l}{n_C} = {n_{C{O_2}}} = \dfrac{{16,8}}{{22,4}} = 0,75\,\,mol;\,\,{n_H} = 2.{n_{{H_2}O}} = 2.\dfrac{{20,25}}{{18}} = 2,25\,\,mol;\,\,\\{n_N} = 2.{n_{{N_2}}} = 2.\dfrac{{2,8}}{{22,4}} = 0,25\,\,mol.\end{array}\) \( \Rightarrow {n_C}:{n_H}:{n_N} = 0,75:2,25:0,25 = 3:9:1\) Vậy CTPT của X là C3H9N. Cách 2 : bảo toàn nguyên tố N : \({n_X} = {n_N} = 2{n_{{N_2}}}\) Đối với các amin đơn chức thì phân tử có một nguyên tử N : Bảo toàn nguyên tử N : \({n_X} = {n_N} = 2{n_{{N_2}}} = 0,25\,\,mol\) → Số C trong amin =\(\dfrac{{{n_{C{O_2}}}}}{{{n_X}}} = \dfrac{{0,75}}{{0,25}} = 3\); Số H trong amin = \(\dfrac{{2{n_{{H_2}O}}}}{{{n_X}}} = \dfrac{{2,25}}{{0,25}} = 9\) Vậy CTPT của X là C3H9N
Câu 5 :
Đốt cháy một hỗn hợp amin A cần V lít O2 (đktc) thu được N2 và 31,68 gam CO2 và 7,56 gam H2O. Giá trị V là
Đáp án : C Phương pháp giải :
Bảo toàn nguyên tử oxi ta có : $2{n_{{O_2}}} = 2{n_{C{O_2}}} + {n_{{H_2}O}}$ Lời giải chi tiết :
\({n_{C{O_2}}} = \dfrac{{31,68}}{{44}} = 0,72\,\,mol;\,\,\,{n_{{H_2}O}} = \dfrac{{7,56}}{{18}}\)= 0,42 mol Bảo toàn nguyên tử oxi ta có :\(2{n_{{O_2}}} = 2{n_{C{O_2}}} + {n_{{H_2}O}} \to \,\,{n_{{O_2}}} = \dfrac{{2{n_{C{O_2}}} + {n_{{H_2}O}}}}{2} = \dfrac{{2.0,72 + 0,42}}{2} = 0,93\,\,mol\) \(\to \,\,{V_{{O_2}}} = 22,4.0,93 = 20,832\) lít
Câu 6 :
Đốt cháy hoàn toàn m gam một amin X bằng lượng không khí vừa đủ thu được 17,6 gam CO2, 12,6 gam H2O và 69,44 lít N2 (đktc). Giả thiết không khí chỉ gồm N2 và O2 trong đó oxi chiếm 20% thể tích không khí. X có công thức là :
Đáp án : A Phương pháp giải :
- Bảo toàn nguyên tố O:\({n_{{O_2}}} = {n_{C{O_2}}} + \dfrac{{{n_{{H_2}O}}}}{2}\)=>\({n_{{N_2}(kk)}} = 4.{n_{{O_2}(p/u)}}\) - Đốt amin ngoài không khí: nN2 sau phản ứng = nN2 sinh ra từ phản ứng đốt cháy amin + nN2 có sẵn trong không khí - nC = nCO2; nH = 2nH2O; nN = 2nN2 => nC : nH : nN => CTPT Lời giải chi tiết :
\({n_C} = {n_{C{O_2}}} = \dfrac{{17,6}}{{44}} = 0,4\,\,mol;\,\,{n_H} = 2.{n_{{H_2}O}} = 2.\dfrac{{12,6}}{{18}} = 1,4\,\,mol\). Áp dụng định luật bảo toàn nguyên tố đối với oxi suy ra : \({n_{{O_2}\,(kk)}} = \dfrac{{2.{n_{C{O_2}}} + {n_{{H_2}O}}}}{2} = 0,75\,\,mol \Rightarrow {n_{{N_2}\,(kk)}} = 0,75.4 = 3\,\,mol.\,\)\( \to \,\,{n_{N\,(hchc)}} = 2.(\dfrac{{69,44}}{{22,4}} - 3) = 0,2\,mol\, \Rightarrow {n_C}:{n_H}:{n_N} = 0,4:1,4:0,2 = 2:7:1.\) Căn cứ vào các phương án ta thấy công thức của X là C2H5NH2.
Câu 7 :
Đốt cháy hoàn toàn amin X bằng oxi vừa đủ, dẫn toàn bộ sản phẩm qua bình chứa dungdịch Ca(OH)2 dư thấy có 4 gam kết tủa và khối lượng bình tăng 3,2 gam và có 0,448 lít khí (đktc) thoát ra khỏi bình. X có CTPT là
Đáp án : A Phương pháp giải :
- nN trong X = 2nN2 - nCO2 = n kết tủa, m bình tăng = mCO2 + mH2O - Sử dụng định luật bảo toàn nguyên tố và lập tỉ lệ nC : nH : nN Lời giải chi tiết :
Nito không bị hấp thụ bởi Ca(OH)2 => khí thoát ra khỏi bình là khí N2 Bảo toàn nguyên tử N : \({n_{N\,\,(trong\,\,X)}} = 2{n_{{N_2}}} = \frac{{0,448}}{{22,4}}\, = 0,02\,mol\) mkết tủa = \({m_{CaC{{\rm{O}}_3}}} = \dfrac{4}{{100}} = 0,04\,\,mol\,\, \to \,\,{n_{C{O_2}}} = 0,04\,\,mol\) mbình tăng = \({m_{C{O_2}}} + {m_{{H_2}O}} = 3,2\,\,gam\,\, \to \,\,{m_{{H_2}O}} = 3,2 - 0,04.44 = 1,44\,\,gam\,\, \to \,\,{n_{{H_2}O}} = 0,08\,\,mol\) → nC : nH : nN = 0,04 : 0,16 : 0,04 = 1 : 4 : 1 => CTĐGN của X là CH4N => CTPT của X là C2H8N2
Câu 8 :
Đốt cháy hoàn toàn 6,2 gam một amin no, mạch hở đơn chức cần dùng 10,08 lít khí O2 (đktc). CTPT của amin là
Đáp án : B Phương pháp giải :
- Gọi số mol của CO2, H2O và N2 - Bảo toàn nguyên tố oxi : $2{n_{C{O_2}}} + {n_{{H_2}O}} = 2{n_{{O_2}}}$ - Bảo toàn khối lượng : mamin = mC + mH + mO+ mN - Đốt cháy amin no, mạch hở, đơn chức thu được :${n_{{H_2}O}} - {n_{C{O_2}}} = 1,5{n_{a\min }}$ - Giải hệ phương trình Lời giải chi tiết :
\({n_{{O_2}}} = \dfrac{{10,08}}{{22,4}} = 0,45\,\,mol\) Gọi số mol của CO2, H2O và N2 lần lượt là a, b, c mol Bảo toàn nguyên tố oxi : \(2{n_{C{O_2}}} + {n_{{H_2}O}} = 2{n_{{O_2}}}\)→ 2a + b = 0,9 (1) Bảo toàn khối lượng : mamin = mC + mH + mN → 12a + 2b + 28c = 6,2 (2) Vì đốt cháy amin no, mạch hở, đơn chức nên ta có : \({n_{{H_2}O}} - {n_{C{O_2}}} = 1,5{n_{a\min }}\)và \({n_{{N_2}}} = \dfrac{1}{2}{n_{a\min }}\)→ \({n_{{H_2}O}} - {n_{C{O_2}}} = 3{n_{{N_2}}}\) → b – a = 3c (3) Từ (1), (2) và (3) → \(\left\{ \begin{array}{l}a = 0,2\\b = 0,5\\c = 0,1\end{array} \right.\) → nC : nH : nN = 0,2 : 0,5.2 : 0,1.2 = 1 : 5 : 1 → công thức phân tử của amin là CH3NH2
Câu 9 :
Đốt cháy hoàn toàn hỗn hợp hai amin no, đơn chức, là đồng đẳng liên tiếp, thu được 2,24 lít khí CO2 (đktc) và 3,6 gam H2O. Công thức phân tử của 2 amin là :
Đáp án : A Phương pháp giải :
gọi công thức phân tử trung bình Lời giải chi tiết :
Sơ đồ phản ứng : \(\begin{align}&\,\,\,\,\,\,\,\,\,\,\,\,\,{{C}_{\overline{n}}}{{H}_{2\overline{n}\,+\,3}}N\,\,\xrightarrow{{{O}_{2}},\,{{t}^{o}}}\,\,\overline{n}C{{O}_{2}}\,\,\,+\,\,\,\,\dfrac{2\overline{n}\,+3}{2}\,{{H}_{2}}O\,\,\,\,+\,\,\,\,\,\dfrac{1}{2}\,{{N}_{2}} \\ & mol:\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,0,1\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,0,2\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\, \\ \end{align}\) Ta có: \(0,2\overline{n}\,=\,0,1.\dfrac{2\overline{n}\,+\,3}{2}\,\Rightarrow \,\overline{n}\,=\,1,5.\) Vậy công thức phân tử của 2 amin là CH5N và C2H7N.
Câu 10 :
Có hai amin bậc một gồm A (đồng đẳng của anilin) và B (đồng đẳng của metylamin). Đốt cháy hoàn toàn 3,21 gam amin A sinh ra khí CO2, hơi H2O và 336 cm3 khí N2 (đktc). Khi đốt cháy amin B thấy ${{V}_{C{{O}_{2}}}}:{{V}_{{{H}_{2}}O}}=2:3$. Biết rằng tên của A có tiếp đầu ngữ “para”. Công thức cấu tạo của A, B lần lượt là :
Đáp án : B Phương pháp giải :
gọi công thức tổng quát của A là CnH2n-7NH2, B là CmH2m+1NH2 Bảo toàn nguyên tố N : \({{n}_{A}}\,=\,2.{{n}_{{{N}_{2}}}}\,\) Tính theo sơ đồ phản ứng : \({{C}_{m}}{{H}_{2m\,+\,1}}N{{H}_{2}}\,\,\xrightarrow{{{O}_{2}},\,{{t}^{o}}}\,\,mC{{O}_{2}}\,+\,\dfrac{m\,+3}{2}\,{{H}_{2}}O\,+\,\dfrac{1}{2}{{N}_{2}}\) Lời giải chi tiết :
A là đồng đẳng của anilin nên công thức của A là CnH2n-7NH2, (n ≥ 7, nguyên) B là đồng đẳng của metylamin nên công thức của B là CmH2m+1NH2, (m ≥ 2, nguyên). Ta có: \({{n}_{A}}=2.{{n}_{{{N}_{2}}}}=2.0,015=0,03\,mol\Rightarrow {{M}_{A}}=14n+9=\dfrac{3,21}{0,03}=107\,gam/mol\,\Rightarrow n=7.\) Sơ đồ phản ứng : \({{C}_{m}}{{H}_{2m+1}}N{{H}_{2}}\,\xrightarrow{{{O}_{2}},\,{{t}^{o}}}\,mC{{O}_{2}}+\dfrac{2m+3}{2}{{H}_{2}}O+\dfrac{1}{2}{{N}_{2}}\) \({{V}_{C{{O}_{2}}}}:{{V}_{{{H}_{2}}O}}=2:3\Rightarrow m=3\) CTCT phù hợp của A, B lần lượt là : 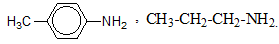
Câu 11 :
Hỗn hợp X gồm ba amin đơn chức là đồng đẳng kế tiếp nhau. Đốt cháy hoàn toàn 11,8 gam X thu được 16,2 gam H2O, 13,44 lít CO2 (đktc) và V lít khí N2 (đktc). Ba amin trên có công thức phân tử lần lượt là :
Đáp án : D Phương pháp giải :
nC = nCO2 nH = 2nH2O nN = 2nN2 lập tỉ lệ nC : nH : nN Lời giải chi tiết :
Theo giả thiết ta có: $\begin{array}{l}{n_{{H_2}O}} = 0,9\,\,mol\,\,;\,\,{n_{C{O_2}}} = 0,6\,\,mol\,\,;\,\,{n_N} = \frac{{11,8 - 0,9.2 - 0,6.12}}{{14}} = 0,2\,\,mol\\ \Rightarrow {n_C}:{n_H}:{n_N} = 0,6:1,8:0,2 = 3:9:1.\end{array}$ Vậy công thức phân tử trung bình của ba amin là C3H9N thuộc dạng CnH2n+3N, suy ra ba amin thuộc loại amin no đơn chức và phải có ít nhất một amin có số C lớn hơn 3.
Câu 12 :
Hỗn hợp X gồm O2 và O3 có tỉ khối so với H2 là 22. Hỗn hợp khí Y gồm metylamin và etylamin có tỉ khối so với H2 là 17,833. Để đốt cháy hoàn toàn V1 lít Y cần vừa đủ V2 lít X (biết sản phẩm cháy gồm CO2, H2O và N2, các chất khí khi đo ở cùng điều kiện nhiệt độ, áp suất). Tỉ lệ V1 : V2 là :
Đáp án : D Phương pháp giải :
Đặt CTPT trung bình của 2 amin là ${C_{\bar n}}{H_{2\bar n + 3}}N$ Quy đổi hỗn hợp O3, O2 thành O, bảo toàn khối lượng :${m_{\left( {{{\rm{O}}_{\rm{3}}},{\rm{ }}{{\rm{O}}_{\rm{2}}}} \right)}} = {m_O}$ Bảo toàn nguyên tố O : $2{n_{C{O_2}}} + {n_{{H_2}O}} = 2{n_{{O_2}}}$ Lời giải chi tiết :
Đặt CTPT trung bình của 2 amin là \({C_{\bar n}}{H_{2\bar n + 3}}N\). Theo giả thiết suy ra : \(14\bar n + 17 = 2.17,833 \Rightarrow \bar n = \frac{4}{3}\). Quy đổi hỗn hợp O3, O2 thành O, theo định luật bảo toàn khối lượng ta có . Sơ đồ phản ứng : \(2{{C}_{{\bar{n}}}}{{H}_{2\bar{n}+3}}N\xrightarrow{{{t}^{o}}}2\bar{n}C{{O}_{2}}+(2\bar{n}+3){{H}_{2}}O+{{N}_{2}}\,\,\,\,(1)\) mol : 1 \(\bar{n}\) \(\dfrac{2\bar{n}+3}{2}\) Theo (1) ta có : \({n_{O\,\,pu }} = 2\overline n + \dfrac{{2\overline n + 3}}{2} = 5,5\,\,mol \Rightarrow {m_{\left( {{{\rm{O}}_{\rm{3}}},{\rm{ }}{{\rm{O}}_{\rm{2}}}} \right)}} = {m_O} = 5,5.16 = 88\,\,gam \Rightarrow {n_{\left( {{{\rm{O}}_{\rm{3}}},{\rm{ }}{{\rm{O}}_{\rm{2}}}} \right)}} = \frac{{88}}{{2.22}} = 2\,\,mol.\) Vậy VY : VX = 1 : 2.
Câu 13 :
Đốt cháy hoàn toàn hỗn hợp 2 amin no, đơn chức, bậc 1, là đồng đẳng kế tiếp nhau, thu được CO2 và H2O với tỉ lệ số mol là: ${n_{C{O_2}}}:{n_{{H_2}O}}$= 7 : 10. Hai amin trên là:
Đáp án : C Phương pháp giải :
Gọi CTPT trung bình cho 2 amin là ${C_{\bar n}}{H_{2\bar n + 3}}N$ Bảo toàn nguyên tố : nC = nCO2; nH = 2nH2O Lời giải chi tiết :
Gọi CTPT trung bình cho 2 amin là \({C_{\bar n}}{H_{2\bar n + 3}}N\) Giả sử lấy 1 mol amin Bảo toàn nguyên tố C : \({n_{C{O_2}}} = \bar n\) Bảo toàn nguyên tố H : \({n_{{H_2}O}} = \dfrac{{2\bar n + 3}}{2}\) Vì \({n_{C{O_2}}}:{n_{{H_2}O}}\)= 7 : 10 → \(10\bar{n}~=\text{ 7}\text{.}\dfrac{2\bar{n}+3}{2}\Rightarrow \bar{n}=3,5\) → 2 amin là C3H7NH2 và C4H9NH2
Câu 14 :
Đốt cháy hết 6,72 lít hỗn hợp khí (đktc) X gồm 2 amin đơn chức, bậc một A và B là đồng đẳng kế tiếp. Cho hỗn hợp khí và hơi sau khi đốt cháy lần lượt qua bình 1 đựng H2SO4 đặc, bình 2 đựng KOH dư, thấy khối lượng bình 2 tăng 21,12 gam. Tên gọi của 2 amin là :
Đáp án : A Phương pháp giải :
Khối lượng bình 2 tăng là khối lượng của CO2 sử dụng \(\bar C = \dfrac{{{n_{C{O_2}}}}}{{{n_{a\min }}}}\) Lời giải chi tiết :
Khối lượng bình 2 tăng 21,12 gam \(\to {m_{C{O_2}}} = 21,12gam\,\, \to \,\,{n_{C{O_2}}} = 0,48\,\,mol\) namin = 0,3 mol \( \to \,\,\bar C = \dfrac{{{n_{C{O_2}}}}}{{{n_{a\min }}}} = \dfrac{{0,48}}{{0,3}} = 1,6\) Vậy 2 amin là CH3NH2 và C2H5NH2
Câu 15 :
Đốt cháy hoàn toàn 7,6 gam hỗn hợp X gồm 2 amin no, đơn chức , mạch hở bằng không khí, sau đó cho hỗn hợp qua NaOH dư thấy khối lượng dung dịch tăng 24 gam và thấy thoát ra V lít khí hỗn hợp Y(đktc) gồm 2 khí có tỉ lệ mol là 1:9. Giá trị của V là
Đáp án : B Phương pháp giải :
Đặt số mol của amin : x, trong không khí : O2 a mol, N2 4a mol BTKL ${m_X} + {m_{{O_2}}} = {m_{C{O_2}}} + {m_{{H_2}O}} + {m_{{N_2}}} \to {n_{{O_2}(p/u)}}$ Hỗn hợp Y gồm: ${n_{{O_2}}} = {\rm{a}} - {n_{{O_2}(p/u);}}\,\,\,\,{n_{{N_2}}} = 4{\rm{a}} + {n_{{N_2}(\sinh \,ra)}}\,$ ${n_{{O_2}}}:{n_{{N_2}}} = 1:9 \to a \to {n_Y} \to V$ Lời giải chi tiết :
CnH2n+3N $ \to $nCO2 + (n+1,5)H2O + 0,5 N2 x nx (n+1,5)x 0,5x Vì N2là khí trơ nên dung dịch NaOH chỉ hấp thụ CO2 và H2O => mdd tăng =${m_{C{O_2}}} + {m_{{H_2}O}} = 44n{\rm{x}} + 18x(n + 1,5) = \,\,(62n + 27)x = 24\,\,\,\,(1)$ mX=(14n+17)x =7,6 (2) Từ (1) và (2) =>$\left\{ \begin{array}{l}n{\rm{x}} = 0,3\\x = 0,2\end{array} \right. \to \left\{ \begin{array}{l}n = 1,5\\x = 0,2\end{array} \right.$ Theo định luật BTKL $\begin{array}{l}{m_X} + {m_{{O_2}}} = {m_{C{O_2}}} + {m_{{H_2}O}} + {m_{{N_2}}} \to 7,6 + 32.{n_{{O_2}}} = 24 + 2,8\\ \to {n_{{O_2}}} = 0,6\,\,mol\end{array}$ Trong không khí : O2 a mol, N2 4a mol Hỗn hợp Y gồm: ${n_{{O_2}}} = a - 0,6\,\,\,mol;\,\,\,\,{n_{{N_2}}} = 4a + 0,1\,\,\,mol$ $\begin{array}{l}{n_{{O_2}}}:{n_{{N_2}}} = 1:9 \to 9(a - 0,6) = 4{\rm{a}} + 0,1 \to a = 1,1\,mol\\{n_Y} = 1,1 - 0,6 + 4.1,1 + 0,1 = 5mol \to V = 22,4.5 = 112\,\,lit\end{array}$ Chú ý
Bỏ qua lượng N2 không khí trong hỗn hợp sản phẩm.
Câu 16 :
Khi đốt cháy một trong các chất là đồng đẳng của metylamin thì tỉ lệ thể tích ${{V}_{C{{O}_{2}}}}:{{V}_{{{H}_{2}}O}}$ = a biến đổi như thế nào ?
Đáp án : C Phương pháp giải :
Biện luận theo giới hạn Công thức chung của ankylamin là CnH2n+3N (n\( \ge 1\) ) \(\dfrac{{{V_{C{O_2}}}}}{{{V_{{H_2}O}}}} = \dfrac{n}{{n + 1,5}}\) . Biện luận khi n=1 và\(n \to + \infty \,\,\) Lời giải chi tiết :
Công thức chung của ankylamin là CnH2n+3N (n\(\ge 1\) ) \(\dfrac{{{V_{C{O_2}}}}}{{{V_{{H_2}O}}}} = \dfrac{n}{{n + 1,5}}\) Khi n=1 => a =0,4 Khi \(n \to + \infty \,\, \Rightarrow a = 1\)
Câu 17 :
Hỗn hợp M gồm một anken và hai amin no, đơn chức, mạch hở X và Y là đồng đẳng kế tiếp (MX< MY). Đốt cháy hoàn toàn một lượng M cần dùng 4,536 lít O2 (đktc) thu được H2O, N2 và 2,24 lít CO2 (đktc). Chất Y là
Đáp án : C Phương pháp giải :
- Gọi CTPT của anken là CnH2n, CTPT trung bình của 2 amin là \({C_{\bar m}}{H_{2\bar m + 3}}\) - Sơ đồ phản ứng tổng quát :\(~{{C}_{n}}{{H}_{2n}}+\dfrac{3n}{2}{{O}_{2}}\to nC{{O}_{2}}+n{{H}_{2}}O\) \({C_{\bar m}}{H_{2\bar m + 3}}N + \dfrac{{6\bar m + 3}}{4}{O_2} \to \bar mC{O_2} + \dfrac{{2\bar m + 3}}{2}{H_2}O + \dfrac{1}{2}{N_2}\) - Lập hệ theo phương trình phản ứng Lời giải chi tiết :
Gọi CTPT của anken là CnH2n CTPT trung bình của 2 amin là \({C_{\bar m}}{H_{2\bar m + 3}}N\) PTHH : \(~{{C}_{n}}{{H}_{2n}}+\dfrac{3n}{2}{{O}_{2}}\to nC{{O}_{2}}+n{{H}_{2}}O\) a → \(\dfrac{{3na}}{2}\) → an \({C_{\bar m}}{H_{2\bar m + 3}}N + \dfrac{{6\bar m + 3}}{4}{O_2} \to \bar mC{O_2} + \dfrac{{2\bar m + 3}}{2}{H_2}O + \dfrac{1}{2}{N_2}\) b → \(\dfrac{{(6\bar m + 3)b}}{2}\) → \(b\bar m\) \(\left\{ \begin{array}{l}{n_{C{O_2}}} = 0,1 = an + b \bar m\\0,2025 = \dfrac{{3an}}{2} + \dfrac{{(6\bar m + 3)b}}{4}\end{array} \right. \Rightarrow b = 0,07\,\, \Rightarrow \,\,an + 0,07\bar m = 0,1\,\, \Rightarrow \,\,\bar m < 2\) → 2 amin là CH5N và C2H7N
Câu 18 :
Đốt cháy hoàn toàn 12,95 gam hỗn hợp A (gồm amin no, mạch hở X và ankan Y) bằng oxi vừa đủ. Sau phản ứng thu được m gam H2O; 19,04 lít CO2 và 0,56 lít khí N2 (đktc). Giá trị của m là
Đáp án : B Phương pháp giải :
Bảo toàn nguyên tố : nC = nCO2; nH = 2nH2O; nN = 2nN2 - Bảo toàn khối lượng : mhhA = mC + mH + mN Lời giải chi tiết :
\({n_{C{O_2}}} = \dfrac{{19,05}}{{22,4}} = 0,85\,\,mol;\,\,{n_{{N_2}}} = \dfrac{{0,56}}{{22,4}} = 0,025\,\,mol\) Bảo toàn khối lượng : mhhA = mC + mH + mN → 0,85.12 + mH + 0,025.2.14 = 12,95 → nH = 2,05 mol \( \to \,\,{n_{{H_2}O}} = \dfrac{{{n_H}}}{2} = 1,025\,\,mol\,\, \to \,\,{m_{{H_2}O}} = 18,45\,\,gam\)
Câu 19 :
Đốt cháy 50 ml hỗn hợp khí X gồm trimetylamin và 2 hiđrocacbon là đồng đẳng liên tiếp bằng oxi vừa đủ, thu được 375 ml hỗn hợp khí và hơi Y. Cho Y đi qua H2SO4 đặc dư thì còn lại 175 ml, các thể tích khí đo ở cùng điều kiện. CTPT của 2 hiđrocacbon là
Đáp án : C Phương pháp giải :
- đốt cháy amin no, mạch hở, đơn chức thì : ${n_{{H_2}O}} - {n_{C{O_2}}} - {n_{{N_2}}} = {n_{a\min }}$ - đốt cháy ankan thu được ${n_{{H_2}O}} - {n_{C{O_2}}} = {n_{ankan}}$→ đốt cháy hỗn hợp ankan + amin : ${n_{{H_2}O}} - {n_{C{O_2}}} - {n_{{N_2}}}$= nhỗn hợp - đốt cháy anken thu được ${n_{{H_2}O}} = {n_{C{O_2}}}$→ đốt cháy hỗn hợp anken + amin : ${n_{{H_2}O}} - {n_{C{O_2}}} - {n_{{N_2}}}$= namin - Đặt công thức chung của 2 anken là ${C_{\bar n}}{H_{2\bar n}}$ - Bảo toàn nguyên tố : nC = nCO2; nN = 2nN2 Lời giải chi tiết :
Ta có :\({V_{{H_2}O}}\)= 375 – 175 = 200 ml; \({V_{C{O_2}}} + {V_{{N_2}}} = 175\,\,ml\) \({V_{{H_2}O}} - {V_{C{O_2}}} - {V_{{N_2}}} = 25\,\,ml\, = \,\,\dfrac{1}{2}\)nhỗn hợp → 2 hiđrocacbon chỉ có thể là anken và Vamin = Vanken = 25 ml Đặt công thức chung của 2 anken là \({C_{\bar n}}{H_{2\bar n + 2}}\) \(\begin{array}{l}{V_{C{O_2}}} = 25\bar n + 3.25 = 25\bar n + 75;\,\,\,\,\,\,\,{V_{{N_2}}} = 0,5.25 = 12,5\\ \to \,\,\,25\bar n + 75 + 12,5 = 175\,\, \to \,\,\bar n = 3,5\end{array}\) Vậy 2 hiđrocacbon là C3H6 và C4H8
Câu 20 :
Đốt cháy hoàn toàn hỗn hợp X gồm 1 amin no, mạch hở, đơn chức và 1 ancol no, mạch hở, đơn chức bằng 151,2 lít không khí (vừa đủ) thu được 17,92 lít khí CO2; 21,6 gam H2O; 123,2 lít khí N2 (các thể tích khí đo ở đktc). CTPT của ancol và amin là
Đáp án : B Phương pháp giải :
Gọi CTPT của ancol là CmH2m+2O; CTPT của amin là CnH2n+3N Bảo toàn nguyên tố N : \({n_{{C_n}{H_{2n + 3}}N}} = 2{n_{{N_2}}}\) Bảo toàn nguyên tố O : \({n_{{C_m}{H_{2m + 2}}O}} = 2{n_{C{O_2}}} + {n_{{H_2}O}} - 2{n_{{O_2}}}\) Bảo toàn nguyên tố C : \({n_{C{O_2}}} = n.{n_{{C_n}{H_{2n + 3}}N}} + m.{n_{{C_m}{H_{2m + 2}}O}}\) Lời giải chi tiết :
\({n_{C{O_2}}} = \dfrac{{17,92}}{{22,4}} = 0,8\,\,mol;\,\,{n_{{H_2}O}} = \dfrac{{21,6}}{{18}} = 1,2\,\,mol;\,\,{n_{{N_2}}} = \dfrac{{123,2}}{{22,4}} = 5,5\,\,mol\) Gọi CTPT của ancol là CmH2m+2O; CTPT của amin là CnH2n+3N nkhông khí = 6,75 mol \( \to \,\,{n_{{O_2}}} = \dfrac{{6,75}}{5} = 1,35\,\,mol;\,\,{n_{{N_2}(kk)}} = 6,75 - 1,35 = 5,4\,\,mol\) \(\to {n_{{N_2}}}\)sinh ra do amin cháy = \({n_{{N_2}}}\)thu được - \({n_{{N_2}(KK)}}\)= 5,5 – 5,4 = 0,1 mol Bảo toàn nguyên tố N : \({n_{{C_n}{H_{2n + 3}}N}} = 2{n_{{N_2}}}\)= 0,2 mol Bảo toàn nguyên tố O : \({n_{{C_m}{H_{2m + 2}}O}} = 2{n_{C{O_2}}} + {n_{{H_2}O}} - 2{n_{{O_2}}} = 2.0,8 + 1,2 - 2.1,35 = 0,1\,\,mol\) Bảo toàn nguyên tố C : \({n_{C{O_2}}} = n.{n_{{C_n}{H_{2n + 3}}N}} + m.{n_{{C_m}{H_{2m + 2}}O}}\) → 0,2n + 0,1m = 0,8 → 2n + m = 8 → m = 2 và n = 3 phù hợp với đáp án Vậy CTPT của ancol và amin là C2H6O vàC3H9N
Câu 21 :
Hỗn hợp X chứa 1 amin no mạch hở đơn chức, 1 ankan, 1 anken. Đốt cháy hoàn toàn 0,4 mol X cần dùng vừa đủ 1,03 mol O2. Sản phẩm cháy thu được có chứa 0,56 mol CO2 và 0,06 mol N2. Phần trăm khối lượng của anken có trong X gần nhất với :
Đáp án : D Phương pháp giải :
Sử dụng phương pháp bảo toàn nguyên tố O và C, bên cạnh đó khảo sát phương trình đốt cháy Lời giải chi tiết :
namin = 0,12 mol ; nX = 0,4 mol Bảo toàn oxi : 2nO2 = 2nCO2 + nH2O => nH2O = 0,94 mol TQ : CnH2n+3N ; CmH2m+2 ; CtH2t => nH2O – nCO2 = 1,5namin + nankan => nankan = 0,2 mol => nanken = 0,08 mol Bảo toàn C : 0,12n + 0,2m + 0,08t = 0,56 => n = m = 1 ; t = 3 => CH5N ; CH4 ; C3H6 => %mC3H6 = 32,6%
Câu 22 :
Đốt cháy hòa toàn hỗn hợp hai amin no, đơn chức, kế tiếp nhau trong dãy đồng đẳng, thu được 1,568 lít khí CO2 (đktc) và 1,8 gam H2O. Số đồng phân cấu tạo thuộc loại amin bậc hai của hai amin đó là:
Đáp án : A Phương pháp giải :
Đặt công thức trung bình của hai amin no, đơn chức, kế tiếp là \({C_{\overline n }}{H_{2\overline n + 3}}N\) Tìm \(\overline n \) theo PTHH => CTPT của 2 amin và viết được các CTCT amin bậc 2. Lời giải chi tiết :
Đặt công thức của hh 2 amin no, đơn chức, kế tiếp nhau trong dãy đồng đẳng là: \({C_{\overline n }}{H_{2\overline n + 3}}N\) PTHH: \({C_{\overline n }}{H_{2\overline n + 3}}N + {O_2}\xrightarrow{{{t^0}}}\overline n C{O_2} + (\overline n + 1,5){H_2}O\) nCO2(đktc) = 1,568/22,4 = 0,07 (mol) nH2O = 1,8/18 = 0,1 (mol) Ta có: namin = (nH2O – nCO2)/1,5 = 0,02 (mol) \(\overline n = \frac{{{n_{C{O_2}}}}}{{n\,a\min }} = \frac{{0,07}}{{0,02}} = 3,5\) Vì 2 amin đồng đẳng kế tiếp nên CTPT 2 amin là C3H9N và C4H11N CTCT amin bậc 2 của C3H9N: CH3CH2-NH-CH3 CTCT amin bậc 2 của C4H11N: CH3-CH2-CH2-NH-CH3; CH3-CH(CH3)-NH-CH3; C2H5-NH-C2H5 → Tổng có 4 CTCT thỏa mãn.
Câu 23 :
Đốt cháy hoàn toàn m gam C2H5NH2 thu được sản phẩm gồm H2O, CO2 và 1,12 lít khí N2 (đktc). Giá trị của m là
Đáp án : C Phương pháp giải :
Áp dụng bảo toàn nguyên tố N. Lời giải chi tiết :
Bảo toàn nguyên tố N có: nC2H5NH2 = 2nN2 = 0,1 mol ⟹ mC2H5NH2 = 0,1.45 = 4,5 gam
Câu 24 :
13,35 gam hỗn hợp X gồm 2 amin no đơn chức mạch hở đồng đẳng kế tiếp tác dụng với dung dịch HCl vừa đủ thu được dung dịch chứa 22,475 gam muối . Nếu đốt 13,35 gam hỗn hợp X thì trong sản phẩm cháy có VCO2/VH2O bằng
Đáp án : B Phương pháp giải :
Dùng định luật bảo toàn khối lượng để tìm số mol 2 amin. Từ đó xác định được công thức chung của 2 amin. Khi đốt hỗn hợp X gồm 2 amin no, đơn chức mạch hở thì \(\frac{{{V_{C{O_2}}}}}{{{V_{{H_2}O}}}} = \frac{{{n_{C{O_2}}}}}{{{n_{{H_2}O}}}}\) Lời giải chi tiết :
Dùng bảo toàn khối lượng ta có: mHCl = mmuối - mamin = 9,125 (g) → nHCl = 0,25 (mol) → nAmin = nHCl = 0,25 mol Gọi công thức chung của 2 amin có dạng CxH2x+3N → M2 amin = m : n = 13,35 : 0,25 = 53,4 (g/mol) ⟹ 14x + 3 + 14 = 53,4 ⟹ x = 2,6 Khi đốt hỗn hợp X thì: CxH2x+3N + (1,5x + 0,75) O2 → xCO2 + (2x+3)/2 H2O + ½ N2 Vậy \(\frac{{{V_{C{O_2}}}}}{{{V_{{H_2}O}}}} = \frac{{{n_{C{O_2}}}}}{{{n_{{H_2}O}}}} = \frac{x}{{x + 1,5}} = \frac{{2,6}}{{2,6 + 1,5}} = \frac{{26}}{{41}}\)
Câu 25 :
Đốt cháy hoàn toàn 6,2 gam metylamin rồi cho sản phẩm cháy qua dung dịch Ca(OH)2 dư. Khối lượng bình đựng dung dịch Ca(OH)2 tăng là
Đáp án : D Phương pháp giải :
Từ phản ứng đốt cháy amin tìm được số mol CO2 và số mol H2O. Bình đựng dung dịch Ca(OH)2 hấp thụ cả CO2 và H2O ⟹ mbình tăng = mCO2 + mH2O Lời giải chi tiết :
Ta có: nCH3NH2 = 6,2/31 = 0,2 mol PTHH: CH3NH2 + 2,25 O2 → CO2 + 2,5 H2O + 0,5 N2 0,2 → 0,2 → 0,5 (mol) Bình đựng dung dịch Ca(OH)2 hấp thụ cả CO2 và H2O ⟹ mbình tăng = mCO2 + mH2O = 0,2. 44 + 0,5.18 = 17,8 gam
Câu 26 :
Đốt cháy hoàn toàn m gam 1 amin no đơn chức mạch hở người ta thu được 6,72 lít khí CO2 (đktc); 9,45 gam H2O và 1,68 lít khí N2 (đktc). Giá trị của m là:
Đáp án : A Phương pháp giải :
Bảo toàn nguyên tố O: 2nO2 = 2nCO2 + nH2O → nO2 Bảo toàn khối lượng: mamin + mO2 = mCO2 + mH2O + mN2 → m amin Lời giải chi tiết :
nCO2 = 6,72 : 22,4 = 0,3 mol; nH2O = 9,45 : 18 = 0,525 mol; nN2 = 1,68 : 22,4 = 0,075 mol Amin no đơn chức mạch hở có dạng CnH2n+3N Bảo toàn nguyên tố O: 2nO2 = 2nCO2 + nH2O → nO2 = 0,5625 mol Bảo toàn khối lượng: mamin + mO2 = mCO2 + mH2O + mN2 → mamin = 44.0,3 + 18.0,525 + 28.0,075 - 0,5625.32 = 6,75 gam
Câu 27 :
Đốt cháy hoàn toàn hỗn hợp M gồm hai amin no, đơn chức, mạch hở X và Y (có số mol bằng nhau, MX < MY) cần lượng vừa đủ 13,44 lít O2, thu được H2O, N2 và 6,72 lít CO2. Chất Y là:
Đáp án : A Phương pháp giải :
Bảo toàn nguyên tố O ta tính được số mol H2O. Đặt công thức chung của 2 amin no, đơn chức, mạch hở X và Y là CnH2n+3N CnH2n+3N + (3n/2+3/4) O2 → nCO2 + (2n+3)/2 H2O → nM = (nH2O - nCO2)/1,5 → số nguyên tử C = nCO2/nM Từ đó tìm được công thức của X và Y trong hỗn hợp M. Lời giải chi tiết :
Ta có: nO2 = 0,6 mol; nCO2 = 0,3 mol BTNT O => 2nO2 = 2nCO2 + nH2O → nH2O = 0,6 mol Đặt công thức chung của 2 amin no, đơn chức, mạch hở X và Y là CnH2n+3N CnH2n+3N + (3n/2+3/4) O2 → nCO2 + (2n+3)/2 H2O => nM = (nH2O - nCO2)/1,5 = 0,2 mol Suy ra số nguyên tử C = nCO2/nM =0,3: 0,2 = 1,5 => X là CH5N và Y là C2H7N (etylamin).
Câu 28 :
Đốt cháy hoàn toàn 1 amin no đơn chức bậc 2 mạch hở thu được tỉ lệ mol CO2 và H2O là 4 : 7. Tên của amin là:
Đáp án : C Phương pháp giải :
Công thức amin no đơn chức là CnH2n+3N Dựa vào nCO2 : nH2O => n => CTPT Amin bậc 2 => CTCT Lời giải chi tiết :
Công thức amin no đơn chức là CnH2n+3N Phản ứng cháy có nCO2 : nH2O = 4 : 7 => nC : nH = 2 : 7 = n : (2n + 3) => n = 2 => Amin đơn chức là C2H7N Amin bậc 2 => CH3NHCH3 (đimetyl amin)
Câu 29 :
Hỗn hợp khí E gồm một amin bậc III no, đơn chức, mạch hở và hai ankin X, Y (MX< MY). Đốt cháy hoàn toàn 0,15 mol hỗn hợp E cần dùng 11,2 lít O2 (đktc), thu được hỗn hợp F gồm CO2, H2O và N2. Dẫn toàn bộ F qua bình đựng dung dịch KOH đặc, dư đến phản ứng hoàn toàn thấy khối lượng bình bazơ nặng thêm 20,8 gam. Số cặp công thức cấu tạo ankin X, Y thỏa mãn là
Đáp án : C Phương pháp giải :
Đặt a, b là số mol CO2, H2O Áp dụng BTNT => a = ? và b = ?(mol) Hỗn hợp E gồm: \(\left\{ \matrix{ => u, v => mối quan hệ m => chọn giá trị và viết các CTCT thỏa mãn Lời giải chi tiết :
Đặt a, b là số mol CO2, H2O mBình nặng = mCO2 + mH2O => 44a + 18b = 20,8 (1) BTNT O: 2nO2 = 2nCO2 + nH2O => 2a+ b = 2.0,5 (2) Từ (1) và (2) => a = 0,35 và b = 0,3 (mol) Hỗn hợp E gồm: \(\left\{ \matrix{ Ta có: \(\eqalign{ Vì m ≥ 3 và \( \Rightarrow \left\{ \matrix{ Vậy 2 cặp ankin thỏa mãn là: (Vì MX < MY và các chất ở thể khí) => Các cặp CTCT thỏa mãn là: Cặp 1: CH≡ CH và CH≡C-CH3 Cặp 2: CH≡ CH và CH≡ C-CH2-CH3 Cặp 3: CH≡ CH và CH3- C≡C -CH3
Câu 30 :
Hỗn hợp X chứa etylamin và trimetylamin. Hỗn hợp Y chứa 2 hiđrocacbon mạch hở có số liên kết pi nhở hơn 3. Trộn X và Y theo tỉ lệ mol nX : nY = 1:5 thu được hỗn hợp Z. Đốt cháy hoàn toàn 3,17 gam hỗn hợp Z cần dùng vừa đủ 7,0 lít khí oxi (đktc), sản phẩm cháy gồm CO2, H2O và N2 được dẫn qua dung dịch NaOH đặc, dư thấy khối lượng dung dịch tăng 12,89 gam. Phần trăm khối lượng của etylamin trong X gần nhất với giá trị nào sau đây?
Đáp án : B Phương pháp giải :
\(3,17\,g\,Z\left\{ \begin{array}{l}{C_n}{H_{2n + 3}}N:z\\{C_m}{H_{2m + 2 - 2\bar k}}:5z\end{array} \right. + {O_2}:0,3125\,mol \to \left\{ \begin{array}{l}C{O_2}:a\\{H_2}O:b\\{N_2}:0,5z\end{array} \right. + NaOH \to \Delta m = 12,89\,gam\) + mdd NaOH tăng = mCO2 + mH2O BTNT O => nCO2, nH2O + BTKL (hoặc BTNT trong Z) => nN2 → Z Lời giải chi tiết :
\(\begin{array}{l}3,17\,g\,Z\left\{ \begin{array}{l}{C_n}{H_{2n + 3}}N:z\\{C_m}{H_{2m + 2 - 2\bar k}}:5z\end{array} \right. + {O_2}: + 0,3125\,mol \to \left\{ \begin{array}{l}C{O_2}:a\\{H_2}O:b\\{N_2}:0,5z\end{array} \right. + NaOH \to \Delta m = 12,89gam\\ \Rightarrow \left\{ \begin{array}{l}{m_{C{O_2}}} + {m_{{H_2}O}} = \Delta m = 12,892\\{n_{C{O_2}}} + {n_{{H_2}O}} = 2{n_{{O_2}}}(BTNT)\end{array} \right. \Rightarrow \left\{ \begin{array}{l}44a + 18b = 12,892\\a + b = 2.0,3125\end{array} \right. \Rightarrow \left\{ \begin{array}{l}a = 0,205\\b = 0,215\end{array} \right.\\{m_Z} = {m_C} + {m_H} + {m_N} \Rightarrow {m_N} = 3,17 - (12.0,205 + 2.0,215) = 0,28gam\\ \Rightarrow {n_N} = 0,02\,mol \Rightarrow z = 0,02 \Rightarrow {n_Y} = 5z = 0,1\\{n_{{H_2}O}} - {n_{C{O_2}}} = 0,01 = 1,5z + 5z.(1 - \bar k) \Rightarrow \bar k = 1,2\\{n_Z} = 6z = 0,12\,mol \Rightarrow \bar C = \frac{{{n_{C{O_2}}}}}{{{n_Z}}} = 1,708;\,\bar H = \frac{{{n_H}}}{{{n_Z}}} = 3,583\end{array}\) Vì X chứa 2 amin C2H7N và C3H9N, đều có số nguyên tử C > 1,708 và H > 3,583 → Y chứa một hiđrocacbon có số nguyên tử C < 1,708 → Y chứa CH4. Hai hiđrocacbon trong Y có số liên kết pi nhỏ hơn 3, mà CH4 (k=0) và = 1,2 → hiđrocacbon còn lại Y2 có k = 2 và số nguyên tử H < 3,583 → Y2: C2H2 \(\begin{array}{l}\bar k = {\rm{ }}1,2\Rightarrow \frac{{{n_{C{H_4}}}(k = 0)}}{{{n_{{Y_2}}}(k = 2)}} = \frac{{\left| {2 - 1,2} \right|}}{{\left| {0 - 1,2} \right|}} = \frac{2}{3}\\ \Rightarrow {n_{C{H_4}}} = 2z = 0,04;\,{n_{{Y_2}}} = 0,06\,mol\\{n_{C{O_2}}} = 0,205 = n.x + {n_{C{H_4}}} + 2{n_{{C_2}{H_2}}} \Rightarrow n = \frac{{0,205 - 0,04 - 2.0,06}}{{0,02}} = 2,25\\X\left\{ \begin{array}{l}{C_2}{H_7}N:x\\{C_3}{H_9}N:y\end{array} \right. \Rightarrow \left\{ \begin{array}{l}x + y = 0,02\\2x + 3y = 2,25.0,02 = {n_C}\end{array} \right. \Rightarrow \left\{ \begin{array}{l}x = 0,015\\y = 0,005\end{array} \right.\\ \Rightarrow \% {C_2}{H_7}N(X) = \frac{{0,015.45}}{{0,015.45 + 0,005.59}}.100\% = 69,59\% \end{array}\)
Câu 31 :
Cho 1,22 gam hỗn hợp X gồm hai amin bậc một (tỉ lệ mol là 1:2) tác dụng vừa đủ với 400 ml dung dịch HCl 0,1M thu được dung dịch Y. Mặt khác, khi đốt cháy hoàn toàn 0,09 mol hỗn hợp X thu được hỗn hợp khí và hơi. Dẫn toàn bộ hỗn hợp khí và hơi đó vào dung dịch Ba(OH)2 dư, lạnh thì thu được m gam kết tủa và thoát ra 1,344 lít (đktc) một khí duy nhất. Giá trị của m là
Đáp án : A Lời giải chi tiết :
\(\begin{array}{l}T{N_1}:\,\,1,22\,gX + HCl:0,04\,mol \to \\ \Rightarrow {n_{N(hh1)}} = {n_{HCl}} = 0,04\,mol.\\T{N_2}:\,\,0,09\,mol\,X + {O_2} \to \left\{ \begin{array}{l}C{O_2}\\{H_2}O\\{N_2}\end{array} \right. + Ba{(OH)_2} \to \left\{ \begin{array}{l}m\,g \downarrow BaC{O_3}\\0,06\,mol\, \uparrow \end{array} \right.\\ \Rightarrow {n_{{N_2}}} = 0,06 \Rightarrow {n_{N{\kern 1pt} (hh2)}} = 0,12\,mol = 3{n_{N(hh1)}}\\ \Rightarrow {m_{X(T{N_2})}} = 3{m_{X(T{N_1})}} = 3,66\,gam.\end{array}\) Ntb = 0,12/0,09 = 4/3 → X có chứa 1 amin đơn chức RNH2 (a mol); amin còn lại là amin đa chức R’(NH2)n (b mol) (Xét trong 3,66 gam X) Tỉ lệ mol của 2 amin là 1: 2 → có 2 TH: \(\begin{array}{l} + T{H_1}:\left\{ \begin{array}{l}a + b = 0,09\\b = 2a\end{array} \right. \Rightarrow \left\{ \begin{array}{l}a = 0,03\\b = 0,06\end{array} \right.\\ \Rightarrow {n_N} = 0,12 = 0,03.1 + 0,06.n \Rightarrow n = 1,5\,(loai)\\ + T{H_2}:\left\{ \begin{array}{l}a + b = 0,09\\a = 2b\end{array} \right. \Rightarrow \left\{ \begin{array}{l}a = 0,06\\b = 0,03\end{array} \right.\\ \Rightarrow \left\{ \begin{array}{l}{n_N} = 0,12 = 0,06.1 + 0,03.n\\0,06(R + 16) + 0,03(R' + 16n) = 3,66\end{array} \right. \Rightarrow \left\{ \begin{array}{l}n = 22\\R + R' = 58\end{array} \right.\\ \Rightarrow \left\{ \begin{array}{l}n = 2\\R = 15;R' = 28\end{array} \right.\\ \Rightarrow X\left\{ \begin{array}{l}C{H_3}N{H_2}:0,06\,mol\\{C_2}{H_4}{(N{H_2})_2}:0,03\,mol\end{array} \right. + {O_2} \to 0,12\,mol\,C{O_2} + Ba{(OH)_2} \to m\,g\,BaC{O_3}\\ \Rightarrow m = 0,12.197 = 23,64\,gam\end{array}\)
Câu 32 :
Hỗn hợp E chứa axetilen, propin và một amin no, đơn chức, mạch hở. Đốt cháy hoàn toàn 5,46 gam hỗn hợp E cần dùng 11,088 lít O2 (đktc) thu được hỗn hợp F gồm CO2, H2O và khí N2, trong đó tỉ lệ mol CO2: H2O là 1:1. Phân tử khối của amin là
Đáp án : A Phương pháp giải :
\(5,46g\,E\left\{ \begin{array}{l}{C_n}{H_{2n - 2}}:x\\{C_m}{H_{2m + 3}}N:y\end{array} \right. + {O_2}:0,495\,mol \to \left\{ \begin{array}{l}C{O_2}:a\\{H_2}O:a\\{N_2}\end{array} \right.\) Sử dụng định luật bảo toàn khối lượng và bảo toàn nguyên tố để giải bài toán này
Lời giải chi tiết :
\(\begin{array}{l}5,46g\,E\left\{ \begin{array}{l}{C_n}{H_{2n - 2}}:x\\{C_m}{H_{2m + 3}}N:y\end{array} \right. + {O_2}:0,495\,mol \to \left\{ \begin{array}{l}C{O_2}:a\\{H_2}O:a\\{N_2}\end{array} \right.\\BTNT\,oxi:2{n_{{O_2}}} = 2{n_{C{O_2}}} + {n_{{H_2}O}} \Rightarrow 0,495.2 = 2a + a \Rightarrow a = 0,33\,mol\\5,46 = {m_E} = {m_C} + {m_H} + {m_N} = 0,33.12 + 0,33.2 + {m_N}\\ \Rightarrow {m_N} = 0,84 \Rightarrow y = 0,06\,mol\\{n_{{H_2}O}} - {n_{C{O_2}}} = 0 \Rightarrow x = 1,5y = 0,09\,mol\\\left\{ \begin{array}{l}nx + my = {n_{C{O_2}}} = 0,33\\2 < n < 3\end{array} \right. \Rightarrow \left\{ \begin{array}{l}0,09n + 0,06m = 0,33\\2 < n < 3\end{array} \right.\\ \Rightarrow 1 < m < 2,5 \Rightarrow n = 2 \Rightarrow A\min :\,{C_2}{H_7}N\end{array}\)
|



















Danh sách bình luận