Trắc nghiệm Bài 26. Kim loại kiềm thổ và hợp chất - Hóa 12Đề bài
Câu 1 :
Dãy gồm các chất đều là kim loại kiềm thổ là
Câu 2 :
Nhận xét nào sau đây là không đúng ?
Câu 3 :
Câu nào không đúng khi nói về canxi ?
Câu 4 :
Mô tả nào sau đây không đúng về ứng dụng của Mg ?
Câu 5 :
So với nguyên tử canxi, nguyên tử kali có
Câu 6 :
Hãy chọn phản ứng giải thích sự xâm thực của nước mưa với đá vôi và sự tạo thành thạch nhũ trong các hang động?
Câu 7 :
Thạch cao nung được điều chế bằng cách nung thạch cao sống CaSO4.2H2O ở 180oC. Công thức của thạch cao nung là
Câu 8 :
Hợp chất nào của canxi được dùng để đúc tượng, bó bột khi gãy xương ?
Câu 9 :
Thành phần chính của quặng đôlomit là
Câu 10 :
Chất nào sau đây không bị nhiệt phân?
Câu 11 :
Để nhận biết Na, Ca, Al ta dùng lần lượt các chất sau:
Câu 12 :
Cho các dung dịch sau: Ba(OH)2, NaHSO4, K2CO3, Ba(HCO3)2. Đổ lần lượt các dung dịch vào nhau. Số phản ứng xảy ra là
Câu 13 :
Cho biết phản ứng nào không xảy ra ở nhiệt độ thường ?
Câu 14 :
Chỉ dùng thêm thuốc thử nào dưới đây có thể nhận biết được 3 lọ mất nhãn chứa các dung dịch: H2SO4, BaCl2, Na2SO4 ?
Câu 15 :
Cho dãy các chất: KOH, Ca(NO3)2, SO2, SO3, NaHSO4, Na2SO3, K2SO4. Số chất trong dãy tạo thành kết tủa khi phản ứng với dung dịch BaCl2 là
Câu 16 :
Đun nóng đến khối lượng không đổi hỗn hợp X gồm Mg(OH)2, Ca(NO3)2, BaCl2 thu được hỗn hợp chất rắn Y. Thành phần của hỗn hợp Y là
Câu 17 :
Cho dd Ba(HCO3)2 lần lượt tác dụng với các dd sau: CaCl2, Ca(NO3)2, NaOH, NaHSO4, Ca(OH)2, H2SO4, HCl. Số phản ứng tạo ra kết tủa là
Câu 18 :
Cho sơ đồ biến hóa: Ca → X → Y → Z → T → Ca. Hãy chọn thứ tự đúng của các chất X, Y, Z, T là
Câu 19 :
Từ hai muối X và Y thực hiện các phản ứng sau: X → X1 + CO2 X1 + H2O → X2 X2 + Y → X + Y1 + H2O X2 + 2Y → X + Y2 + H2O Hai muối X và Y tương ướng là
Câu 20 :
Cho các sơ đồ chuyển hóa: CaO + X → CaCl2; CaCl2 + Y → Ca(NO3)2; Ca(NO3)2 + Z → CaCO3. Công thức của chất X, Y, Z lần lượt là
Câu 21 :
Kim loại nào sau đây là kim loại kiềm thổ?
Câu 22 :
Đốt môi sắt chứa kim loại M cháy ngoài không khí rồi đưa vào bình đựng khí CO2 như hình vẽ, thấy kim loại M vẫn tiếp tục cháy trong bình đựng CO2 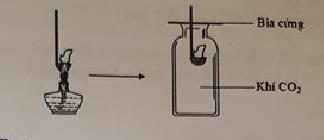 Kim loại M là
Kim loại kiềm thuộc nhóm IA trong bảng tuần hoàn. Kim loại thuộc nhóm IA được gọi là kim loại kiềm vì hiđroxit của chúng có tính chất kiềm mạnh. Các kim loại kiềm có màu trắng bạc và có ánh kim rất mạnh. Ánh kim mất nhanh chóng khi kim loại tiếp xúc với không khí do bị oxi hóa. Một số hợp chất của kim loại kiềm có nhiều ứng dụng quan trọng như natri hiđrocacbonat dùng trong y học, công nghệ dược phẩm, chế tạo nước giải khát,... Natri cacbonat dùng trong công nghiệp thủy tinh, xà phòng, giấy,... Hợp chất của Na, K rất cần thiết đối với con người, động vật và thực vật. Kali là một trong 3 nguyên tố cần thường xuyên cung cấp cho đất để tăng năng suất vụ mùa. Natri cần thiết cho con người và động vật giống như kali cần thiết cho cây trồng. Câu 23
Điện phân nóng chảy hoàn toàn 4,25 g muối clorua của một kim loại kiềm thu được 1,568 lít khí tại anot (đo ở 109,2°C và 1 atm). (Biết Li = 7; Na = 23; K = 39; Rb = 85). Kim loại kiềm đó là
Câu 24
Để có được những chiếc bánh to và đẹp, một cơ sở sản xuất bánh bao thường trộn một ít bột natri hiđrocacbonat nhào với bột mì làm thành nhiều chiếc bánh nhỏ, sau đó cho bánh vào lò nung ở nhiệt độ cao. Sau một thời gian, thu được những chiếc bánh bao to, tròn nóng hổi rất thơm ngon. Phương trình hóa học giải thích cho việc làm đó là
Câu 25
Nhận định nào sau đây sai?
Vôi tôi là một dạng tinh thể không màu hay bột màu trắng, và thu được khi cho canxi oxit (vôi sống) tác dụng với nước. Nó cũng có thể kết tủa xuống khi trộn dung dịch chứa canxi clorua với dung dịch natri hiđroxit. Tên gọi dân gian của canxi hiđroxit là vôi tôi hay đơn giản chỉ là vôi. Dung dịch chứa canxi hiđroxit gọi chung là nước vôi và có tính bazơ trung bình – mạnh. Trong quá trình sản xuất vôi xảy ra phản ứng sau: CaCO3(r) ⇄ CaO(r) + CO2(k) \(\Delta H > 0\) Câu 26
Khi bị ong, kiến đốt để đỡ đau, người ta thường bôi vôi vào vết đốt. Phương trình hóa học giải thích cho việc làm đó là
Câu 27
Người ta nung 1 tấn đá vôi chứa 10% tạp chất thì có thể thu được bao nhiêu tấn vôi sống để sản xuất vôi tôi nếu hiệu suất phản ứng là 95% (biết H = 1; C = 12; O = 16; Ca = 40)?
Câu 28
Để tăng hiệu suất tạo thành vôi tôi, người ta có thể
Mưa axit - hậu quả ô nhiễm khói, bụi được phát hiện lần đầu tiên vào năm 1948 tại Thụy Điển. Ngay từ những năm 50 của thế kỷ 20, hiện tượng này đã bắt đầu được nghiên cứu. Phát hiện tại Đức năm 1984 cho thấy, hơn một nửa cánh rừng của miền Tây nước này đã và đang ở vào thời kỳ bị phá hủy với những mức độ khác nhau. Hay như ở Thụy Sĩ bị thiệt hại khoảng 12 triệu cây (chiếm 14% diện tích rừng), trong khi đó ở Hà Lan diện tích rừng bị phá hủy lên đến 40%. Mưa axit gây phá hủy rộng lớn cho rừng cây khắp nơi trên thế giới, đặc biệt là những vùng công nghiệp hóa như châu Âu và Bắc Mỹ. Mưa axit xảy ra chủ yếu do sự phóng thích SO2 từ sự nung chảy quặng sunfua và sự đốt cháy các nhiên liệu. Trong không khí, một phần SO2 chuyển thành SO3 được hấp thụ trong nước mưa chuyển thành axit sunfuric. Hình ảnh sau đây là những bức tượng Caryalid (tượng hình phụ nữ thay cho cột) được xây dựng ở Acropolis tại Athen hơn 2500 năm trước. Các bức tượng này được tạc từ một loại đá gọi là đá cẩm thạch. Đá cẩm thạch được tạo thành từ canxi cacbonat. Năm 1980, những tượng nguyên bản đã được chuyển vào trong bảo tàng Acropolis và được thay thế bởi bản sao đúng như thật. Những bức tượng nguyên bản đã bị ăn mòn bởi mưa axit.
Câu 29
Phản ứng hóa học nào đã xảy ra trong hiện tượng ăn mòn các bức tượng Caryatid do mưa axit?
Câu 30
Giả sử rằng cứ 50000 phân tử nước (chứa trong 4,50.104 lít nước của một trận mưa) hấp thụ một phân tử SO3 và toàn bộ lượng axit sunfuric được tạo ra đều tan hết trong lượng mưa nêu trên. Cho H = 1; O = 16; S = 32; NA = 6,02.1023 và khối lượng riêng của nước là 1,00 g.ml-1. Nồng độ mol/l của axit sunfuric trong nước mưa là
Câu 31
Để xác định hàm lượng NO3- trong 200 ml nước mưa, người ta dùng Cu và H2SO4 loãng, thấy lượng đồng cần sử dụng là 1,92 mg. Biết nồng độ ion NO3- tối đa cho phép trong nước mưa dùng để ăn uống là 9 ppm (mg/l). Cho H = 1; N = 14; O = 16; S = 32; Cu = 64. Nhận định nào sau đây đúng?
Lời giải và đáp án
Câu 1 :
Dãy gồm các chất đều là kim loại kiềm thổ là
Đáp án : A Lời giải chi tiết :
Dãy gồm các chất đều là kim loại kiềm thổ là Be, Ca, Sr, Ba
Câu 2 :
Nhận xét nào sau đây là không đúng ?
Đáp án : D Lời giải chi tiết :
Nhận xét không đúng là : Be, Mg, Ca, Sr, Ba đều phản ứng với nước ở nhiệt độ thường nên gọi là kim loại kiềm thổ. Vì Be không phản ứng với nước, còn Mg phản ứng với nước ở nhiệt độ cao.
Câu 3 :
Câu nào không đúng khi nói về canxi ?
Đáp án : C Lời giải chi tiết :
Câu không đúng là: Nguyên tử Ca bị khử khi Ca tác dụng với O2. PTHH: 2Ca + O2 → 2CaO => Ca bị oxi hóa khi tác dụng với O2.
Câu 4 :
Mô tả nào sau đây không đúng về ứng dụng của Mg ?
Đáp án : B Lời giải chi tiết :
Mô tả không đúng là B. Mg dùng chế tạo dây dẫn điện
Câu 5 :
So với nguyên tử canxi, nguyên tử kali có
Đáp án : B Phương pháp giải :
Xem lại lí thuyết kim loại kiềm thổ Lời giải chi tiết :
So với nguyên tử canxi, nguyên tử K có bán kính lớn hơn và độ âm điện nhỏ hơn
Câu 6 :
Hãy chọn phản ứng giải thích sự xâm thực của nước mưa với đá vôi và sự tạo thành thạch nhũ trong các hang động?
Đáp án : D Lời giải chi tiết :
Phản ứng giải thích sự xâm thực của nước mưa với đá vôi và sự tạo thành thạch nhũ trong các hang động là quá trình phản ứng thuận nghịch: CaCO3 + H2O + CO2 $\overset {} \leftrightarrows $ Ca(HCO3)2 xảy ra trong 1 thời gian rất lâu
Câu 7 :
Thạch cao nung được điều chế bằng cách nung thạch cao sống CaSO4.2H2O ở 180oC. Công thức của thạch cao nung là
Đáp án : A Lời giải chi tiết :
CaSO4.2H2O $\xrightarrow{{{{160}^o}C}}$ CaSO4.H2O hoặc CaSO4.0,5H2O (thạch cao nung)
Câu 8 :
Hợp chất nào của canxi được dùng để đúc tượng, bó bột khi gãy xương ?
Đáp án : C Lời giải chi tiết :
Hợp chất được dùng để đúc tượng, bó bột khi gãy xương là thạch cao nung (CaSO4.H2O)
Câu 9 :
Thành phần chính của quặng đôlomit là
Đáp án : A Phương pháp giải :
Xem lại lí thuyết kim loại kiềm thổ Lời giải chi tiết :
Thành phần chính của quặng đôlomit là: CaCO3.MgCO3
Câu 10 :
Chất nào sau đây không bị nhiệt phân?
Đáp án : B Phương pháp giải :
Xem lại lí thuyết kim loại kiềm thổ Lời giải chi tiết :
Mg(OH)2 $\xrightarrow{{{t^o}}}$ MgO + H2O CaCO3 $\xrightarrow{{{t^o}}}$ CaO + CO2 Ca(HCO3)2 $\xrightarrow{{{t^o}}}$ CaCO3 + CO2 + H2O => Chất không bị nhiệt phân là Ca(OH)2
Câu 11 :
Để nhận biết Na, Ca, Al ta dùng lần lượt các chất sau:
Đáp án : A Phương pháp giải :
Xem lại lí thuyết kim loại kiềm thổ Lời giải chi tiết :
Câu 12 :
Cho các dung dịch sau: Ba(OH)2, NaHSO4, K2CO3, Ba(HCO3)2. Đổ lần lượt các dung dịch vào nhau. Số phản ứng xảy ra là
Đáp án : B Phương pháp giải :
Xem lại lí thuyết kim loại kiềm thổ Lời giải chi tiết :
+) Ba(OH)2 phản ứng với NaHSO4, K2CO3, Ba(HCO3)2 +) NaHSO4 phản ứng với K2CO3, Ba(HCO3)2 +) K2CO3 phản ứng với Ba(HCO3)2 => có tất cả 6 phản ứng
Câu 13 :
Cho biết phản ứng nào không xảy ra ở nhiệt độ thường ?
Đáp án : D Phương pháp giải :
Xem lại lí thuyết kim loại kiềm thổ Lời giải chi tiết :
Phản ứng không xảy ra ở nhiệt độ thường là: CaCl2 + NaHCO3 → CaCO3 + NaCl + HCl
Câu 14 :
Chỉ dùng thêm thuốc thử nào dưới đây có thể nhận biết được 3 lọ mất nhãn chứa các dung dịch: H2SO4, BaCl2, Na2SO4 ?
Đáp án : D Phương pháp giải :
Xem lại lí thuyết kim loại kiềm thổ Lời giải chi tiết :
- dùng quỳ tím
- dùng bột kẽm
- dùng Na2CO3
Câu 15 :
Cho dãy các chất: KOH, Ca(NO3)2, SO2, SO3, NaHSO4, Na2SO3, K2SO4. Số chất trong dãy tạo thành kết tủa khi phản ứng với dung dịch BaCl2 là
Đáp án : A Phương pháp giải :
Xem lại lí thuyết kim loại kiềm thổ Lời giải chi tiết :
Các chất tạo kết tủa với dung dịch BaCl2 là: SO3, NaHSO4, Na2SO3, K2SO4 SO3 + H2O → H2SO4 BaCl2 + H2SO4 → BaSO4↓ + 2HCl BaCl2 + 2NaHSO4 → BaSO4↓ + 2HCl + Na2SO4 BaCl2 + Na2SO3 → 2NaCl + BaSO3↓ BaCl2 + K2SO4 → 2KCl + BaSO4↓
Câu 16 :
Đun nóng đến khối lượng không đổi hỗn hợp X gồm Mg(OH)2, Ca(NO3)2, BaCl2 thu được hỗn hợp chất rắn Y. Thành phần của hỗn hợp Y là
Đáp án : C Phương pháp giải :
Xem lại lí thuyết kim loại kiềm thổ Lời giải chi tiết :
Đun nóng hỗn hợp X có 2 chất bị phân hủy Mg(OH)2 $\xrightarrow{{{t^o}}}$ MgO + H2O Ca(NO3)2 $\xrightarrow{{{t^o}}}$ Ca(NO2)2 + O2 BaCl2 không bị phân hủy
Câu 17 :
Cho dd Ba(HCO3)2 lần lượt tác dụng với các dd sau: CaCl2, Ca(NO3)2, NaOH, NaHSO4, Ca(OH)2, H2SO4, HCl. Số phản ứng tạo ra kết tủa là
Đáp án : B Phương pháp giải :
Xem lại lí thuyết kim loại kiềm thổ Lời giải chi tiết :
Ba(HCO3)2 phản ứng với các chất sinh ra kết tủa là: NaOH, NaHSO4, Ca(OH)2, H2SO4 Ba(HCO3)2 + 2NaOH → BaCO3 ↓ + Na2CO3 + 2H2O Ba(HCO3)2 + 2NaHSO4 → BaSO4 ↓ + Na2SO4 + 2CO2 + 2H2O Ba(HCO3)2 + Ca(OH)2 → BaCO3 ↓ + CaCO3 ↓ + 2H2O Ba(HCO3)2 + H2SO4 → BaSO4 ↓ + 2CO2 + 2H2O
Câu 18 :
Cho sơ đồ biến hóa: Ca → X → Y → Z → T → Ca. Hãy chọn thứ tự đúng của các chất X, Y, Z, T là
Đáp án : B Phương pháp giải :
Xem lại lí thuyết kim loại kiềm thổ Lời giải chi tiết :
Sơ đồ biến hóa đúng là : Ca → CaO → CaCO3 → Ca(HCO3)2 → CaCl2 → Ca PTHH: 2Ca + O2 → 2CaO CaO + CO2 → CaCO3 CaCO3 + CO2 + H2O → Ca(HCO3)2 Ca(HCO3)2 + 2HCl → CaCl2 + 2CO2 + 2H2O CaCl2 $\xrightarrow{{đpnc}}$ Ca + Cl2
Câu 19 :
Từ hai muối X và Y thực hiện các phản ứng sau: X → X1 + CO2 X1 + H2O → X2 X2 + Y → X + Y1 + H2O X2 + 2Y → X + Y2 + H2O Hai muối X và Y tương ướng là
Đáp án : C Phương pháp giải :
Xem lại lí thuyết kim loại kiềm thổ Lời giải chi tiết :
X phân hủy tạo CO2 => X là CaCO3 hoặc BaCO3 => X1 là oxit bazơ : MO => X2 là bazơ M(OH)2 Ta thấy X2 + Y -> X => Y phải là hợp chất cacbonat ( CO3 hoặc HCO3) mà X2 tác dụng với Y theo 2 tỉ lệ tạo 2 chất khác nhau => Y là NaHCO3 => X là CaCO3 PTHH: Ca(OH)2 + NaHCO3 → CaCO3 + NaOH + H2O Ca(OH)2 + 2NaHCO3 → CaCO3 + Na2CO3 + H2O
Câu 20 :
Cho các sơ đồ chuyển hóa: CaO + X → CaCl2; CaCl2 + Y → Ca(NO3)2; Ca(NO3)2 + Z → CaCO3. Công thức của chất X, Y, Z lần lượt là
Đáp án : B Phương pháp giải :
Xem lại lí thuyết kim loại kiềm thổ Lời giải chi tiết :
PTHH: CaO + 2HCl → CaCl2 + H2O CaCl2 + 2AgNO3 → Ca(NO3)2 + 2AgCl↓ Ca(NO3)2 + (NH4)2CO3 → CaCO3 + 2NH4NO3 Loại A và D vì Cl2 không tác dụng với CaO Loại C vì HNO3 không tác dụng với CaCl2
Câu 21 :
Kim loại nào sau đây là kim loại kiềm thổ?
Đáp án : B Phương pháp giải :
Kim loại kiềm thổ là các kim loại thuộc nhóm IIA trong bảng hệ thống tuần hoàn các nguyên tố hóa học Lời giải chi tiết :
Fe là kim loại chuyển tiếp Mg là kim loại kiềm thổ Al là kim loại nhóm IIIA K là kim loại kiềm
Câu 22 :
Đốt môi sắt chứa kim loại M cháy ngoài không khí rồi đưa vào bình đựng khí CO2 như hình vẽ, thấy kim loại M vẫn tiếp tục cháy trong bình đựng CO2  Kim loại M là
Đáp án : D Phương pháp giải :
Viết PTHH Lời giải chi tiết :
Kim loại M là Mg vì 2Mg + O2 \(\xrightarrow{{{t^o}}}\) 2MgO Mg + CO2 \(\xrightarrow{{{t^o}}}\) MgO + C Kim loại kiềm thuộc nhóm IA trong bảng tuần hoàn. Kim loại thuộc nhóm IA được gọi là kim loại kiềm vì hiđroxit của chúng có tính chất kiềm mạnh. Các kim loại kiềm có màu trắng bạc và có ánh kim rất mạnh. Ánh kim mất nhanh chóng khi kim loại tiếp xúc với không khí do bị oxi hóa. Một số hợp chất của kim loại kiềm có nhiều ứng dụng quan trọng như natri hiđrocacbonat dùng trong y học, công nghệ dược phẩm, chế tạo nước giải khát,... Natri cacbonat dùng trong công nghiệp thủy tinh, xà phòng, giấy,... Hợp chất của Na, K rất cần thiết đối với con người, động vật và thực vật. Kali là một trong 3 nguyên tố cần thường xuyên cung cấp cho đất để tăng năng suất vụ mùa. Natri cần thiết cho con người và động vật giống như kali cần thiết cho cây trồng. Câu 23
Điện phân nóng chảy hoàn toàn 4,25 g muối clorua của một kim loại kiềm thu được 1,568 lít khí tại anot (đo ở 109,2°C và 1 atm). (Biết Li = 7; Na = 23; K = 39; Rb = 85). Kim loại kiềm đó là
Đáp án : D Phương pháp giải :
Gọi công thức của muối clorua là MCl. Bước 1: Tính số mol Cl2 Sử dụng công thức \(n = \dfrac{{pV}}{{RT}}\) Trong đó: + p là áp suất (đơn vị: atm) + V là thể tích (đơn vị: lít) + n là số mol (đơn vị: mol) + R là hằng số, R = 0,082 + T là nhiệt độ (đơn vị: K; cách đổi từ oC sang K là T (K) = t (oC) + 273) Bước 2: Tính MCl theo PTHH PTHH: 2 MCl \(\xrightarrow{{{t^0}}}\) 2M + Cl2 Từ số mol tính MMCl => M Lời giải chi tiết :
Gọi công thức của muối clorua là MCl Bước 1: Tính số mol Cl2 Ta có: \({n_{C{l_2}}} = \dfrac{{1.1,568}}{{0,082.(109,2 + 273)}} = 0,05\) (mol). Bước 2: Tính MCl theo PTHH PTHH: 2MCl \(\xrightarrow{{{t^0}}}\) 2M + Cl2 Theo PTHH ⟹ \({n_{MCl}} = 2{n_{C{l_2}}} = 0,1\) (mol). Bước 3: Xác định M ⟹ \({M_{MCl}} = \dfrac{{4,25}}{{0,1}} = 42,5\) ⟹ \({M_M} = 42,5 - 35,5 = 7\) (Li). Vậy M là Li. Câu 24
Để có được những chiếc bánh to và đẹp, một cơ sở sản xuất bánh bao thường trộn một ít bột natri hiđrocacbonat nhào với bột mì làm thành nhiều chiếc bánh nhỏ, sau đó cho bánh vào lò nung ở nhiệt độ cao. Sau một thời gian, thu được những chiếc bánh bao to, tròn nóng hổi rất thơm ngon. Phương trình hóa học giải thích cho việc làm đó là
Đáp án : A Lời giải chi tiết :
Ở nhiệt độ cao, NaHCO3 bị nhiệt phân tạo ra CO2 khiến cho bánh trở nên phồng xốp hơn. PTHH: 2NaHCO3 \(\xrightarrow{{{t^0}}}\) Na2CO3 + CO2 + H2O. Câu 25
Nhận định nào sau đây sai?
Đáp án : B Phương pháp giải :
Dựa vào kiến thức tổng hợp về tính chất và ứng dụng của kim loại kiềm. Lời giải chi tiết :
B sai vì các kim loại kiềm có cấu trúc mạng tinh thể lập phương tâm khối.
Vôi tôi là một dạng tinh thể không màu hay bột màu trắng, và thu được khi cho canxi oxit (vôi sống) tác dụng với nước. Nó cũng có thể kết tủa xuống khi trộn dung dịch chứa canxi clorua với dung dịch natri hiđroxit. Tên gọi dân gian của canxi hiđroxit là vôi tôi hay đơn giản chỉ là vôi. Dung dịch chứa canxi hiđroxit gọi chung là nước vôi và có tính bazơ trung bình – mạnh. Trong quá trình sản xuất vôi xảy ra phản ứng sau: CaCO3(r) ⇄ CaO(r) + CO2(k) \(\Delta H > 0\) Câu 26
Khi bị ong, kiến đốt để đỡ đau, người ta thường bôi vôi vào vết đốt. Phương trình hóa học giải thích cho việc làm đó là
Đáp án : D Phương pháp giải :
Bước 1: Xác định loại nọc độc của ong là gì? Trong nọc độc của ong, kiến chứa axit cacboxylic là axit fomic (HCOOH). Bước 2: Viết pt ⟹ Viết phương trình hóa học (phản ứng trung hòa giữa vôi và axit fomic). Lời giải chi tiết :
Bước 1: Xác định loại nọc độc của ong là gì? Trong nọc độc của ong, kiến chứa axit cacboxylic là axit fomic (HCOOH). Để đỡ đau, người ta sẽ bôi vôi (mang tính bazơ) vào vết đốt để trung hòa axit trong nọc độc của ong, kiến. Bước 2: Viết pt PTHH: Ca(OH)2 + 2HCOOH → (HCOO)2Ca + 2H2O. Câu 27
Người ta nung 1 tấn đá vôi chứa 10% tạp chất thì có thể thu được bao nhiêu tấn vôi sống để sản xuất vôi tôi nếu hiệu suất phản ứng là 95% (biết H = 1; C = 12; O = 16; Ca = 40)?
Đáp án : A Phương pháp giải :
Bước 1: Tính khối lượng thực tế của CaCO3 trong đá vôi m CaCO3 (trong đá vôi) = mđá vôi . 90% (Do đá vôi chứa 10% tạp chất) Bước 2: Tính khối lượng CaO thu được theo lý thuyết CaCO3 ⇄ CaO + CO2 Theo PTHH ⟹ mCaO(LT) Bước 3: Tính khối lượng CaO thực tế thu được \(H = \dfrac{{{m_{CaO(TT)}}}}{{{m_{CaO(LT)}}}}.100\% \) ⟹ mCaO(TT). Lời giải chi tiết :
Bước 1: Tính khối lượng thực tế của CaCO3 trong đá vôi m CaCO3 (trong đá vôi) = mđá vôi . 90% = 0,90 (tấn) Bước 2: Tính khối lượng CaO thu được theo lý thuyết PTHH: CaCO3 ⇄ CaO + CO2 Theo PTHH : 100 56 44 (tấn) Theo đề bài : 0,90 → x (tấn) ⟹ \({m_{CaO(LT)}} = x = \dfrac{{0,90.56}}{{100}} = 0,5040\) (tấn) Bước 3: Tính khối lượng CaO thực tế thu được \(H = \dfrac{{{m_{CaO(TT)}}}}{{{m_{CaO(LT)}}}}.100\% \)⟹ \({m_{CaO(TT)}} = \dfrac{{H.{m_{CaO(LT)}}}}{{100\% }} = \dfrac{{95\% .0,5040}}{{100\% }} = 0,4788\) (tấn) Vậy khối lượng vôi sống thu được là 0,4788 (tấn). Câu 28
Để tăng hiệu suất tạo thành vôi tôi, người ta có thể
Đáp án : B Phương pháp giải :
Áp dụng nguyên lý chuyển dịch cân bằng Lơ Sa-tơ-li-ê: “Một phản ứng thuận nghịch đang ở trạng thái cân bằng khi chịu tác động từ bên ngoài như biến đổi nồng độ, áp suất, nhiệt độ, thì cân bằng sẽ chuyển dịch theo chiều làm giảm tác động bên ngoài đó.’’ Do vậy để tăng hiệu suất của quá trình tạo thành vôi tôi (CaO) thì cân bằng phải chuyển dịch theo chiều tạo ra CaO nhiều hơn, tức là theo chiều thuận. Lời giải chi tiết :
Để tăng hiệu suất của quá trình tạo thành vôi tôi (CaO) thì cân bằng phải chuyển dịch theo chiều tạo ra CaO nhiều hơn, tức là theo chiều thuận. ∆H > 0 nên phản ứng thuận là phản ứng thu nhiệt. ⟹ Muốn cân bằng chuyển dịch theo chiều thuận thì phải tăng nhiệt độ. Sau phản ứng tạo ra CaO và CO2 (lượng CaO và CO2 sau phản ứng nhiều hơn trước phản ứng). ⟹ Muốn cân bằng chuyển dịch theo chiều thuận thì phải lấy bớt ra lượng khí CO2 hoặc CaO tạo ra sau phản ứng. Sau phản ứng tạo ra CO2 làm tăng áp suất của hệ. ⟹ Muốn cân bằng chuyển dịch theo chiều thuận thì phải làm giảm áp suất của hệ. Vậy đáp án đúng là đáp án B.
Mưa axit - hậu quả ô nhiễm khói, bụi được phát hiện lần đầu tiên vào năm 1948 tại Thụy Điển. Ngay từ những năm 50 của thế kỷ 20, hiện tượng này đã bắt đầu được nghiên cứu. Phát hiện tại Đức năm 1984 cho thấy, hơn một nửa cánh rừng của miền Tây nước này đã và đang ở vào thời kỳ bị phá hủy với những mức độ khác nhau. Hay như ở Thụy Sĩ bị thiệt hại khoảng 12 triệu cây (chiếm 14% diện tích rừng), trong khi đó ở Hà Lan diện tích rừng bị phá hủy lên đến 40%. Mưa axit gây phá hủy rộng lớn cho rừng cây khắp nơi trên thế giới, đặc biệt là những vùng công nghiệp hóa như châu Âu và Bắc Mỹ. Mưa axit xảy ra chủ yếu do sự phóng thích SO2 từ sự nung chảy quặng sunfua và sự đốt cháy các nhiên liệu. Trong không khí, một phần SO2 chuyển thành SO3 được hấp thụ trong nước mưa chuyển thành axit sunfuric. Hình ảnh sau đây là những bức tượng Caryalid (tượng hình phụ nữ thay cho cột) được xây dựng ở Acropolis tại Athen hơn 2500 năm trước. Các bức tượng này được tạc từ một loại đá gọi là đá cẩm thạch. Đá cẩm thạch được tạo thành từ canxi cacbonat. Năm 1980, những tượng nguyên bản đã được chuyển vào trong bảo tàng Acropolis và được thay thế bởi bản sao đúng như thật. Những bức tượng nguyên bản đã bị ăn mòn bởi mưa axit.
Câu 29
Phản ứng hóa học nào đã xảy ra trong hiện tượng ăn mòn các bức tượng Caryatid do mưa axit?
Đáp án : C Phương pháp giải :
Dựa vào dữ kiện đá cẩm thạch được tạo thành từ canxi cacbonat ⟶ Phản ứng hóa học. Lời giải chi tiết :
Phản ứng hóa học nào đã xảy ra trong hiện tượng ăn mòn các bức tượng Caryatid do mưa axit là PTHH: CaCO3 + 2H+ ⟶ Ca2+ + CO2 ↑ + H2O. Câu 30
Giả sử rằng cứ 50000 phân tử nước (chứa trong 4,50.104 lít nước của một trận mưa) hấp thụ một phân tử SO3 và toàn bộ lượng axit sunfuric được tạo ra đều tan hết trong lượng mưa nêu trên. Cho H = 1; O = 16; S = 32; NA = 6,02.1023 và khối lượng riêng của nước là 1,00 g.ml-1. Nồng độ mol/l của axit sunfuric trong nước mưa là
Đáp án : A Phương pháp giải :
- Ta có: \({m_{{H_2}O}} = V.D \Rightarrow {n_{{H_2}O}} \Rightarrow {n_{S{O_3}}} = \dfrac{{{n_{{H_2}O}}}}{{{{5.10}^4}}}\) - Bảo toàn nguyên tố S ⟹ \({n_{{H_2}S{O_4}}} \Rightarrow {C_{M({H_2}S{O_4})}} = \dfrac{{{n_{{H_2}S{O_4}}}}}{{4,{{5.10}^4}}}\) Lời giải chi tiết :
- Ta có: \({m_{{H_2}O}} = V.D = 4,{5.10^4}{.10^3} = 4,{5.10^7}(g) \Rightarrow {n_{{H_2}O}} = \dfrac{{4,{{5.10}^7}}}{{18}} = 2,{5.10^6}(mol)\) - Cứ 50000 phân tử nước (chứa trong 4,50.104 lít nước của một trận mưa) hấp thụ một phân tử SO3 ⟹ \({n_{S{O_3}}} = \dfrac{{{n_{{H_2}O}}}}{{{{5.10}^4}}} = \dfrac{{2,{{5.10}^6}}}{{{{5.10}^4}}} = 50(mol)\) - Bảo toàn nguyên tố S ⟹ \({n_{{H_2}S{O_4}}} = {n_{S{O_3}}} = 50(mol)\) Vậy nồng độ mol/l của axit sunfuric trong nước mưa là \({C_{M({H_2}S{O_4})}} = \dfrac{{{n_{{H_2}S{O_4}}}}}{{4,{{5.10}^4}}} = \dfrac{{50}}{{4,{{5.10}^4}}} = 0,0011(mol/l)\) Câu 31
Để xác định hàm lượng NO3- trong 200 ml nước mưa, người ta dùng Cu và H2SO4 loãng, thấy lượng đồng cần sử dụng là 1,92 mg. Biết nồng độ ion NO3- tối đa cho phép trong nước mưa dùng để ăn uống là 9 ppm (mg/l). Cho H = 1; N = 14; O = 16; S = 32; Cu = 64. Nhận định nào sau đây đúng?
Đáp án : B Phương pháp giải :
- PTHH: 3Cu + 8H+ + 2NO3- ⟶ 3Cu2+ + 2NO + 4H2O - Từ PTHH ⟹ \({n_{N{O_3}^ - }} \Rightarrow {\rm{[}}N{O_3}^ - {\rm{]}}(mg/l)\) - Xác định nhận định đúng/sai. Lời giải chi tiết :
- PTHH: 3Cu + 8H+ + 2NO3- ⟶ 3Cu2+ + 2NO + 4H2O - Theo PTHH ⟹ \({n_{N{O_3}^ - }} = \dfrac{2}{3}{n_{Cu}} = {2.10^{ - 5}}(mol) \Rightarrow {\rm{[}}N{O_3}^ - {\rm{]}} = \dfrac{{{{2.10}^{ - 5}}{{.62.10}^3}}}{{0,2}} = 6,2(mg/l)\) - Nhận thấy [NO3-] = 6,2 ppm < 9 ppm ⟹ Lượng nước mưa này có nồng độ ion NO3- trong khoảng cho phép và có thể sử dụng được ⟹ B đúng.
|




















Danh sách bình luận