Đề thi học kì 1 Hóa 10 Cánh diều - Đề số 1Các hạt cấu tạo nên hầu hết các nguyên tử làĐề bài
Câu 1 :
Các hạt cấu tạo nên hầu hết các nguyên tử là
Câu 2 :
Chọn định nghĩa đúng về đồng vị
Câu 3 :
Số electron tối đa chứa trong các phân lớp s, p, d, f lần lượt là
Câu 4 :
Nguyên tử M có cấu hình electron ở lớp ngoài cùng là 3s23p5. Nguyên tử M là
Câu 5 :
Nguyên tố X có số hiệu nguyên tử là 14. Nguyên tố X thuộc nhóm
Câu 6 :
Nguyên tố Y có số hiệu nguyên tử là 24, A thuộc nhóm
Câu 7 :
Số đơn vị điện tích hạt nhân của nguyên tử có kí hiệu \({}_{11}^{23}Na\) là
Câu 8 :
Số khối của nguyên tử bằng tổng
Câu 9 :
Nhận định nào không đúng về hai nguyên tử \(_{{\rm{29}}}^{{\rm{63}}}{\rm{Cu}}\) và \(_{{\rm{29}}}^{{\rm{65}}}{\rm{Cu}}\)là
Câu 10 :
Cho cấu hình electron nguyên tử các nguyên tố sau: a) 1s22s1 b) 1s22s22p63s23p1 c) 1s22s22p5 d) 1s22s22p63s23p4 e) 1s22s22p63s2 Cấu hình của các nguyên tố phi kim là
Câu 11 :
Ở trạng thái cơ bản, nguyên tử của nguyên tố X có 4 electron ở lớp L (lớp thứ hai). Số proton có trong nguyên tử X là
Câu 12 :
Hãy cho biết lớp N có thể chứa tối đa số electron là
Câu 13 :
Phát biểu đúng là
Câu 14 :
Một nguyên tử R có tổng số hạt p, n, e là 115. Số hạt mang điện nhiều hơn số hạt không mang điện là 25 hạt. Tên nguyên tố R là
Câu 15 :
Cho hai nguyên tố X và Y (MX < MY) thuộc 2 nhóm A liên tiếp nhau trong một chu kì của bảng tuần hoàn và có tổng số đơn vị điện tích hạt nhân bằng 39. Vị trí của Y trong bảng tuần hoàn là
Câu 16 :
X và Y là hai nguyên tố ở cùng một nhóm và thuộc hai chu kì liên tiếp. Tổng số proton trong hai hạt nhân nguyên tử của X,Y bằng 32. Cấu hình electron của X và Y là
Câu 17 :
Cho 2 nguyên tố X và Y cùng nằm trong một nhóm A của hai chu kì nhỏ liên tiếp (ZX < ZY). Tổng số đơn vị điện tích hạt nhân của X và Y là 24. Phát biểu đúng về X và Y là
Câu 18 :
Biết rằng nguyên tố agon có ba đồng vị khác nhau, ứng với số khối 36; 38 và A. Phần trăm các đồng vị tương ứng lần lượt bằng : 0,34% ; 0,06% và 99,6%. Số khối A của đồng vị thứ 3 của nguyên tố agon là (biết nguyên tử khối trung bình của agon bằng 39,98)
Câu 19 :
Khi cho 10 gam một kim loại R thuộc nhóm IIA tác dụng hết với nước tạo ra 0,25 mol khí hiđro. Kim loại R là
Câu 20 :
Theo quy tắc octet (bát tử): Trong quá trình hình thành liên kết hóa học, nguyên tử các nguyên tố nhóm A có xu hướng tạo thành lớp vỏ ngoài cùng có
Câu 21 :
H2O có nhiệt độ sôi cao hơn H2S là vì
Câu 22 :
Liên kết trong hợp chất nào dưới đây thuộc loại liên kết ion (biết độ âm điện của Cl(3,16), Al(1,61), Ca(1), S (2,58))
Câu 23 :
Cho các phân tử: H2, CO2, HCl, Cl2. Có bao nhiêu phân tử có cực?
Câu 24 :
Công thức Lewis nào sau đây viết sai?
Câu 25 :
Cho các hợp chất sau: Na2O ; H2O ; HCl ; Cl2 ; O3 ; CH4. Có bao nhiêu chất mà trong phân tử chứa liên kết cộng hóa trị không phân cực?
Lời giải và đáp án
Câu 1 :
Các hạt cấu tạo nên hầu hết các nguyên tử là
Đáp án : B Phương pháp giải :
Dựa vào cấu tạo của nguyên tử Lời giải chi tiết :
Các hạt cấu tạo nên nguyên tử là hạt proton, neutron và electron Đáp án B
Câu 2 :
Chọn định nghĩa đúng về đồng vị
Đáp án : D Phương pháp giải :
Dựa vào khái niệm của đồng vị Lời giải chi tiết :
Đồng vị là những nguyên tố có cùng số proton, khác nhau số neutron Đáp án D
Câu 3 :
Số electron tối đa chứa trong các phân lớp s, p, d, f lần lượt là
Đáp án : D Phương pháp giải :
Dựa vào sự phân bố electron trên các phân lớp Lời giải chi tiết :
Số electron tối đa trên các phân lớp s, p, d, f lần lượt là 2, 6, 10, 14 Đáp án D
Câu 4 :
Nguyên tử M có cấu hình electron ở lớp ngoài cùng là 3s23p5. Nguyên tử M là
Đáp án : C Phương pháp giải :
Dựa vào cấu hình electron của nguyên tử Lời giải chi tiết :
Nguyên tử M có cấu hình: 1s22s22p63s23p5 có tổng 17 electron Đáp án C
Câu 5 :
Nguyên tố X có số hiệu nguyên tử là 14. Nguyên tố X thuộc nhóm
Đáp án : D Phương pháp giải :
Dựa vào số hiệu nguyên tử = số p = số e Lời giải chi tiết :
Nguyên tố X có số Z = 14 => ô số 14, chu kì 3, nhóm IVA Đáp án D
Câu 6 :
Nguyên tố Y có số hiệu nguyên tử là 24, A thuộc nhóm
Đáp án : D Phương pháp giải :
Dựa vào số hiệu nguyên tử = số p = số e Lời giải chi tiết :
Nguyên tố Y có số hiệu nguyên tử là 24 => A thuộc nhóm VIB Đáp án D
Câu 7 :
Số đơn vị điện tích hạt nhân của nguyên tử có kí hiệu \({}_{11}^{23}Na\) là
Đáp án : D Phương pháp giải :
Số điện tích hạt nhân = số Z Lời giải chi tiết :
Z = 11 Đáp án D
Câu 8 :
Số khối của nguyên tử bằng tổng
Đáp án : A Phương pháp giải :
Số khối của nguyên tử bằng tổng số p và n Lời giải chi tiết :
Đáp án A
Câu 9 :
Nhận định nào không đúng về hai nguyên tử \(_{{\rm{29}}}^{{\rm{63}}}{\rm{Cu}}\) và \(_{{\rm{29}}}^{{\rm{65}}}{\rm{Cu}}\)là
Đáp án : A Phương pháp giải :
Dựa vào khái niệm của đồng vị Lời giải chi tiết :
Hai nguyên tử có cùng số proton, khác nhau về số neutron => là đồng vị của nhau Đáp án A
Câu 10 :
Cho cấu hình electron nguyên tử các nguyên tố sau: a) 1s22s1 b) 1s22s22p63s23p1 c) 1s22s22p5 d) 1s22s22p63s23p4 e) 1s22s22p63s2 Cấu hình của các nguyên tố phi kim là
Đáp án : C Phương pháp giải :
Các nguyên tố phi kim thường có 5, 6, 7 electron lớp ngoài cùng Lời giải chi tiết :
a) có 3e lớp ngoài cùng => kim loại b) có 3e lớp ngoài cùng => kim loại c) có 7e lớp ngoài cùng => phi kim d) có 6e lớp ngoài cùng => phi kim e) có 2e lớp ngoài cùng => kim loại đáp án C
Câu 11 :
Ở trạng thái cơ bản, nguyên tử của nguyên tố X có 4 electron ở lớp L (lớp thứ hai). Số proton có trong nguyên tử X là
Đáp án : C Phương pháp giải :
Lớp K có tối đa 2 electron Lớp L có tối đa 8 electron Lời giải chi tiết :
Vì nguyên tử X có 4 electron lớp L, và 2 electron lớp X => có tổng 6 electron Đáp án C
Câu 12 :
Hãy cho biết lớp N có thể chứa tối đa số electron là
Đáp án : D Phương pháp giải :
Lớp N là lớp thứ 4 có tối đa 32 electron Lời giải chi tiết :
Đáp án D
Câu 13 :
Phát biểu đúng là
Đáp án : D Phương pháp giải :
Dựa vào kiến thức về nguyên tử Lời giải chi tiết :
Nguyên tố M có Z = 11 => M là Na thuộc chu kì 3, nhóm IA Đáp án D
Câu 14 :
Một nguyên tử R có tổng số hạt p, n, e là 115. Số hạt mang điện nhiều hơn số hạt không mang điện là 25 hạt. Tên nguyên tố R là
Đáp án : B Lời giải chi tiết :
Ta có : p + n + e = 115 P + e = n + 25 => n = 45 ; p = e = 35 Đáp án B
Câu 15 :
Cho hai nguyên tố X và Y (MX < MY) thuộc 2 nhóm A liên tiếp nhau trong một chu kì của bảng tuần hoàn và có tổng số đơn vị điện tích hạt nhân bằng 39. Vị trí của Y trong bảng tuần hoàn là
Đáp án : A Phương pháp giải :
Vì X và Y thuộc 2 nhóm A nên tiếp nên PX – PY = 1 Lời giải chi tiết :
Vì tổng số đơn vị điện tích hạt nhân bằng 39 => PX + PY = 39 Vì X và Y thuộc 2 nhóm A nên tiếp nên PX – PY = 1 PX = 20; PY = 19 Vậy Y là K thuộc chu kì 4 nhóm IA Đáp án A
Câu 16 :
X và Y là hai nguyên tố ở cùng một nhóm và thuộc hai chu kì liên tiếp. Tổng số proton trong hai hạt nhân nguyên tử của X,Y bằng 32. Cấu hình electron của X và Y là
Đáp án : D Phương pháp giải :
Dựa vào X, Y thuộc cùng một nhóm và thuộc hai chu kì liên tiếp Lời giải chi tiết :
Vì X và Y là hai nguyên tố ở cùng một nhóm và thuộc hai chu kì liên tiếp nên PY – PX = 8 Tổng số proton trong hai hạt nhân nguyên tử X, Y bằng 32 => PX + PY = 32 PX = 12; PY = 20 Cấu hình X và Y là: 1s22s22p63s2 và 1s22s22p63s23p64s2 Đáp án D
Câu 17 :
Cho 2 nguyên tố X và Y cùng nằm trong một nhóm A của hai chu kì nhỏ liên tiếp (ZX < ZY). Tổng số đơn vị điện tích hạt nhân của X và Y là 24. Phát biểu đúng về X và Y là
Đáp án : A Lời giải chi tiết :
Gọi ZX, ZY lần lượt là số proton của nguyên tử nguyên tố X và Y. Ta có: ZX + ZY = 32 (1) Vì X và Y thuộc cùng nhóm A ở hai chu kì kế tiếp nhau nên số proton của chúng khác nhau 8, 18 hoặc 32 đơn vị. Giả sử ZY > ZX. Trường hợp 1: ZY – ZX = 8 (2) Kết hợp (1) và (2) giải hệ phương trình ta được: ZX = 12; ZY = 20. Cấu hình electron của X: 1s22s22p63s2 (nhóm IIA). Cấu hình electron của Y: 1s22s22p63s23p64s2 (nhóm IIA). Vậy trường hợp 1 thỏa mãn, X là magnesium (Mg) và Y là calcium (Ca). Trường hợp 2: ZY – ZX = 18 (3) Kết hợp (1) và (3) giải hệ phương trình ta được: ZX = 7; ZY = 25. Cấu hình electron của X: 1s22s22p3 (nhóm VA) Cấu hình electron của Y: 1s22s22p63s23p63d54s2 (nhóm VIIB) Vậy trường hợp 2 không thỏa mãn. Trường hợp 3: ZY – ZX = 32 (4) Kết hợp (1) và (4) giải hệ phương trình ta được: ZX = 0; ZY = 32. Vậy trường hợp 3 không thỏa mãn.
Câu 18 :
Biết rằng nguyên tố agon có ba đồng vị khác nhau, ứng với số khối 36; 38 và A. Phần trăm các đồng vị tương ứng lần lượt bằng : 0,34% ; 0,06% và 99,6%. Số khối A của đồng vị thứ 3 của nguyên tố agon là (biết nguyên tử khối trung bình của agon bằng 39,98)
Đáp án : A Phương pháp giải :
Dựa vào công thức tính nguyên tử khối trung bình Lời giải chi tiết :
Gọi số khối của đồng vị thứ 3 của agon là x Ta có : \(\begin{array}{l}\bar A = \frac{{36.0,34 + 38.0,06 + x.99,6}}{{100}} = 39,98\\ \to x = 39,99 \approx 40\end{array}\) Đáp án A
Câu 19 :
Khi cho 10 gam một kim loại R thuộc nhóm IIA tác dụng hết với nước tạo ra 0,25 mol khí hiđro. Kim loại R là
Đáp án : B Phương pháp giải :
Dựa vào số mol của H2 để tính nguyên tử khối của R Lời giải chi tiết :
\(\begin{array}{l}R + 2{H_2}O \to R{(OH)_2} + {H_2}\\{\rm{ 0,25 }} \leftarrow {\rm{ 0,25}}\\{{\rm{M}}_R} = \frac{{10}}{{0,25}} = 40(Ca)\end{array}\) Đáp án B
Câu 20 :
Theo quy tắc octet (bát tử): Trong quá trình hình thành liên kết hóa học, nguyên tử các nguyên tố nhóm A có xu hướng tạo thành lớp vỏ ngoài cùng có
Đáp án : C Phương pháp giải :
Dựa vào kiến thức về quy tắc octet Lời giải chi tiết :
Theo quy tắc octet, các nguyên tố nhóm A có xu hướng tạo thành lớp vỏ ngoài cùng có 8 electron tương ứng với khí hiếm gần nhất (hoặc 2 electron với khí hiếm helium) Đáp án C
Câu 21 :
H2O có nhiệt độ sôi cao hơn H2S là vì
Đáp án : C Phương pháp giải :
Giải thích dựa trên liên kết hydrogen và liên kết van der Waals Lời giải chi tiết :
H2O có nhiệt độ sôi cao hơn H2S vì H2O có liên kết hydrogen Đáp án C
Câu 22 :
Liên kết trong hợp chất nào dưới đây thuộc loại liên kết ion (biết độ âm điện của Cl(3,16), Al(1,61), Ca(1), S (2,58))
Đáp án : B Phương pháp giải :
Liên kết ion có hiệu độ âm điện \( \ge 1,7\) Lời giải chi tiết :
CaCl2 có hiệu độ âm điện bằng 2,16 > 1,7 => chứa liên kết ion Đáp án B
Câu 23 :
Cho các phân tử: H2, CO2, HCl, Cl2. Có bao nhiêu phân tử có cực?
Đáp án : A Phương pháp giải :
Liên kết cộng hóa trị phân cực có: \(0,4 \le \Delta \chi < 1,7\) Lời giải chi tiết :
HCl có hiệu độ âm điện nằm trong khoảng 0,4 – 1,7 => là liên kết cộng hóa trị phân cực Đáp án A
Câu 24 :
Công thức Lewis nào sau đây viết sai?
Đáp án : B Phương pháp giải :
Công thức Lewis biểu thị sự góp chung electron để tạo thành liên kết và dùng dấu – để thể hiện cho liên kết, các electron chưa liên kết được biểu thị bằng dấu “.” Lời giải chi tiết :
Đáp án B
Câu 25 :
Cho các hợp chất sau: Na2O ; H2O ; HCl ; Cl2 ; O3 ; CH4. Có bao nhiêu chất mà trong phân tử chứa liên kết cộng hóa trị không phân cực?
Đáp án : B Phương pháp giải :
Liên kết cộng hóa trị không phân cực có: \(\Delta \chi < 0,4\) Lời giải chi tiết :
Cl2, O3, CH4 chứa liên kết cộng hóa trị không phân cực Đáp án B
|














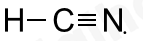










Danh sách bình luận