Đề thi học kì 2 Hóa 10 Cánh diều - Đề số 7Phát biểu nào sau đây là không đúng ?Đề bài
I. Trắc nghiệm
Câu 1 :
Phát biểu nào sau đây là không đúng ?
Câu 2 :
Khi cho 100mL dung dịch KOH 1M vào 100 mL dung dịch HCl thì phản ứng xảy ra vừa đủ. Nồng độ mol của HCl trong dung dịch đã dùng là
Câu 3 :
Khí oxygen được điều chế trong phòng thí nghiệm bằng cách nhiệt phân potassium chlorate. Để thí nghiệm thành công và rút ngắn thời gian tiến hành có thể dùng một số biện pháp sau (1) Dùng chất xúc tác manganese dioxide. (2) Nung ở nhiệt độ cao. (3) Dùng phương pháp dời nước để thu khí oxygen. (4) Đập nhỏ potassium chlorate. (5) Trộn đều bột potassium chlorate và xúc tác. Số biện pháp dùng để tăng tốc độ phản ứng là
Câu 4 :
Phát biểu nào sau đây là đúng ?
Câu 5 :
Trong phản ứng FeS2 tác dụng với HNO3 tạo ra sản phẩm Fe(NO3)3, NO và H2O, H2SO4 thì một phân tử FeS2 sẽ
Câu 6 :
Cho phản ứng tert – butyl chloride (tert – C4H9CI) với nước: C4H9CI (l) + H2O (l) ⟶ C4H9OH (aq) + HCl (aq) Tính tốc độ trung bình của phản ứng theo tert – butyl chloride, với nồng độ ban đầu là 0,22 M, sau 4s, nồng độ còn lại 0,10 M.
Câu 7 :
Trong các phát biểu sau, phát biểu nào sau đúng ?
Câu 8 :
Từ số liệu bảng enthalpy tạo thành chuẩn, hãy xác định biến thiên enthalpy chuẩn của phản ứng đốt cháy ethane: C2H6 (g) + \(\frac{7}{2}\)O2 (g) → 2CO2 (g) + 3H2O (l) Biết nhiệt tạo thành chuẩn của các chất trên cho ở bảng sau đây :
Câu 9 :
Đốt cháy hết 13,6g hỗn hợp Mg, Fe trong bình khí chlorine dư, sau phản ứng thấy thể tích khí chlorine giảm 9,916 L (đkc). Khối lượng muối chloride khan thu được là
Câu 10 :
Một phản ứng có hệ số nhiệt độ Van’t Hoff bằng 3,5. Ở 15 °C, tốc độ của phản ứng này bằng 0,2 M s-1. Tốc độ của phản ứng ở 40 °C là :
Câu 11 :
Nguyên tử carbon vừa có khả năng thể hiện tính oxi hoá, vừa có khả năng thể hiện tính khử trong chất nào sau đây?
Câu 12 :
Khi nghiên cứu ảnh hưởng của nhiệt độ tới tốc độ của phản ứng giữa Mg(s) với HCl(aq), những mô tả nào sau đây phản ánh đúng hiện tượng quan sát được khi làm thí nghiệm? (1) Khi đun nóng, bọt khí thoát ra nhanh hơn so với không đun nóng. (2) Khi đun nóng, bọt khí thoát ra chậm hơn so với không đun nóng. (3) Khi đun nóng, dây Mg tan nhanh hơn so với không đun nóng. (4) Khi đun nóng, dây Mg tan chậm hơn so với không đun nóng.
Câu 13 :
Dung dịch muối X không màu, tác dụng với dung dịch silver nitrate, sản phẩm có chất kết tủa màu vàng đậm. Dung dịch muối X là
Câu 14 :
Yếu tố nào dưới đây không ảnh hưởng đến tốc độ phản ứng ?
Câu 15 :
Ở nhiệt độ cao và có xúc tác, phản ứng giữa hydrogen với halogen nào sau đây xảy ra thuận nghịch?
II. Câu hỏi đúng sai
Câu 1 :
Cho các phát biểu sau: a) Hydrochloric acid được sử dụng cho quá trình thuỷ phân các chất trong sản xuất, chế biến thực phẩm.
Đúng
Sai
b) Hydrofluoric acid hoặc hydrogen fluoride phản ứng với chlorine dùng để sản xuất fluorine.
Đúng
Sai
c) Trong công nghiệp, hydrofluoric acid dùng tẩy rửa các oxide của sắt trên bề mặt của thép.
Đúng
Sai
d) Hydrogen fluoride được dùng để sản xuất chất làm lạnh hydrochlorofluorocarbon HCFC (thay thế chất CFC), chất chảy cryolite, …
Đúng
Sai
Câu 2 :
Cho các phát biểu sau a) Trong phản ứng điều chế nước Javel bằng chlorine và sodium hydroxide, chlorine vừa đóng vai trò chất oxi hoá, vừa đóng vai trò chất khử.
Đúng
Sai
b) Fluorine có số oxi hoá bằng -1 trong các hợp chất.
Đúng
Sai
c) Tất cả các muối halide của bạc (AgF, AgCl, AgBr, AgI) đều là những chất không tan trong nước ở nhiệt độ thường.
Đúng
Sai
d) Ở cùng điều kiện áp suất, hydrogen fluoride (HF) có nhiệt độ sôi cao nhất trong các hydrogen halide là do liên kết H – F bền nhất trong các liên kết H – X.
Đúng
Sai
Câu 3 :
Cho các phát biểu sau a) Tốc độ của mọi phản ứng hóa học đều tuân theo định luật tác dụng khối lượng.
Đúng
Sai
b) Hằng số tốc độ phản ứng là tốc độ của phản ứng khi nồng độ của tất cả các chất trong hỗn hợp phản ứng đều bằng nhau và bằng 1.
Đúng
Sai
c) Hằng số tốc độ của phản ứng phụ thuộc vào thời gian.
Đúng
Sai
d) Hằng số tốc độ phản ứng là tốc độ của phản ứng khi nồng độ các chất phản ứng bằng nhau và bằng 1 M.
Đúng
Sai
Câu 4 :
Cho biết phản ứng tạo thành 2 mol HCl(g) ở điều kiện chuẩn tỏa ra 184,6 kJ \({H_2}(g) + C{l_2}(g) \to 2HCl(g)\)(1) a) Nhiệt tạo thành chuẩn của HCl (g) là -184,6 kJ/mol
Đúng
Sai
b) Biến thiên enthalpy chuẩn của phản ứng (1) là -184,6 kJ
Đúng
Sai
c) Nhiệt tạo thành chuẩn của HCl(g) là -92,3 kJ/mol
Đúng
Sai
d) Biến thiên enthalpy chuẩn của phản ứng (1) là -92,3 kJ.
Đúng
Sai
III. Trắc nghiệm
Lời giải và đáp án
I. Trắc nghiệm
Câu 1 :
Phát biểu nào sau đây là không đúng ?
Đáp án : D Phương pháp giải :
Dựa vào tính chất vật lí của halogen Lời giải chi tiết :
Khí chlorine dùng để sản xuất thuốc trừ sâu trong nông nghiệp Đáp án D
Câu 2 :
Khi cho 100mL dung dịch KOH 1M vào 100 mL dung dịch HCl thì phản ứng xảy ra vừa đủ. Nồng độ mol của HCl trong dung dịch đã dùng là
Đáp án : A Phương pháp giải :
Dựa vào phản ứng giữa KOH và HCl Lời giải chi tiết :
n KOH = 0,1.1 = 0,1 mol KOH + HCl \( \to \)KCl + H2O 0,1 0,1 => CM HCl = 0,1 : 0,1 = 1M Đáp án A
Câu 3 :
Khí oxygen được điều chế trong phòng thí nghiệm bằng cách nhiệt phân potassium chlorate. Để thí nghiệm thành công và rút ngắn thời gian tiến hành có thể dùng một số biện pháp sau (1) Dùng chất xúc tác manganese dioxide. (2) Nung ở nhiệt độ cao. (3) Dùng phương pháp dời nước để thu khí oxygen. (4) Đập nhỏ potassium chlorate. (5) Trộn đều bột potassium chlorate và xúc tác. Số biện pháp dùng để tăng tốc độ phản ứng là
Đáp án : C Phương pháp giải :
Dựa vào các yếu tố ảnh hưởng đến tốc độ phản ứng
Lời giải chi tiết :
(1), (2), (4) (5) làm tăng tốc độ phản ứng Đáp án C
Câu 4 :
Phát biểu nào sau đây là đúng ?
Đáp án : B Phương pháp giải :
Dựa vào tính chhất của hydrohalic acid Lời giải chi tiết :
Ở trạng thái lỏng, giữa các phân tử HF tạo được liên kết hydrogen mạnh. Đáp án B
Câu 5 :
Trong phản ứng FeS2 tác dụng với HNO3 tạo ra sản phẩm Fe(NO3)3, NO và H2O, H2SO4 thì một phân tử FeS2 sẽ
Đáp án : A Phương pháp giải :
Dựa vào quá trình cho nhận electron Lời giải chi tiết :
\({(Fe{S_2})^o} \to F{e^{ + 3}} + 2.{S^{ + 6}} + 15e\) 1 phân tử FeS2 sẽ nhường 15 electron Đáp án A
Câu 6 :
Cho phản ứng tert – butyl chloride (tert – C4H9CI) với nước: C4H9CI (l) + H2O (l) ⟶ C4H9OH (aq) + HCl (aq) Tính tốc độ trung bình của phản ứng theo tert – butyl chloride, với nồng độ ban đầu là 0,22 M, sau 4s, nồng độ còn lại 0,10 M.
Đáp án : B Phương pháp giải :
Dựa vào công thức tính tốc độ phản ứng Lời giải chi tiết :
\(v = \frac{{0,22 - 0,1}}{4} = 0,03M/s\) Đáp án B
Câu 7 :
Trong các phát biểu sau, phát biểu nào sau đúng ?
Đáp án : B Phương pháp giải :
Dựa vào kiến thức về enthalpy tạo thành chuẩn của chất Lời giải chi tiết :
Giá trị nhiệt tạo thành chuẩn của các đơn chất bền nhất luôn bằng 0 Đáp án B
Câu 8 :
Từ số liệu bảng enthalpy tạo thành chuẩn, hãy xác định biến thiên enthalpy chuẩn của phản ứng đốt cháy ethane: C2H6 (g) + \(\frac{7}{2}\)O2 (g) → 2CO2 (g) + 3H2O (l) Biết nhiệt tạo thành chuẩn của các chất trên cho ở bảng sau đây :
Đáp án : B Phương pháp giải :
Dựa vào công thức tính biến thiên enthalpy của phản ứng Lời giải chi tiết :
\(\begin{array}{l}{\Delta _r}H_{298}^o = 2.{\Delta _f}H_{298}^oC{O_2} + 3.{\Delta _f}H_{298}^o{H_2}{\rm{O}} - {\Delta _f}H_{298}^o{C_2}{H_6}\\ = 2.( - 393,5) + 3.( - 285,84) - ( - 84,7) = - 1559,82kJ\end{array}\) Đáp án B
Câu 9 :
Đốt cháy hết 13,6g hỗn hợp Mg, Fe trong bình khí chlorine dư, sau phản ứng thấy thể tích khí chlorine giảm 9,916 L (đkc). Khối lượng muối chloride khan thu được là
Đáp án : D Phương pháp giải :
Dựa vào phương pháp bảo toàn khối lượng Lời giải chi tiết :
n Cl2 = 9,916 : 24,79 = 0,4 mol m Cl2 = 0,4 . 71 = 28,4g m muối chloride = m hỗn hợp kim loại + m Cl2 = 13,6 + 28,4 = 42g Đáp án D
Câu 10 :
Một phản ứng có hệ số nhiệt độ Van’t Hoff bằng 3,5. Ở 15 °C, tốc độ của phản ứng này bằng 0,2 M s-1. Tốc độ của phản ứng ở 40 °C là :
Đáp án : A Phương pháp giải :
Dựa vào hệ số Van’t Hoff Lời giải chi tiết :
\(\begin{array}{l}\frac{{{v_{{{40}^o}C}}}}{{{v_{{{15}^o}C}}}} = {\gamma ^{\frac{{(40 - 15)}}{{10}}}}\\ \to \frac{{{v_{{{40}^o}C}}}}{{0,2}} = 3,{5^{2,5}} \to {v_{{{40}^o}C}} = 4,6M/s\end{array}\)
Câu 11 :
Nguyên tử carbon vừa có khả năng thể hiện tính oxi hoá, vừa có khả năng thể hiện tính khử trong chất nào sau đây?
Đáp án : A Phương pháp giải :
Các nguyên tử vừa có tính oxi hóa vừa có tính khử khi có số oxi hóa chưa đạt cao nhất và thấp nhất Lời giải chi tiết :
Nguyên tử C vừa thể hiện tính oxi hóa vừa thể hiện tính khử Đáp án A
Câu 12 :
Khi nghiên cứu ảnh hưởng của nhiệt độ tới tốc độ của phản ứng giữa Mg(s) với HCl(aq), những mô tả nào sau đây phản ánh đúng hiện tượng quan sát được khi làm thí nghiệm? (1) Khi đun nóng, bọt khí thoát ra nhanh hơn so với không đun nóng. (2) Khi đun nóng, bọt khí thoát ra chậm hơn so với không đun nóng. (3) Khi đun nóng, dây Mg tan nhanh hơn so với không đun nóng. (4) Khi đun nóng, dây Mg tan chậm hơn so với không đun nóng.
Đáp án : A Phương pháp giải :
Dựa vào các yếu tố ảnh hưởng đến tốc độ phản ứng Lời giải chi tiết :
Mg tan dần, có bọt khí xuất hiện (1) và (3) là hiện tượng xảy ra khi tăng nhiệt độ Đáp án A
Câu 13 :
Dung dịch muối X không màu, tác dụng với dung dịch silver nitrate, sản phẩm có chất kết tủa màu vàng đậm. Dung dịch muối X là
Đáp án : A Phương pháp giải :
Dựa vào màu của kết tủa Lời giải chi tiết :
Sản phẩm có chất kết tủa màu vàng => Kết tủa là AgI Dung dịch muối X là NaI Đáp án A
Câu 14 :
Yếu tố nào dưới đây không ảnh hưởng đến tốc độ phản ứng ?
Đáp án : D Phương pháp giải :
Dựa vào các yếu tố ảnh hưởng đến tốc độ phản ứng Lời giải chi tiết :
Tỉ trọng của chất phản ứng không ảnh hưởng đến tốc độ phản ứng Đáp án D
Câu 15 :
Ở nhiệt độ cao và có xúc tác, phản ứng giữa hydrogen với halogen nào sau đây xảy ra thuận nghịch?
Đáp án : B Phương pháp giải :
Dựa vào phản ứng giữa hydrogen với halogen Lời giải chi tiết :
Ở nhiệt độ cao và có xúc tác, phản ứng giữa hydrogen và I2 xảy ra thuận nghịch Đáp án B
II. Câu hỏi đúng sai
Câu 1 :
Cho các phát biểu sau: a) Hydrochloric acid được sử dụng cho quá trình thuỷ phân các chất trong sản xuất, chế biến thực phẩm.
Đúng
Sai
b) Hydrofluoric acid hoặc hydrogen fluoride phản ứng với chlorine dùng để sản xuất fluorine.
Đúng
Sai
c) Trong công nghiệp, hydrofluoric acid dùng tẩy rửa các oxide của sắt trên bề mặt của thép.
Đúng
Sai
d) Hydrogen fluoride được dùng để sản xuất chất làm lạnh hydrochlorofluorocarbon HCFC (thay thế chất CFC), chất chảy cryolite, …
Đúng
Sai
Đáp án
a) Hydrochloric acid được sử dụng cho quá trình thuỷ phân các chất trong sản xuất, chế biến thực phẩm.
Đúng
Sai
b) Hydrofluoric acid hoặc hydrogen fluoride phản ứng với chlorine dùng để sản xuất fluorine.
Đúng
Sai
c) Trong công nghiệp, hydrofluoric acid dùng tẩy rửa các oxide của sắt trên bề mặt của thép.
Đúng
Sai
d) Hydrogen fluoride được dùng để sản xuất chất làm lạnh hydrochlorofluorocarbon HCFC (thay thế chất CFC), chất chảy cryolite, …
Đúng
Sai
Lời giải chi tiết :
a) đúng b) sai, F2 được sản xuất từ điện phân dung dịch KF, HF c) sai, HCl được dùng để tẩy rửa các oxide của sắt trên bề mặt của thép d) đúng
Câu 2 :
Cho các phát biểu sau a) Trong phản ứng điều chế nước Javel bằng chlorine và sodium hydroxide, chlorine vừa đóng vai trò chất oxi hoá, vừa đóng vai trò chất khử.
Đúng
Sai
b) Fluorine có số oxi hoá bằng -1 trong các hợp chất.
Đúng
Sai
c) Tất cả các muối halide của bạc (AgF, AgCl, AgBr, AgI) đều là những chất không tan trong nước ở nhiệt độ thường.
Đúng
Sai
d) Ở cùng điều kiện áp suất, hydrogen fluoride (HF) có nhiệt độ sôi cao nhất trong các hydrogen halide là do liên kết H – F bền nhất trong các liên kết H – X.
Đúng
Sai
Đáp án
a) Trong phản ứng điều chế nước Javel bằng chlorine và sodium hydroxide, chlorine vừa đóng vai trò chất oxi hoá, vừa đóng vai trò chất khử.
Đúng
Sai
b) Fluorine có số oxi hoá bằng -1 trong các hợp chất.
Đúng
Sai
c) Tất cả các muối halide của bạc (AgF, AgCl, AgBr, AgI) đều là những chất không tan trong nước ở nhiệt độ thường.
Đúng
Sai
d) Ở cùng điều kiện áp suất, hydrogen fluoride (HF) có nhiệt độ sôi cao nhất trong các hydrogen halide là do liên kết H – F bền nhất trong các liên kết H – X.
Đúng
Sai
Lời giải chi tiết :
a) đúng b) đúng c) sai, AgF tan trong nước d) đúng
Câu 3 :
Cho các phát biểu sau a) Tốc độ của mọi phản ứng hóa học đều tuân theo định luật tác dụng khối lượng.
Đúng
Sai
b) Hằng số tốc độ phản ứng là tốc độ của phản ứng khi nồng độ của tất cả các chất trong hỗn hợp phản ứng đều bằng nhau và bằng 1.
Đúng
Sai
c) Hằng số tốc độ của phản ứng phụ thuộc vào thời gian.
Đúng
Sai
d) Hằng số tốc độ phản ứng là tốc độ của phản ứng khi nồng độ các chất phản ứng bằng nhau và bằng 1 M.
Đúng
Sai
Đáp án
a) Tốc độ của mọi phản ứng hóa học đều tuân theo định luật tác dụng khối lượng.
Đúng
Sai
b) Hằng số tốc độ phản ứng là tốc độ của phản ứng khi nồng độ của tất cả các chất trong hỗn hợp phản ứng đều bằng nhau và bằng 1.
Đúng
Sai
c) Hằng số tốc độ của phản ứng phụ thuộc vào thời gian.
Đúng
Sai
d) Hằng số tốc độ phản ứng là tốc độ của phản ứng khi nồng độ các chất phản ứng bằng nhau và bằng 1 M.
Đúng
Sai
Lời giải chi tiết :
a) sai, các phản ứng đơn giản tuân theo định luật tác dụng khối lượng b) sai, Hằng số tốc độ phản ứng có giá trị đúng bằng tốc độ phản ứng khi nồng độ các chất phản ứng bằng nhau và bằng 1 M. c) sai, hằng số tốc độ phản ứng phụ thuộc vào nhiệt độ và bản chất của chất tham gia d) đúng
Câu 4 :
Cho biết phản ứng tạo thành 2 mol HCl(g) ở điều kiện chuẩn tỏa ra 184,6 kJ \({H_2}(g) + C{l_2}(g) \to 2HCl(g)\)(1) a) Nhiệt tạo thành chuẩn của HCl (g) là -184,6 kJ/mol
Đúng
Sai
b) Biến thiên enthalpy chuẩn của phản ứng (1) là -184,6 kJ
Đúng
Sai
c) Nhiệt tạo thành chuẩn của HCl(g) là -92,3 kJ/mol
Đúng
Sai
d) Biến thiên enthalpy chuẩn của phản ứng (1) là -92,3 kJ.
Đúng
Sai
Đáp án
a) Nhiệt tạo thành chuẩn của HCl (g) là -184,6 kJ/mol
Đúng
Sai
b) Biến thiên enthalpy chuẩn của phản ứng (1) là -184,6 kJ
Đúng
Sai
c) Nhiệt tạo thành chuẩn của HCl(g) là -92,3 kJ/mol
Đúng
Sai
d) Biến thiên enthalpy chuẩn của phản ứng (1) là -92,3 kJ.
Đúng
Sai
Lời giải chi tiết :
(a) sai, vì phản ứng tạo 2 mol HCl (b) đúng (c) đúng (d) sai
III. Trắc nghiệm
Lời giải chi tiết :
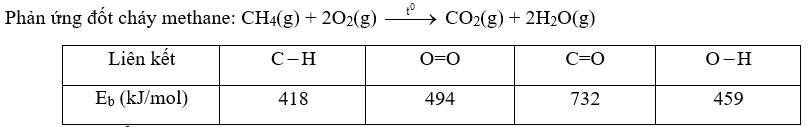
\(\begin{array}{l}{\Delta _r}H_{298}^o = 4.{E_{C - H}} + 2.{E_{O = O}} - 2.{E_{C = O}} - 2.2.{E_{O - H}}\\ = 4.418 + 2.494 - 2.732 - 4.459 = - 640kJ\end{array}\) Lời giải chi tiết :
\(v = \frac{1}{2}.\frac{{0,024 - 0,02}}{5} = {4.10^{ - 4}}\) Lời giải chi tiết :
\(\frac{{{v_{{{70}^o}C}}}}{{{v_{{{60}^o}C}}}} = {\gamma ^{\frac{{(70 - 60)}}{{10}}}} \to {v_{{{60}^o}C}} = \frac{{{{2.10}^{ - 7}}}}{{2.25}} = 8,{8.10^{ - 8}}\) Lời giải chi tiết :
n Fe = 2,8 : 56 = 0,05 mol \(F{e^o} \to F{e^{ + 3}} + 3{\rm{e}}\) 0,05 0,15 \(M{n^{ + 7}} + 5{\rm{e}} \to M{n^{ + 2}}\) 0,03\( \leftarrow \)0,15 V KMnO4 = 0,03.0,1 = 0,003 = 30ml
|























Danh sách bình luận