Đề thi giữa kì 2 Hóa 10 - Cánh diều - Đề số 5Tính số oxi hóa của S trong các hợp chất sau (viết đúng thứ tự hợp chất):Đề bài
I. Trắc nghiệm
Câu 1 :
Tính số oxi hóa của S trong các hợp chất sau (viết đúng thứ tự hợp chất): Cu2S, FeS2, NaHSO4, (NH4)2S2O8, Na2SO3
Câu 2 :
Cho biết trong phản ứng sau: 4HNO3đặc nóng + Cu → Cu(NO3)2 + 2NO2 + 2H2O. HNO3 đóng vai trò là:
Câu 3 :
Cho phương trình phản ứng hoá học sau: 1. 4HClO3 + 3H2S → 4HCl + 3H2SO4 2. 8Fe + 30 HNO3 → 8Fe(NO3)3 + 3N2O + 15H2O 3. 16HCl + 2KMnO4 → 2KCl + 2MaCl2 + 8H2O + 5Cl2 4. Mg + CuSO4 → MgSO4 + Cu 5. 2NH3 + 3Cl2 → N2 + 6HCl Trong các phản ứng trên các chất khử là:
Câu 4 :
Phát biểu nào dưới đây không đúng?
Câu 5 :
KMnO4 + FeSO4 + H2SO4 → Fe2(SO4)3 + K2SO4 + MnSO4 + H2O. Hệ số của chất oxi hóa và chất khử trong phản ứng trên lần lượt là
Câu 6 :
Cho 20,4 gam hỗn hợp A gồm Al, Zn và Fe tác dụng với dung dịch HCl dư, thu được 11,15 lít H2. Mặt khác 0,2 mol A tác dụng vừa đủ với 6,817 lít Cl2. Tính khối lượng của Al trong hỗn hợp A (biết khí đo được ở đktc)
Câu 7 :
Phản ứng tỏa nhiệt có
Câu 8 :
Cho phương trình nhiệt hóa học sau: \({H_2}(g) + {I_2}(g) \to 2HI(g){\rm{ }}\Delta {\rm{H = 11,3kJ}}\) Phát biểu nào sau đây về sự trao đổi năng lượng của phản ứng trên là đúng?
Câu 9 :
Phản ứng nào sau đây là phản ứng tỏa nhiệt
Câu 10 :
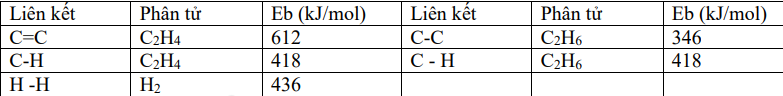
Cho phản ứng hydrogen hóa ethylene sau: \({H_2}C = C{H_2}(g) + {H_2}(g) \to {H_3}C - C{H_3}(g)\). Biết năng lượng liên kết trong các chất cho trong bảng sau:
Biến thiên enthalpy (kJ) của phản ứng có giá trị là:
Câu 11 :
Khí hydrogen và khí oxygen sẽ gây nổ theo tỉ lệ mol tương ứng là 2:1 khi xảy ra phản ứng như sau: 2H2(g) + O2(g) \( \to \)2H2O(l) \({\Delta _r}H_{298}^0\) của phản ứng năng lượng liên kết là:
Câu 12 :
Cho phương trình nhiệt hóa học sau: P(s, đỏ) \( \to \)P(s, trắng) \({\Delta _r}H_{298}^0 = 17,6kJ\) Phát biểu nào sau đây về sự trao đổi năng lượng của phản ứng trên là không đúng?
Câu 13 :
Phản ứng tổng hợp ammonia: \({N_2}(g) + 3{H_2}(g) \to 2N{H_3}(g){\rm{ }}{\Delta _{\rm{r}}}{\rm{H}}_{298}^0 = - 92kJ\) Biết năng lượng liên kết (kJ/mol) của \(N \equiv N\)và H – H lần lượt là 946 và 436. Năng lượng liên kết của N – H trong ammonia là:
Câu 14 :
: Cho phương trình nhiệt hóa học của phản ứng ứng: \(2{H_2}(g) + {O_2}(g) \to 2{H_2}{\rm{O}}(l){\rm{ }}{\Delta _{\rm{r}}}{\rm{H}}_{298}^0 = - 571,68kJ\) Lượng nhiệt tỏa ra hay thu vào khi dùng 5g H2(g) để tạo thành H2O(l) là:
Câu 15 :
Cho 16,5g Zn vào 500g dung dịch HCl 1M, dung dịch thu được có nhiệt độ tăng thêm 5oC. Giả thiết không có sự thất thoát nhiệt ra ngoài môi trường, nhiệt dung của dung dịch loãng bằng nhiệt dung của nước (4,2 J/g.K). Nhiệt lượng của phản ứng (KJ) của phản ứng giữa Zn và HCl trong dung dịch có giá trị là
II. Tự luận
Lời giải và đáp án
I. Trắc nghiệm
Câu 1 :
Tính số oxi hóa của S trong các hợp chất sau (viết đúng thứ tự hợp chất): Cu2S, FeS2, NaHSO4, (NH4)2S2O8, Na2SO3
Đáp án : D Phương pháp giải :
Dựa vào quy tắc xác định số oxi hóa Lời giải chi tiết :
Số oxi hóa của S trong Cu2S là: 2.(+1) + x = 0 => x = -2 Số oxi hóa của S trong FeS2 là: (+2).1 + 2.x = 0 => x = -1 Số oxi hóa của S trong NaHSO4 là: (+1) + (+1) + x + 4.(-2) = 0 => x = +6 Số oxi hóa của S trong (NH4)2S2O8 là: (+1).2 + 2.x + 8.(-2) = 0 => x = +7 Số oxi hóa của S trong Na2SO3 là: 2.(+1) + x + 3.(-2) = 0 => x = +4 Đáp án D
Câu 2 :
Cho biết trong phản ứng sau: 4HNO3đặc nóng + Cu → Cu(NO3)2 + 2NO2 + 2H2O. HNO3 đóng vai trò là:
Đáp án : D Phương pháp giải :
Dựa vào sự thay đổi số oxi hóa của HNO3 Lời giải chi tiết :
Trong phản ứng, HNO3 đóng vai trò là chất oxi hóa và là môi trường để thực hiện phản ứng Đáp án D
Câu 3 :
Cho phương trình phản ứng hoá học sau: 1. 4HClO3 + 3H2S → 4HCl + 3H2SO4 2. 8Fe + 30 HNO3 → 8Fe(NO3)3 + 3N2O + 15H2O 3. 16HCl + 2KMnO4 → 2KCl + 2MaCl2 + 8H2O + 5Cl2 4. Mg + CuSO4 → MgSO4 + Cu 5. 2NH3 + 3Cl2 → N2 + 6HCl Trong các phản ứng trên các chất khử là:
Đáp án : B Phương pháp giải :
Chất khử là chất nhường electron Lời giải chi tiết :
1. \({H_2}\mathop S\limits^{ - 2} \to {H_2}\mathop S\limits^{ + 6} {O_4} + 4e\) 2. \(F{e^0} \to F{e^{ + 3}} + 3{\rm{e}}\) 3. \(H\mathop {Cl}\limits^{ - 1} \to C{l^0} + 1{\rm{e}}\) 4. \(M{g^0} \to M{g^{ + 2}} + 2{\rm{e}}\) 5. \(\mathop N\limits^{ - 3} {H_3} \to {N^0} + 3e\) Đáp án B
Câu 4 :
Phát biểu nào dưới đây không đúng?
Đáp án : B Phương pháp giải :
Phản ứng oxi hóa khử là phản ứng có sự thay đổi số oxi hóa của một số nguyên tố hoặc sự trao đổi electron giữa các chất Lời giải chi tiết :
Đáp án B
Câu 5 :
KMnO4 + FeSO4 + H2SO4 → Fe2(SO4)3 + K2SO4 + MnSO4 + H2O. Hệ số của chất oxi hóa và chất khử trong phản ứng trên lần lượt là
Đáp án : C Phương pháp giải :
Cân bằng phương trình theo phương pháp thăng bằng electron Lời giải chi tiết :
\(\begin{array}{l}F{e^{ + 2}} \to F{e^{ + 3}} + 1{\rm{e|x5}}\\M{n^{ + 7}} + 5{\rm{e}} \to M{n^{ + 2}}|x1\end{array}\) 2KMnO4 + 10FeSO4 + 18H2SO4 → 5Fe2(SO4)3 + K2SO4 + 2MnSO4 + 18H2O Hệ số của chất oxi hóa 2 và hệ số chất khử là 10 Đáp án C
Câu 6 :
Cho 20,4 gam hỗn hợp A gồm Al, Zn và Fe tác dụng với dung dịch HCl dư, thu được 11,15 lít H2. Mặt khác 0,2 mol A tác dụng vừa đủ với 6,817 lít Cl2. Tính khối lượng của Al trong hỗn hợp A (biết khí đo được ở đktc)
Đáp án : D Phương pháp giải :
Dựa vào phương pháp bảo toàn electron Lời giải chi tiết :
Đặt số mol của Fe, Zn, Al lần lượt là x, y, z Ta có: 56x + 65y + 27z = 20,4 (1) Fe + 2HCl \( \to \) FeCl2 + H2 x \( \to \) x Zn + 2HCl \( \to \)ZnCl2 + H2 y \( \to \) y 2Al + 6HCl \( \to \)2AlCl3 + 3H2 z \( \to \) 3z/2 n H2 = 11,15 : 24,79 = 0,45 = x + y + 3z/2 (2) Mặt khác: số mol của X là: kx + ky + kz = 0,2 (3) 2Fe + 3Cl2 \( \to \)2FeCl3 kx\( \to \) 1,5kx Zn + Cl2 \( \to \)ZnCl2 ky \( \to \)ky 2Al + 3Cl2\( \to \)2AlCl3 kz \( \to \)1,5kz n Cl2 = 6,817 : 24,79 = 0,275 = 1,5kx + ky + 1,5kz (4) Từ (1), (2), (3), (4) ta có: \(\left\{ \begin{array}{l}x = 0,2\\y = 0,1\\z = 0,1\end{array} \right.\) m Al = 0,1 . 27 = 2,7g Đáp án D
Câu 7 :
Phản ứng tỏa nhiệt có
Đáp án : C Phương pháp giải :
Phản ứng tỏa nhiệt có \(\Delta H < 0\) Lời giải chi tiết :
Đáp án C
Câu 8 :
Cho phương trình nhiệt hóa học sau: \({H_2}(g) + {I_2}(g) \to 2HI(g){\rm{ }}\Delta {\rm{H = 11,3kJ}}\) Phát biểu nào sau đây về sự trao đổi năng lượng của phản ứng trên là đúng?
Đáp án : B Phương pháp giải :
Dựa vào năng lượng hóa học của phản ứng Lời giải chi tiết :
Phản ứng trên là phản ứng thu nhiệt, nên năng lượng chứa trong HI lớn hơn hỗn hợp H2 và I2 và tổng nhiệt phá vỡ liên kết của chất phản ứng lớn hơn nhiệt tỏa ra khi tạo thành sản phẩm Đáp án B
Câu 9 :
Phản ứng nào sau đây là phản ứng tỏa nhiệt
Đáp án : C Phương pháp giải :
Phản ứng tỏa nhiệt là phản ứng tỏa ra năng lượng dưới dạng nhiệt Lời giải chi tiết :
Phản ứng oxi hóa glucose trong cơ thể là phản ứng tỏa nhiệt Đáp án C
Câu 10 :
Cho phản ứng hydrogen hóa ethylene sau: \({H_2}C = C{H_2}(g) + {H_2}(g) \to {H_3}C - C{H_3}(g)\). Biết năng lượng liên kết trong các chất cho trong bảng sau:
Biến thiên enthalpy (kJ) của phản ứng có giá trị là:
Đáp án : B Phương pháp giải :
Dựa vào năng lượng liên kết của các chất để tính biến thiên enthalpy của phản ứng Lời giải chi tiết :
\({\Delta _r}H_{298}^0 = {E_{H2C = CH2}} + {E_{H2}} - {E_{H3C - CH3}}\)= E C=C + 4. E C – H + E H – H – E C – C – 6. E C – H = 612 + 4. 418 + 436 – 346 – 6. 418 = - 134 kJ Đáp án B
Câu 11 :
Khí hydrogen và khí oxygen sẽ gây nổ theo tỉ lệ mol tương ứng là 2:1 khi xảy ra phản ứng như sau: 2H2(g) + O2(g) \( \to \)2H2O(l) \({\Delta _r}H_{298}^0\) của phản ứng năng lượng liên kết là:
Đáp án : B Phương pháp giải :
Dựa vào công thức tính \({\Delta _r}H_{298}^0\)theo năng lượng liên kết Lời giải chi tiết :
\({\Delta _r}H_{298}^0 = 2.{E_b}({H_2}) + {E_b}({O_2}) - 2.{E_b}({H_2}{\rm{O}})\) Đáp án B
Câu 12 :
Cho phương trình nhiệt hóa học sau: P(s, đỏ) \( \to \)P(s, trắng) \({\Delta _r}H_{298}^0 = 17,6kJ\) Phát biểu nào sau đây về sự trao đổi năng lượng của phản ứng trên là không đúng?
Đáp án : B Phương pháp giải :
Dựa vào kiến thức về năng lượng hóa học của phản ứng Lời giải chi tiết :
Phản ứng trên là phản ứng thu nhiệt nên năng lượng chứa trong P trắng lớn hơn P đỏ => P đỏ bền hơn P trắng. Vì cả P đỏ và P trắng đều là đơn chất nên nhiệt tạo thành chuẩn = 0 Đáp án B
Câu 13 :
Phản ứng tổng hợp ammonia: \({N_2}(g) + 3{H_2}(g) \to 2N{H_3}(g){\rm{ }}{\Delta _{\rm{r}}}{\rm{H}}_{298}^0 = - 92kJ\) Biết năng lượng liên kết (kJ/mol) của \(N \equiv N\)và H – H lần lượt là 946 và 436. Năng lượng liên kết của N – H trong ammonia là:
Đáp án : B Phương pháp giải :
Dựa vào công thức tính \({\Delta _r}H_{298}^0\)theo năng lượng liên kết của các chất Lời giải chi tiết :
\({\Delta _r}H_{298}^0\)= E N2 + 3. E H2 – 2. ENH3 = E N2 + 3. E H-H – 2.3. E N-H = 92 => 6E N – H = 946 + 3.436 – 92 = 2162 => E N-H = 2162 : 6 = 361 KJ/mol Đáp án B
Câu 14 :
: Cho phương trình nhiệt hóa học của phản ứng ứng: \(2{H_2}(g) + {O_2}(g) \to 2{H_2}{\rm{O}}(l){\rm{ }}{\Delta _{\rm{r}}}{\rm{H}}_{298}^0 = - 571,68kJ\) Lượng nhiệt tỏa ra hay thu vào khi dùng 5g H2(g) để tạo thành H2O(l) là:
Đáp án : D Phương pháp giải :
Dựa vào \({\Delta _r}H_{298}^0\)của phản ứng Lời giải chi tiết :
n H2 = 5: 2 = 2,5 mol Lượng nhiệt tỏa ra khi dùng 2,5 mol H2(g) để tạo thành 2,5 mol H2O(l) là: 2,5 . 571,68 = 1429,2 kJ Đáp án D
Câu 15 :
Cho 16,5g Zn vào 500g dung dịch HCl 1M, dung dịch thu được có nhiệt độ tăng thêm 5oC. Giả thiết không có sự thất thoát nhiệt ra ngoài môi trường, nhiệt dung của dung dịch loãng bằng nhiệt dung của nước (4,2 J/g.K). Nhiệt lượng của phản ứng (KJ) của phản ứng giữa Zn và HCl trong dung dịch có giá trị là
Đáp án : C Phương pháp giải :
Dựa vào công thức Q = m.C.\(\Delta T\) Lời giải chi tiết :
n Zn = 16,5 : 65 = 0,254 mol n HCl = 0,5 mol Zn + 2HCl \( \to \)ZnCl2 + H2 0,254 0,5 n HCl < n Zn Q = 500.4,2.5 = 10500 J \(\Delta H = \frac{{10500}}{{0,25}} = 42000J = 42kJ\) Đáp án C
II. Tự luận
Lời giải chi tiết :
a) Vì SO2 đóng vai trò chất oxi hóa trong phản ứng trên nên gọi là phản ứng khử sulfur b) \({\Delta _r}H_{298}^0 = {\Delta _f}H_{298}^0(CaS{O_3}) + {\Delta _f}H_{298}^0(C{O_2}) - {\Delta _f}H_{298}^0(CaC{O_3}) - {\Delta _f}H_{298}^0(S{O_2})\) = -1634,9 + (-393,5) – (-1207,6) – (-296,8) = -524 kJ. Phản ứng tỏa nhiệt nên thuận lợi về mặt năng lượng c) Là phản ứng oxi hóa khử vì làm tăng số oxi hóa của sulfur từ +4 lên +6 Lời giải chi tiết :
=> m X = 8,84 – 2,52 = 6,32g Đặt số mol của O2 và Cl2 là x và y n X = 2,479 : 24,79 = 0,1 mol => x + y = 0,1 mol (1) m X = 32x + 71y = 6,32 (2) Từ (1) và (2) => \(\left\{ \begin{array}{l}x = 0,02\\y = 0,08\end{array} \right.\) %VO2 = \(\frac{{0,02}}{{0,1}}.100 = 20\% \); V Cl2 = 80% b) gọi số mol Mg và Al lần lượt là a và b mol Theo quá trình cho – nhận electron ta có: \(\begin{array}{l}M{g^0} \to M{g^{ + 2}} + 2{\rm{e}}\\A{l^o} \to A{l^{ + 3}} + 3e\end{array}\) \(\begin{array}{l}O_2^o + 4e \to {O^{ - 2}}\\Cl_2^0 + 2e \to C{l^{ - 1}}\end{array}\) Ta có: m hỗn hợp = 24a + 27b = 2,52g Theo bảo toàn electron: 2a + 3b = 0,02.4 + 0,08.2 = 0,24 => a = 0,06; b = 0,04 mol
|




















Danh sách bình luận