Lý thuyết mol và tỉ khối chất khí - Khoa học tự nhiên 8 - Kết nối tri thứcMol là lượng chất có chứa NA (6,022.10-23) nguyên tử hoặc phân tử của chất đó. Quảng cáo
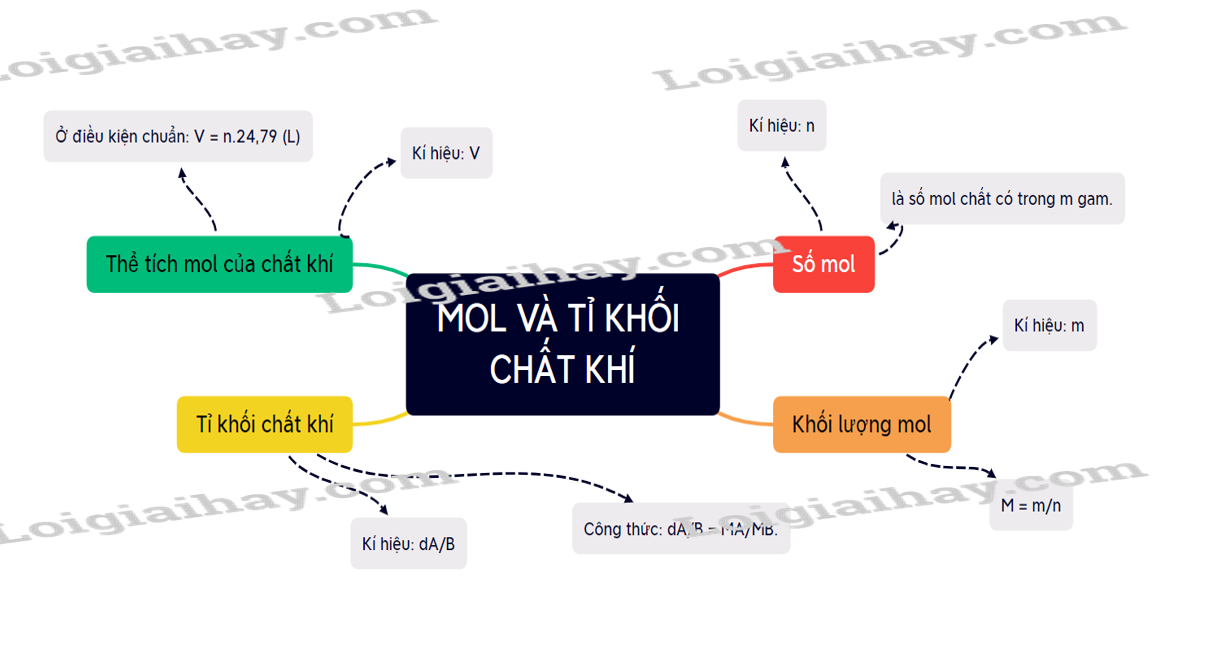
I. Mol 1. Khái niệm - Mol là lượng chất có chứa NA (6,022.1023) nguyên tử hoặc phân tử của chất đó. - NA = 6,022.1023 là số Avogadro. 2. Khối lượng mol - Kí hiệu: M - Khối lượng mol của một chất là khối lượng của NA nguyên tử hoặc phân tử chất đó tính theo đơn vị gam. - Công thức tính khối lượng mol: (với n là số mol chất có trong m gam) 3. Thể tích mol của chất khí - Thể tích mol của chất khí là thể tích chiếm bởi NA phân tử của chất khí đó. - Ở điều kiện chuẩn (25oC và 1 bar), 1mol khí đều chiếm 24,79 lít. → V = n.24,79 (L) II. Tỉ khối chất khí - Để xác định khí A nặng hay nhẹ hơn bao nhiêu lần, người ta dựa vào tỉ số khối lượng mol của khí A (MA) và khối lượng mol khí B (MB). - Công thức: dA/B = MA/MB. - Tỉ khối của khí A so với không khí: dA/kk = MA/29. Sơ đồ tư duy
|




















Danh sách bình luận