Bài 5. Định luật bảo toàn khối lượng và phương trình hóa học trang 24, 25, 26, 27 Khoa học tự nhiên 8 Kết nối tri thứcKhi các phản ứng hoá học xảy ra, lượng các chất tham gia phản ứng giảm dần, lượng các chất sản phẩm tăng dần vậy tổng khối lượng các chất trước và sau phản ứng có thay đổi không? Quảng cáo
Lựa chọn câu để xem lời giải nhanh hơn
CH tr 24 MĐ Khi các phản ứng hoá học xảy ra, lượng các chất tham gia phản ứng giảm dần, lượng các chất sản phẩm tăng dần vậy tổng khối lượng các chất trước và sau phản ứng có thay đổi không? Phương pháp giải: áp dụng định luật bảo toàn khối lượng Lời giải chi tiết: Áp dụng định luật bảo toàn khối lượng tổng khối lượng các chất sản phẩm bằng tổng khối lượng các chất tham gia phản ứng CH tr 24 CH1 So sánh tổng khối lượng của các chất trước phản ứng với tổng khối lượng các chất sau phản ứng Phương pháp giải: Dựa vào định luật bảo toàn khối lượng để trả lời câu hỏi Lời giải chi tiết: ta cốc 1 đổ vào cốc 2 sinh ra phản ứng BaCl2 + Na2SO4 BaSO4 + 2NaCl Áp dụng định luật bảo toàn khối lượng ta có mBaCl2 + mNa2SO4 = mBaSO4 + mNaCl Vậy tổng khối lượng các chất sản phẩm sau phản ứng bằng với tổng khối lượng chất sản phẩm CH tr 25 CH1 Giải thích tại sao khối lượng cacbon dyoxid bằng tổng khối lượng carbon oxygen Phương pháp giải: Áp dụng định luật bảo toàn khối lượng Lời giải chi tiết: Khối lượng carbon dioxide bằng tổng khối lượng carbon và oxygen vì trong các phản ứng hoá học, chỉ có liên kết giữa các nguyên tử C và O thay đổi, còn số nguyên tử của mỗi nguyên tổ hoá học vẫn giữ nguyên nên tổng khối lượng của các chất tham gìa phản ứng bằng tổng khối lượng của các sản phẩm. Câu 4 1. Sau khi đốt cháy than tổ ong (thành phần chính là carbon) thì thu được xỉ than. Xỉ than nặng hơn hay nhẹ hơn than tổ ong? Giải thích. 2. Vôi sống (calcium oxide) phản ứng với một số chất có mặt trong không khí như sau: Calcium oxide + Carbon dioxide ——> Calcium carbonate Calcium oxide + Nước ——> Calcium hydroxide Khi làm thí nghiệm, một học sinh quên đậy nắp lọ đựng vôi sống (thành phần chính là CaO), sau một thời gian thì khối lượng của lọ sẽ thay đổi như thế nào? Phương pháp giải: Áp dụng định luật bảo toàn khối lượng khối lượng các chất tham gia phản ứng bẳng tổng khối lượng chất sản phẩm. Dựa vào phương trình hoá học của thí nghiệm để giải thích Lời giải chi tiết: 1. Xỉ than nhẹ hơn than tổ ong. Vì Carbon đã tác dụng với oxygen trong không khí tạo thành khí carbon dioxide. Lượng khí sinh ra đã làm giảm lượng C trong than làm khối lượng xỉ than nhẹ hơn khối lượng viên than ban đầu. Carbon + oxygen ——> Carbon dioxide 2. Vôi sống (calcium oxide) phản ứng với một số chất có mặt trong không khí như sau: Calcium oxide + Carbon dioxide ——> Calcium carbonate Calcium oxide + Nước ——> Calcium hydroxide Khi làm thí nghiệm, một học sinh quên đậy nắp lọ đựng vôi sống (thành phần chính là CaO), sau một thời gian thì khối lượng của lọ sẽ tăng lên. CH tr 26 Lập phương trình hoá học a, Fe + O2 → Fe3O4 b, Al + HCl → AlCl3 + H2 c, Al2(SO4)3 + NaOH → Al(OH)3 + Na2SO4 d, CaCO3 + HCl → CaCl2 + CO2 + H2O
Phương pháp giải: Áp dụng các bước lập phương trình hoá học, cân bằng phương trình. Lời giải chi tiết: a, 6Fe + 4O2 → 2Fe3O4 b, 2Al + 6HCl → 2AlCl3 + 3H2 c, Al2(SO4)3 + 6NaOH → 2Al(OH)3 + 3Na2SO4 d, CaCO3 + 2HCl → CaCl2 + CO2 + H2O CH tr 27 CH1 Sơ đồ của phản ứng hoá học khác với phương trình hoá học ở điểm nào? Nêu ý nghĩa của phương trình hoá học. Phương pháp giải: dựa vào khái niệm về phương trình hoá học và phản ứng hoá học Lời giải chi tiết:
CH tr 27 CH2 Lập phương trình hoá học và xác định tỉ lệ số phân tử của các chất trong sơ đồ phản ứng hoá học sau: Na2CO3 + Ba(OH)2 →BaCO3 + NaOH Phương pháp giải: dựa và các bước lập phương trình hoá học đã học Lời giải chi tiết: Áp dụng các bước lập phương trình hoá học, cân bằng phương trình. PTHH: Na2CO3 + Ba(OH)2 → BaCO3 + 2NaOH Tỉ lệ số phân tử chất trong phản ứng là: Số phân tử Na2CO3 : số phân tử Ba(OH)2 : số phân tử BaCO3 : số phân tử NaOH = 1 : 1 : 1 : 2 CH tr 27 CH3 Giả thiết trong không khí sắt tác dụng với oxygen tạo thành gỉ sắt (Fe2O3). Từ 5,6 gam sắt có thể tạo ra tối đa bao nhiêu gam gỉ sắt. Phương pháp giải: Dựa vào công thức tính số mol của nguyên tử/ phân tử, các bước lập phương trình hoá học và cân bằng phương trình hoá học Lời giải chi tiết: Phương trình: Ta có tỉ lệ: Số mol Fe : số mol O2 : số mol Fe2O3 = 4 : 3 : 2 Từ tỉ lệ số mol ta xác định được tỉ lệ khối lượng các chất: Khối lượng Fe : khối lượng O2 : khối lượng Fe2O3 = (56 x 4) : (32 x 3) : (160 x 2) = 7 : 3 : 10 Vậy cứ 7 gam Fe phản ứng hết với 3 gam O2 tạo ra 10 gam Fe2O3 Do đó, từ 5,6 gam Fe có thể tạo ra tối đa (5,6 x 10) : 7 = 8 gam gỉ sắt
|














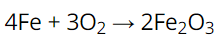






Danh sách bình luận