Lý thuyết dung dịch và nồng độ - Khoa học tự nhiên 8 - Kết nối tri thứcDung dịch là hỗn hợp đồng nhất của chất tan và dung môi. Quảng cáo
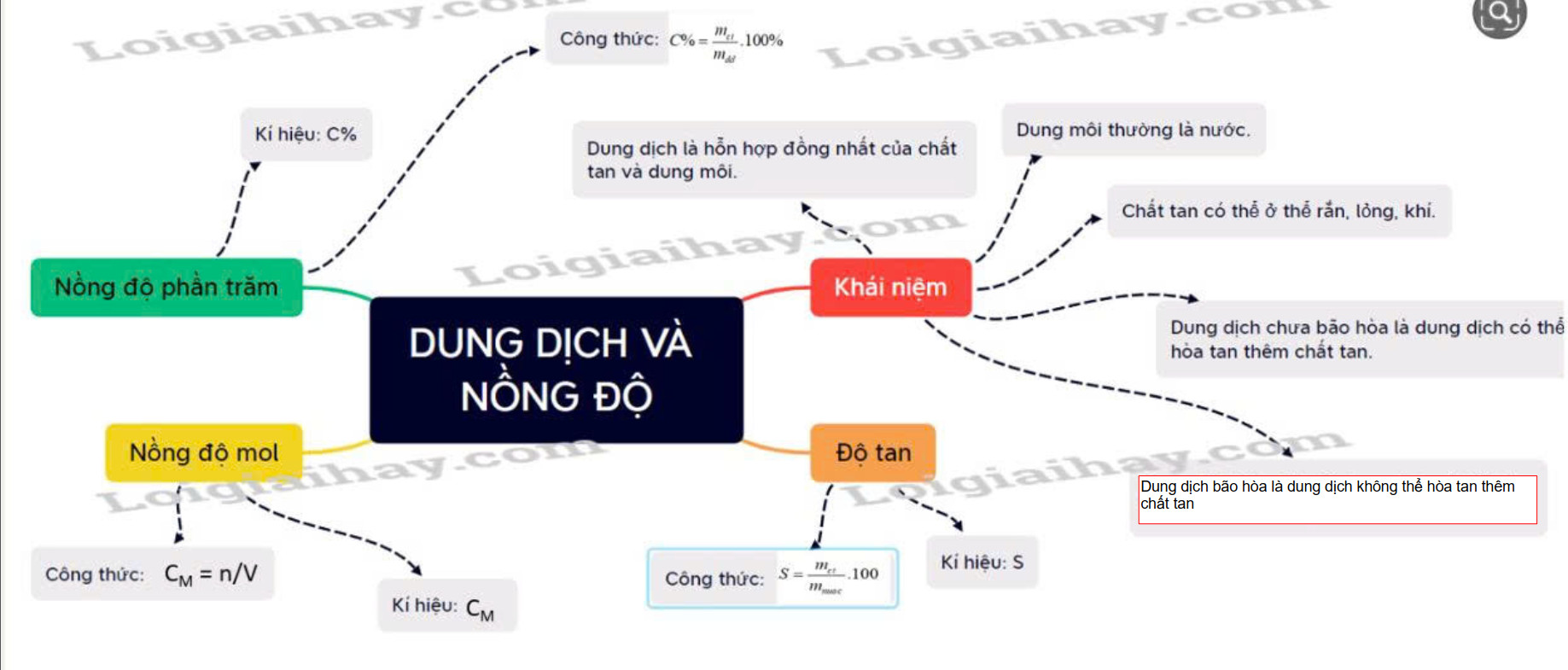
I. Dung dịch, chất tan và dung môi. - Dung dịch là hỗn hợp đồng nhất của chất tan và dung môi. - Dung môi thường là nước ở thể lỏng. - Chất tan có thể ở thể rắn, lỏng hoặc khí. - Dung dịch chưa bão hòa là dung dịch có thể hòa tan thêm chất tan. - Dung dịch bão hòa là dung dịch không thể hòa tan thêm chất tan. II. Độ tan. - Độ tan là đại lượng đặc trưng cho khả năng tan của mỗi chất. - Công thức: \(S = \frac{{{m_{ct}}}}{{{m_{nuoc}}}}.100\) Với: + S là độ tan, đơn vị g/100 gam nước. + mct là khối lượng chất tan, đơn vị là gam (g). + mnước là khối lượng nước, đơn vị là gam (g). III. Nồng độ dung dịch 1. Nồng độ phần trăm - Kí hiệu: C% - Công thức:\(C\% = \frac{{{m_{ct}}}}{{{m_{dd}}}}.100\% \) Với + C% là nồng độ phần trăm của dung dịch, đơn vị % + mct là khối lượng chất tan , đơn vị gam (g). + mdd là khối lượng dung dịch, đơn vị (g) Ta có: khối lượng dung dịch = khối lượng chất tan + khối lượng dung môi. 2. Nồng độ mol - Kí hiệu: CM - Công thức: CM = n/V Với + CM là nồng độ mol của dung dịch, đơn vị mol/l hay M. + n là số mol của chất tan, đơn vị mol. + V là thể tích dung dịch, đơn vị lít (L). Sơ đồ tư duy |




















Danh sách bình luận