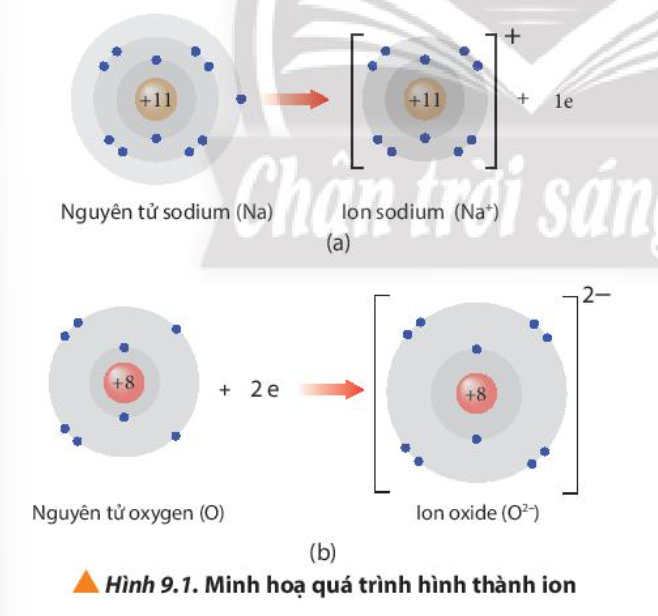
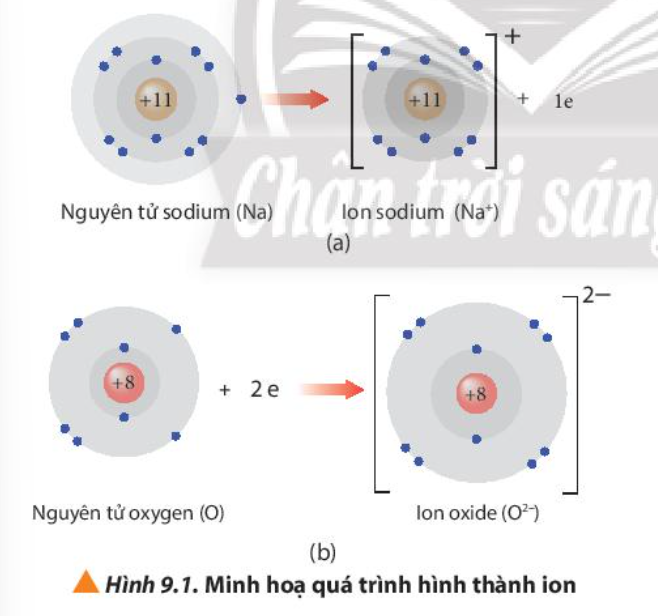
Bài 9. Liên kết ion trang 55, 56, 57, 58 Hóa 10 Chân trời sáng tạoTải vềHơn 50% dược phẩm sử dụng trong y tế được sản xuất dưới dạng muối với mục đích thúc đẩy sự hấp thu các dược chất vào máu, tăng cường hiệu quả điều trị. Quan sát Hình 9.1, nhận xét số electron trên lớp vỏ với số proton trong hạt nhân của mỗi ion tạo thành Quảng cáo
Lựa chọn câu để xem lời giải nhanh hơn
Tải về
CH tr 55 MĐ
Lời giải chi tiết: - Liên kết ion là liên kết được hình thành bởi lực hút tĩnh điện giữa các ion mang điện tích trái dấu - Liên kết ion thường được hình thành khi kim loại điển hình tác dụng với phi kim điển hình CH tr 55 CH
Phương pháp giải: Quan sát Hình 9.1 và rút ra nhận xét Lời giải chi tiết: - Ion sodium: có 10 electron ở lớp vỏ và 11 proton trong hạt nhân - Ion oxide: có 10 electron ở lớp vỏ và 8 proton trong hạt nhân CH tr 55 CH
Phương pháp giải: Cách tính: điện tích ion = số đơn vị điện tích hạt nhân – số electron của ion Lời giải chi tiết: - Các tích điện tích của ion thu được khi nguyên tử nhường hoặc nhận thêm electron: Điện tích ion = số đơn vị điện tích hạt nhân – số electron của ion - Ví dụ: + Ion sodium: điện tích = 11 – 10 = 1 => Điện tích là +1 + Ion oxide: điện tích = 8 – 10 = -2 => Điện tích là -2 CH tr 55 CH
Phương pháp giải: Nguyên tố, ion có cấu hình electron giống của khí hiếm => bền vững về mặt hóa học Lời giải chi tiết: - Ion Na+ có 10 electron ở lớp vỏ và có 2 lớp electron => Giống cấu hình electron nguyên tử của nguyên tố Ne => Bền vững về mặt hóa học - Ion O2- có 10 electron ở lớp vỏ và có 2 lớp electron => Giống cấu hình electron nguyên tử của nguyên tố Ne => Bền vững về mặt hóa học CH tr 56 CH
Phương pháp giải: - Nguyên tố kim loại dễ nhường electron - Nguyên tố phi kim dễ nhận electron Lời giải chi tiết: - Các nguyên tố kim loại dễ nhường electron => Tạo thành cation - Các nguyên tố phi kim dễ nhận electron => Tạo thành anion CH tr 56 CH
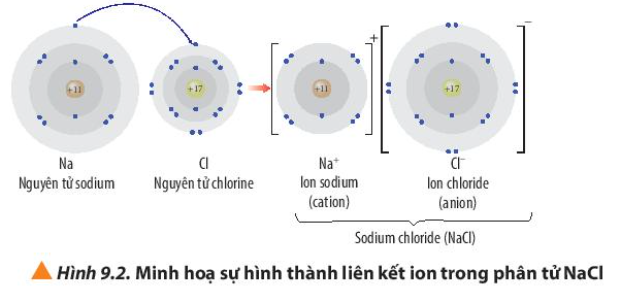
Phương pháp giải: - Kim loại sodium dễ dàng nhường 1 electron để đạt cấu hình electron bền vững của khí hiếm - Phi kim chlorine dễ dàng nhận 1 electron để đạt cấu hình electron bền vững của khí hiếm Lời giải chi tiết: - Kim loại sodium có 1 electron ở lớp ngoài cùng => Dễ dàng nhường 1 electron thành ion Na+ - Phi kim chlorine có 7 electron ở lớp ngoài cùng => Dễ dàng nhận 1 electron thành ion Cl- => Nguyên tử Cl sẽ nhận 1 electron của nguyên tử Na tạo thành Na+ và Cl-. 2 ion này sẽ liên kết với nhau tạo thành phân tử NaCl CH tr 56 CH
Phương pháp giải: - Ion Na+ có 10 electron ở lớp vỏ và có 2 lớp electron - Ion Cl- có 18 electron ở lớp vỏ và có 3 lớp electron Lời giải chi tiết: - Ion Na+ có 10 electron ở lớp vỏ và có 2 lớp electron => Giống cấu hình electron của khí hiếm Ne - Ion Cl- có 18 electron ở lớp vỏ và có 3 lớp electron => Giống cấu hình electron của khí hiếm Ar CH tr 56 LT
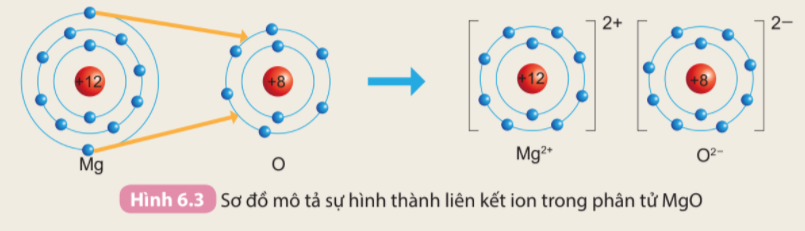
Phương pháp giải: - Nguyên tử Mg có 2 electron ở lớp vỏ ngoài cùng => Có xu hướng nhường 2 electron - Nguyên tử O có 6 electron ở lớp vỏ ngoài cùng => Có xu hướng nhận 2 electron Lời giải chi tiết: - Nguyên tử Mg (Z = 12): 1s22s22p63s2 => Có 2 electron ở lớp ngoài cùng => Có xu hướng nhường 2 electron để đạt cấu hình electron của khí hiếm tạo thành ion Mg2+ - Nguyên tử O (Z = 8): 1s22s22p4 => Có 6 electron ở lớp ngoài cùng => Có xu hướng nhận 2 electron để đạt cấu hình electron của khí hiếm tạo thành ion O2- => Nguyên tử O sẽ nhận 2 electron của nguyên tử Mg tạo thành 2 ion Mg2+ và O2-. 2 ion liên kết với nhau tạo thành phân tử MgO
CH tr 56 CH
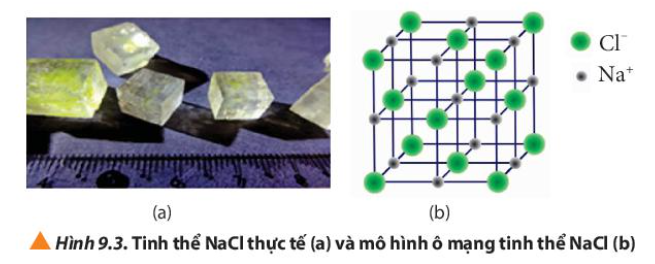
Phương pháp giải: Quan sát Hình 9.3 và rút ra nhận xét Lời giải chi tiết: a) Tinh thể NaCl có cấu trúc là hình lập phương b) Các ion Na+ và Cl- được xếp xen kẽ nhau c) Xung quanh mỗi loại ion có 6 ion ngược dấu gần nhất. Ví dụ: xung quanh ion Na+ có 6 ion Cl- CH tr 56 CH
Phương pháp giải: Tinh thể ion lớp một hợp chất ion kết tinh Lời giải chi tiết: - Tinh thể ion là hợp chất ion - Các ion liên kết với nhau nhờ lực hút tĩnh điện tạo thành hợp chất ion CH tr 57 CH
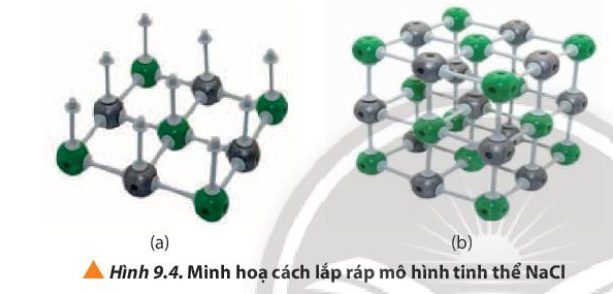
Phương pháp giải: Quan sát Hình 9.4 và rút ra nhận xét Lời giải chi tiết: - Quả cầu màu đen (Na+): 13 - Quả cầu màu xanh (Cl-): 14 - Số thanh nối: + Lớp đáy có 12 thanh nằm ngang => 3 lớp có 36 thanh nằm ngang + Mỗi lớp có 9 quả cầu => có 9 thanh dọc => có 18 thanh dọc => Tổng có 54 thanh nối CH tr 57 VD
Phương pháp giải: 58,5 gam muối ăn có 23 gam ion Na+ 5 gam muối ăn có x gam ion Na+ Lời giải chi tiết: Phân tử khối của NaCl = 23 + 35,5 = 58,5 (g/mol) 58,5 gam muối ăn có 23 gam ion Na+ 5 gam muối ăn có a gam ion Na+ => a = 5 x 23 : 58,5 = 1,965 gam = 1965 mg Ta có: 500 < 1965 < 2 300 => Nếu một người sử dụng 5,0 gam muối ăn mỗi ngày thì lượng ion Na+ mà người ấy nạp vào cơ thể không vượt mức giới hạn cho phép Bài tập 1
Phương pháp giải: - Viết cấu hình của Mg => Cấu hình electron của Mg2+
Lời giải chi tiết: Nguyên tử Mg (Z = 12): 1s22s22p63s2 => Mg2+: 1s22s22p6 => Ion Mg2+ có 10 electron và 2 lớp electron => Giống cấu hình electron của nguyên tử khí hiếm Neon Đáp án B Bài tập 2
Phương pháp giải: - Viết cấu hình của các nguyên tử => Cấu hình của các ion - Khí hiếm Ne có 10 electron ở lớp vỏ và 2 lớp electron Lời giải chi tiết: - Nguyên tử Ca (Z = 20): 1s22s22p63s23p64s2 => Cấu hình Ca2+: 1s22s22p63s23p6 - Nguyên tử F (Z = 9): 1s22s22p5 => Cấu hình F-: 1s22s22p6 - Nguyên tử Al (Z = 13): 1s22s22p63s23p1 => Cấu hình Al3+: 1s22s22p6 - Nguyên tử N (Z = 7): 1s22s22p3 => Cấu hình N3-: 1s22s22p6 - Nguyên tử khí hiếm Neon có cấu hình: 1s22s22p6 => Có 3 ion có cấu hình electron của khí hiếm Neon: F-, Al3+, N3- Đáp án D Bài tập 3
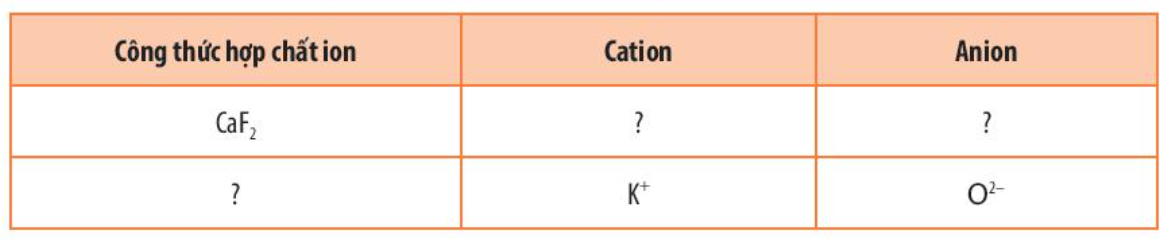
Phương pháp giải: - Nguyên tố potassium có Z = 19 => Cấu hình electron => Ion - Nguyên tử magnesium có Z = 12 => Cấu hình electron => Ion Lời giải chi tiết: a) - Nguyên tố potassium (Z = 19): 1s22s22p63s23p64s1 => Có xu hướng nhường 1 electron => Cấu hình: 1s22s22p63s23p6 (K+) => Ion K+ có 18 electron ở lớp vỏ và có 3 lớp electron => Giống cấu hình electron của khí hiếm Ar - Nguyên tố magnesium (Z = 12): 1s22s22p63s2 => Có xu hướng nhường 2 electron => Cấu hình: 1s22s22p6 (Mg2+) => Ion Mg2+ có 10 electron ở lớp vỏ và có 2 lớp electron => Giống cấu hình electron của khí hiếm Ne b) Hợp chất ion được tạo bởi 2 ion trái dấu nhau mà ion K+ và Mg2+ cùng mang dấu dương => Không có hợp chất ion nào chỉ tạo bởi 2 ion K+ và Mg2+ Bài tập 4
Lời giải chi tiết:
Bài tập 5
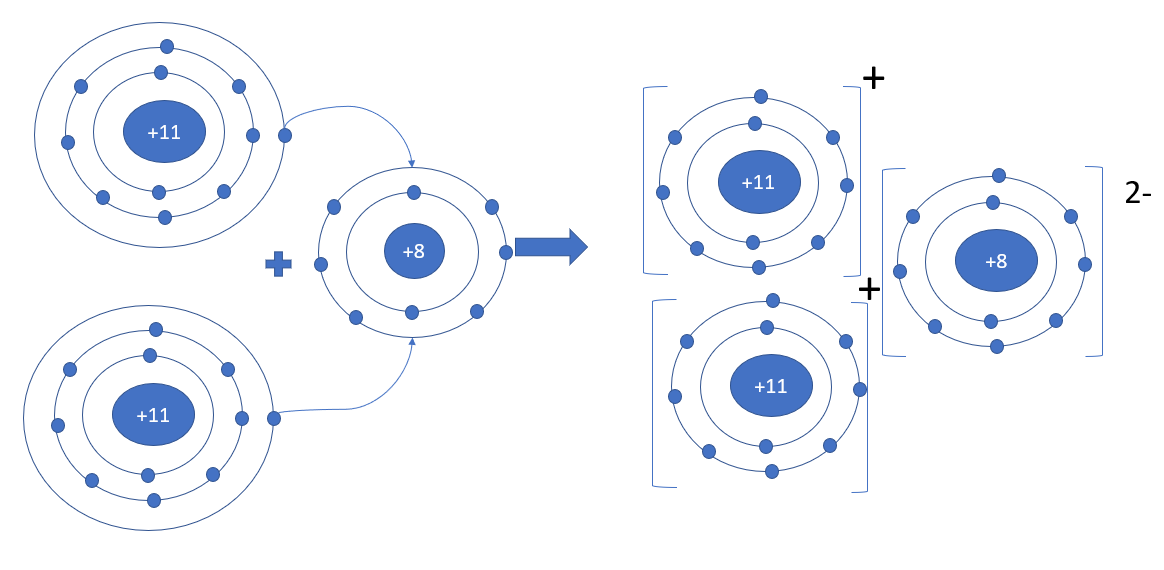
Phương pháp giải: - Viết cấu hình của nguyên tử Na => Xu hướng nhận hay nhường bao nhiêu electron - Viết cấu hình của nguyên tử O => Xu hướng nhận hay nhường bao nhiêu electron Lời giải chi tiết: - Nguyên tử Na (Z = 11): 1s22s22p63s1 => Xu hướng nhường 1 electron tạo thành ion Na+ - Nguyên tử O (Z = 8): 1s22s22p4 => Xu hướng nhận 2 electron tạo thành ion O2- => Mỗi nguyên tử Na sẽ nhường 1 electron cho nguyên tử O để tạo thành 2 ion Na+ và 1 ion O2-. 3 ion này liên kết với nhau tạo thành phân tử Na2O
|





















Danh sách bình luận