Bài 11. Liên kết hydrogen và tương tác van der Waals trang 67, 68, 69, 70, 71 Hóa 10 Chân trời sáng tạoTải vềCác nhà hóa học đã nghiên cứu và kết luận rằng nếu không có liên kết hydrogen thì nước sẽ sôi ở -80oC. 1. Giữa liên kết S-H và liên kết O-H, liên kết nào phân cực mạnh hơn? Vì sao? Quảng cáo
Lựa chọn câu để xem lời giải nhanh hơn
Tải về
CH tr 67 MĐ
Lời giải chi tiết: Liên kết mà các nguyên tử sử dụng chung các electron hóa trị để cùng thỏa mãn quy tắc octet được gọi là liên kết cộng hóa trị CH tr 67 CH
Phương pháp giải: Liên kết cộng hóa trị là liên kết được hình thành giữa hai nguyên tử bằng một hay nhiều cặp electron dùng chung Lời giải chi tiết: Nguyên tử bị thiếu bao nhiêu electron thì bỏ ra bấy nhiêu electron để góp chung electron với các nguyên tử khác => Đạt cấu hình eleectron bền vững của khí hiếm Ví dụ: - Nguyên tử O cần nhận thêm 2 electron => Bỏ ra 2 electron để góp chung - Nguyên tử Cl và H cần nhận thêm 1 electron => Mỗi nguyên tử bỏ ra 1 electron để góp chung - Nguyên tử N cần nhận thêm 3 electron => Bỏ ra 3 electron để góp chung CH tr 68 CH
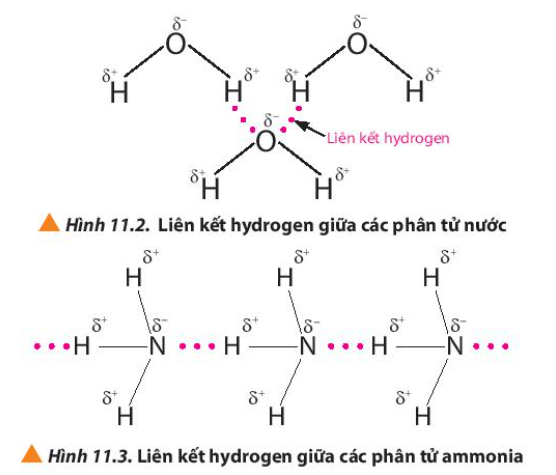
Lời giải chi tiết: Liên kết hydrogen là một loại liên kết yếu, được hình thành giữa nguyên tử H (đã liên kết với một nguyên tử có độ âm điện lớn, thường là F, O, N) với một nguyên tử khác có độ âm điện lớn (thường là F, O, N) còn cặp electron hóa trị chưa tham gia liên kết CH tr 68 CH
Phương pháp giải: - Liên kết cộng hóa trị mạnh hơn liên kết hydrogen - Liên kết ion mạnh hơn liên kết cộng hóa trị Lời giải chi tiết: Liên kết hydrogen < Liên kết cộng hóa trị < Liên kết ion CH tr 68 LT
Phương pháp giải: Liên kết hydrogen làm cho phân tử có nhiệt độ sôi cao hơn Lời giải chi tiết: H2O có nhiệt độ sôi cao hơn H2S do H2O có liên kết hydrogen liên phân tử còn H2S không có liên kết hydrogen CH tr 68 CH
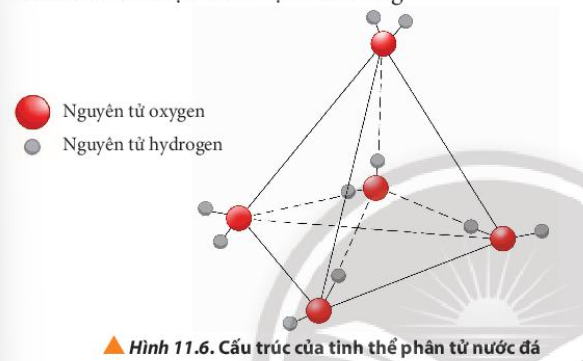
Phương pháp giải: - Liên kết hydrogen làm phân tử có nhiệt độ sôi cao và tan tốt trong nước Lời giải chi tiết: - Phân tử NH3 có khả năng liên kết hydrogen liên phân tử do N có độ âm điện cao - Phân tử CH4 không có khả năng liên kết hydrogen liên phân tử do C có độ âm điện thấp => Phân tử NH3 có nhiệt độ sôi cao hơn và khả năng hòa tan trong nước tốt hơn soi với CH4 CH tr 69 CH
Phương pháp giải: Phân tử nước có 2 H liên kết với O và O có 2 cặp electron hóa trị chưa tham gia liên kết Lời giải chi tiết: - Trong phân tử nước có 2 nguyên tử H liên kết với O => 2 nguyên tử H này tham gia liên kết hydrogen với 2 nguyên tử O của 2 phân tử nước khác - Nguyên tử O còn 2 cặp electron hóa trị chưa tham gia liên kết => Mỗi cặp electron hóa trị sẽ liên kết hydrogen với nguyên tử H của phân tử nước khác => Một phân tử nước có thể tạo được liên kết hydrogen tối đa với 4 phân tử nước CH tr 69 VD
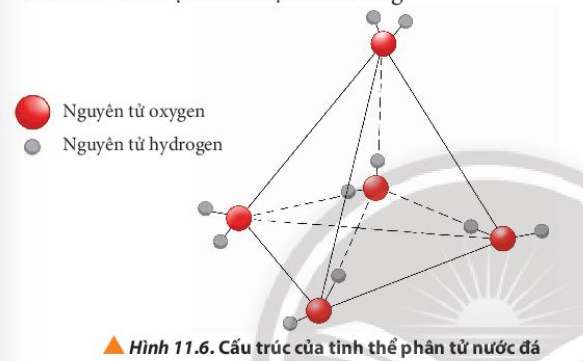
Phương pháp giải: Nước ở trạng thái rắn có thể tích lớn hơn khi ở trạng thái lỏng Lời giải chi tiết: Khi cho vào ngăn đá của tủ lạnh, nước chuyển thành trạng thái rắn có cấu trúc tinh thể phân tử với 4 phân tử H2O phân bố ở bốn đỉnh của một tứ diện đều, bên trong là rỗng => Nước ở trạng thái rắn có thể tích lớn hơn khi ở trạng thái lỏng => Làm méo và biến dạng các lon bia, chai nước giải khát CH tr 69 CH
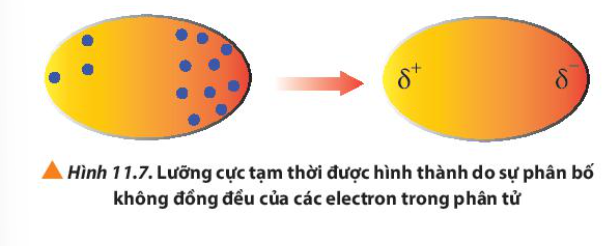
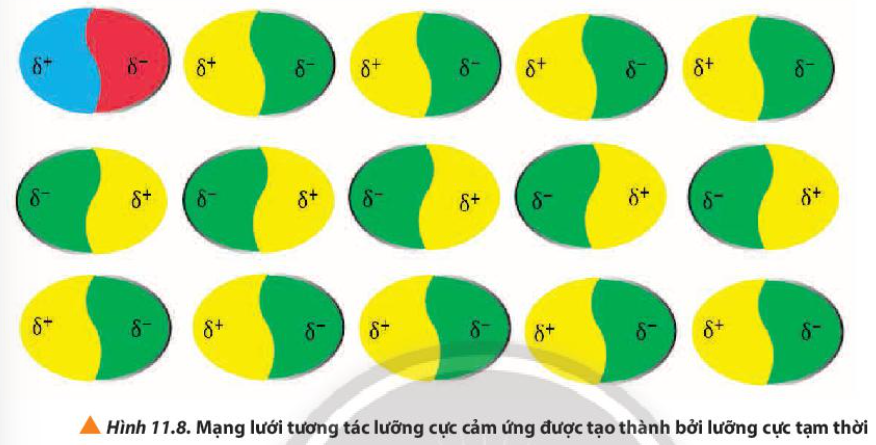
Phương pháp giải: Lưỡng cực tạm thời được hình thành do sự phân bố không đồng đều của các electron trong phân tử Lời giải chi tiết: Trong phân tử, các electron chuyển động không ngừng => Khi các electron di chuyển tập trung về một phía bất kì của phân tử sẽ hình thành nên các lượng cực tạm thời, bên nào tập trung nhiều electron hơn thì mang điện tích âm và ngược lại CH tr 70 CH
Phương pháp giải: Quan sát Hình 11.8 để trả lời câu hỏi
Lời giải chi tiết: Các lưỡng cực tạm thời và lưỡng cực cảm ứng hút nhau bằng lực ngược dấu CH tr 70 CH
Phương pháp giải: Tương tác van der Waals làm tăng nhiệt độ nóng chảy và nhiệt độ sôi của các chất. Khi khối lượng phân tử tăng, kích thước phân tử tăng thì tương tác van der Waals tăng CH tr 70 VD
Phương pháp giải: - Nước có sức căng bề mặt - Chân nhện gồm các chất kị nước (không tan trong nước) Lời giải chi tiết: - Giữa các phân tử nước hình thành lực liên kết hydrogen => Liên kết hydrogen giữa các phân tử nước trên bề mặt nước và giữa các phân tử nước trên bề mặt và lớp nước bên dưới tạo ra sức căng bề mặt cho nước - Chân của con nhện nước gồm các chất kị nước (không phân cực), phân tử các chất nảy đẩy nước khiến cho chân của nhện nước không bị nước bao bọc và tụt xuống dưới nước. Vì vậy chúng có thể di chuyển trên bề mặt nước mà không làm vỡ bề mặt nước Bài tập 1
Phương pháp giải: Liên kết hydrogen là một loại liên kết yếu, được hình thành giữa nguyên tử H (đã liên kết với một nguyên tử có độ âm điện lớn, thường là F, O, N) với một nguyên tử khác có độ âm điện lớn (thường là F, O, N) còn cặp electron hóa trị chưa tham gia liên kết Lời giải chi tiết: Liên kết hydrogen được hình thành giữa nguyên tử H (đã liên kết với một nguyên tử có độ âm điện lớn, thường là F, O, N) => H2O có thể tham gia liên kết hydrogen liên phân tử Đáp án B Bài tập 2
Phương pháp giải: Lưỡng cực tạm thời được hình thành do sự phân bố không đồng đều của các electron trong phân tử Lời giải chi tiết: Sự phân bố electron không đồng đều trong một nguyên tử hay một phân tử hình thành nên một lưỡng cực tạm thời Đáp án D Bài tập 3
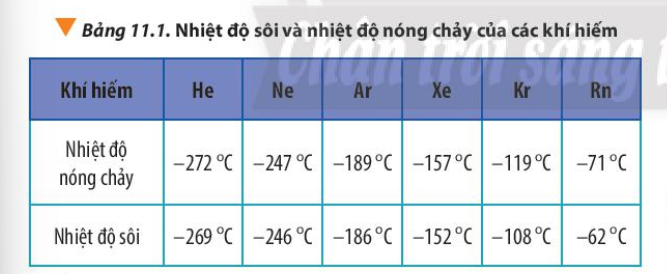
Phương pháp giải: Tương tác van der Waals làm tăng nhiệt độ nóng chảy và nhiệt độ sôi của các chất. Khi khối lượng phân tử tăng, kích thước phân tử tăng thì tương tác van der Waals tăng Lời giải chi tiết: Trong cùng 1 nhóm, đi từ trên xuống dưới, khối lượng phân tử tăng, kích thước phân tử tăng => Tương tác van der Waals tăng => Nhiệt độ sôi, nhiệt độ nóng chảy tăng => Ne có nhiệt độ sôi thấp nhất Đáp án A Bài tập 4
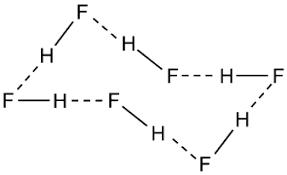
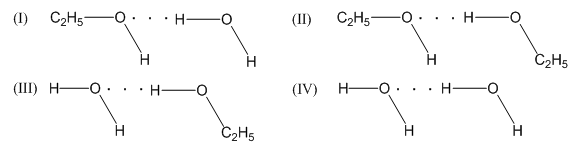
Phương pháp giải: Liên kết hydrogen là một loại liên kết yếu, được hình thành giữa nguyên tử H (đã liên kết với một nguyên tử có độ âm điện lớn, thường là F, O, N) với một nguyên tử khác có độ âm điện lớn (thường là F, O, N) còn cặp electron hóa trị chưa tham gia liên kết Lời giải chi tiết: a) Hydrogen fluoride: Nguyên tử H của phân tử HF này liên kết với nguyên tử F của phân tử HF khác (biểu diễn bằng 3 nét gạch ---) b) Ethanol (C2H5OH) và nước - Ethanol (C2H5OH) và nước tồn tại 4 kiểu liên kết hydrogen như sau + H của C2H5OH liên kết hydrogen với O của H2O (I) + H của C2H5OH này liên kết hydrogen với O của C2H5OH khác (II) + H của H2O liên kết hydrogen với O của C2H5OH (III) + H của H2O này liên kết hydrogen với O của H2O khác (IV) Bài tập 5
Phương pháp giải: Chất nào có tham gia liên kết hydrogen thì có nhiệt độ sôi và độ tan trong nước lớn hơn Lời giải chi tiết: - N có độ âm điện lớn hơn P => Phân tử NH3 có khả năng tham gia liên kết hydrogen => Phân tử NH3 có nhiệt độ sôi và độ tan trong nước lớn hơn
|






















Danh sách bình luận