Bài 15. Phương trình tốc độ phản ứng và hằng số tốc độ phản ứng trang 94, 95, 96, 97 Hóa 10 Chân trời sáng tạoTrong tự nhiên có những phản ứng xảy ra rất nhanh, như phản ứng nổ của pháo hoa, phản ứng cháy của que diêm,… 1. Quan sát hình trong phần Khởi động, nhận xét về mức độ nhanh hay chậm của phản ứng hóa học xảy ra trong đám cháy lá cây khô và thân tàu biển bị oxi hóa trong điều kiện tự nhiên Quảng cáo
Lựa chọn câu để xem lời giải nhanh hơn
CH tr 94 MĐ
Lời giải chi tiết: - Để đánh giá mức độ nhanh hay chậm của một phản ứng hóa học, người ta dùng đại lượng: tốc độ phản ứng - Cách tính: Cho phản ứng tổng quát: aA + bB → cC + dD Biểu thức tốc độ trung bình của phản ứng: Trong đó: \(\mathop v\limits^\_ \): tốc độ trung bình của phản ứng ∆C = C2 – C1: sự biến thiên nồng độ ∆t = t2 – t1: biến thiên thời gian C1, C2 là nồng độ của một chất tại 2 thời điểm tương ứng t1, t2 CH tr 94 CH
Lời giải chi tiết: - Trong đám cháy của lá cây khô: Phản ứng hóa học xảy ra nhanh. Các lá cây nhanh chóng bị cháy và chuyển thành tro - Thân tàu biển bị oxi hóa trong điều kiện tự nhiên: Phản ứng hóa học xảy ra chậm. Vỏ tàu biển làm bằng thép mất thời gian rất lâu mới bị gỉ (bị oxi hóa) CH tr 95 CH
Phương pháp giải: - Ví dụ: Đốt cháy CH tr 95 CH
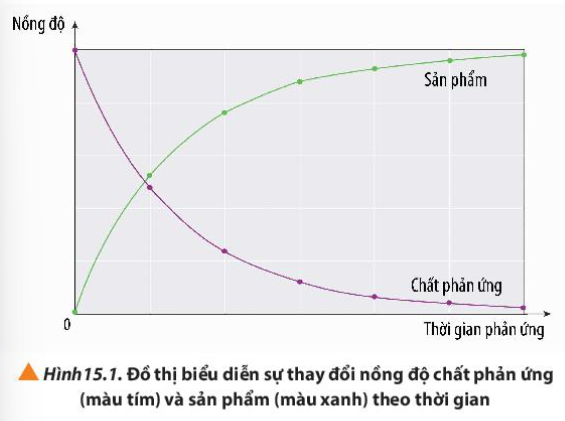
Phương pháp giải: Quan sát đồ thị và rút ra nhận xét Lời giải chi tiết: - Nồng độ chất phản ứng giảm dần theo thời gian - Nồng độ chất sản phẩm tăng dần theo thời gian CH tr 95 LT
Phương pháp giải: aA + bB → cC + dD Áp dụng công thức: \(\mathop v\limits^\_ = - \frac{1}{a}\frac{{\Delta {C_A}}}{{\Delta t}} = - \frac{1}{b}\frac{{\Delta {C_B}}}{{\Delta t}} = \frac{1}{c}\frac{{\Delta {C_C}}}{{\Delta t}} = \frac{1}{d}\frac{{\Delta {C_D}}}{{\Delta t}}\) Lời giải chi tiết: Áp dụng công thức: \(\mathop v\limits^\_ = - \frac{1}{a}\frac{{\Delta {C_A}}}{{\Delta t}} = - \frac{1}{b}\frac{{\Delta {C_B}}}{{\Delta t}} = \frac{1}{c}\frac{{\Delta {C_C}}}{{\Delta t}} = \frac{1}{d}\frac{{\Delta {C_D}}}{{\Delta t}}\) => \(\mathop v\limits^\_ = \frac{1}{1}\frac{{\Delta {C_{{N_2}{O_4}}}}}{{\Delta t}} = \frac{1}{1}\frac{{0,25}}{{184}} = 1,{36.10^{ - 3}}(M/s)\) Tốc độ trung bình của phản ứng theo N2O4 trong 184 giây là 1,36.10-3 (M/s) CH tr 96 CH
Phương pháp giải: Định luật tác dụng khối lượng: Ở nhiệt độ không đổi, tốc độ phản ứng tỉ lệ với tích số nồng độ các chất tham gia phản ứng với số mũ thích hợp Lời giải chi tiết: Tốc độ phản ứng tỉ lệ thuận với nồng độ các chất tham gia phản ứng với số mũ thích hợp => Khi nồng độ tăng thì tốc độ phản ứng tăng và ngược lại CH tr 96 CH
Phương pháp giải: Ví dụ: + Que đóm còn tàn đỏ bùng cháy khi cho vào bình oxygen + Cho nhiều men vào bánh mì thì bánh mì lên men nhanh hơn + Làm sữa chua Lời giải chi tiết: - Khi cho que đóm còn tàn đỏ vào bình oxygen thì que đóm bùng cháy, để ở ngoài thì k hiện tượng là do nồng độ oxygen trong bình khí oxygen cao hơn - Khi làm bánh mì, nếu cho nhiều men vào bột thì quá trình lên men diễn ra nhanh hơn - Khi làm sữa chua, nếu cho nhiều sữa chua thì quá trình lên men diễn ra nhanh hơn CH tr 96 LT
Phương pháp giải: a) v = k.CCl2.CH2 b) Áp dụng công thức tính tốc độ tức thời Lời giải chi tiết: a) Biểu thức tốc độ tức thời của phản ứng là: v1 = k.CCl2.CH2 b) Gọi CCl2 là nồng độ ban đầu của Cl, CH2 là nồng độ đầu của H2 => v2 = k. CCl2.CH2 :2 => 2v2 = v1 => Tốc độ phản ứng giảm 1 nửa khi nồng độ H2 giảm 2 lần và giữ nguyên nồng độ Cl2 CH tr 96 VD
Lời giải chi tiết: Sắp xếp theo thứ tự tốc độ giảm dần:
Bài tập 1
Phương pháp giải: a) v = k.CNO2.CO2 b) Áp dụng công thức tính tốc độ tức thời Lời giải chi tiết: a) Công thức tính tốc độ tức thời của phản ứng là: v1 = k.CNO2.CO2 b) - Nồng độ O2 tăng 3 lần, nồng độ NO không đổi: v2 = k.CNO2.(CO2.3) => v2 tăng 3 lần so với v1 - Nồng độ NO tăng 3 lần, nồng độ O2 không đổi: v3 = k.(CNO.3)2.CO2 = k.CNO2.9.CO2 => v3 tăng 9 lần so với v1 - Nồng độ NO và O2 đều tăng 3 lần: v4 = k.(CNO.3)2.(CO2.3) = k.CNO2.27.CO2 => v4 tăng 27 lần so với v1 Bài tập 2
Lời giải chi tiết: Từ phương trình hóa học nhận thấy: hệ số cân bằng của NO là 2, hệ số cân bằng của N2 là 1 => Trong cùng thời gian, nồng độ tiêu hao của NO nhanh gấp 2 lần nồng độ tạo thành của N2 Bài tập 3
Phương pháp giải: Áp dụng công thức: \(\mathop v\limits^\_ = - \frac{1}{a}\frac{{\Delta {C_A}}}{{\Delta t}} = - \frac{1}{b}\frac{{\Delta {C_B}}}{{\Delta t}} = \frac{1}{c}\frac{{\Delta {C_C}}}{{\Delta t}} = \frac{1}{d}\frac{{\Delta {C_D}}}{{\Delta t}}\) Lời giải chi tiết: Vì NO2 là chất sản phẩm => \(\mathop v\limits^\_ = \frac{1}{4}\frac{{\Delta {C_{N{O_2}}}}}{{\Delta t}} = \frac{1}{4}\frac{{0,4 - 0,3}}{{120 - 61}} = 4,{2.10^{ - 4}}(M/s)\) Bài tập 4
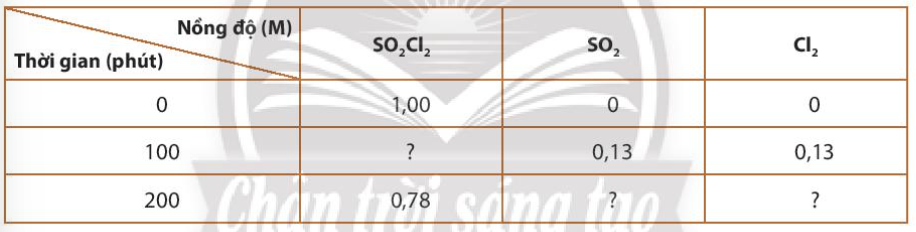
Phương pháp giải: Áp dụng công thức: \(\mathop v\limits^\_ = - \frac{1}{a}\frac{{\Delta {C_A}}}{{\Delta t}} = - \frac{1}{b}\frac{{\Delta {C_B}}}{{\Delta t}} = \frac{1}{c}\frac{{\Delta {C_C}}}{{\Delta t}} = \frac{1}{d}\frac{{\Delta {C_D}}}{{\Delta t}}\) Lời giải chi tiết: a) Trong 100 phút, chất tạo thành từ 0M tăng lên 0,13M => ∆C = 0,13M \(\mathop v\limits^\_ = \frac{1}{1}\frac{{\Delta {C_{S{O_2}C{l_{_2}}}}}}{{\Delta t}} = \frac{1}{1}\frac{{0,13}}{{100}} = 1,{3.10^{ - 3}}(M/phut)\) b) Ta có: -∆CSO2Cl2 = 0,13M = 1,00 – C2 => C2 = 0,87M c) Sau 200 phút -∆CSO2Cl2 = C1 – C2 = 1,00 – 0,78 = 0,22M => Sau 200 phút, nồng độ của SO2 và Cl2 = 0,22M Lý thuyết >> Xem chi tiết: Lý thuyết bài 15: Phương trình tốc độ phản ứng và hằng số tốc độ phản ứng
|















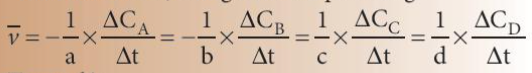







Danh sách bình luận