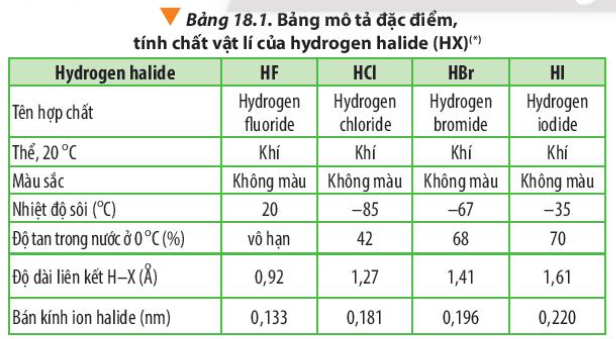
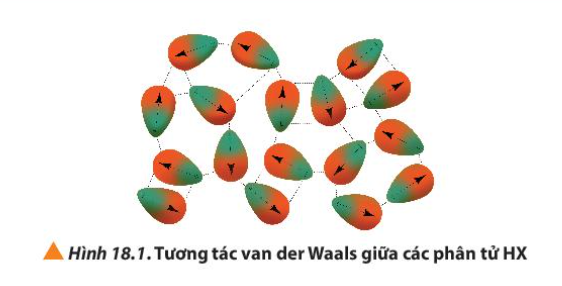
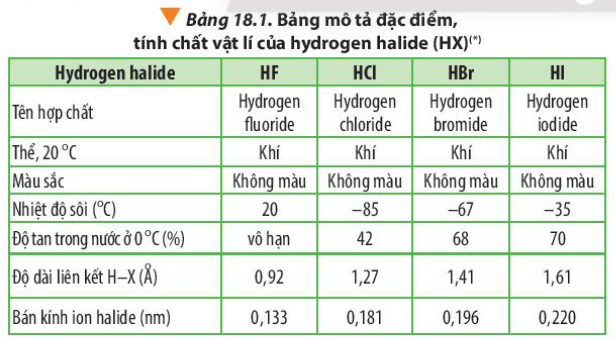
Bài 18. Hydrogen halide và một số phản ứng của ion halide trang 114, 115, 116, 117, 118, 119 Hóa 10 Chân trời sáng tạoThủy tinh vốn cứng, trơn và khá trơ về mặt hóa học nên việc chạm khắc là điều không đơn giản 1. Dựa vào Bảng 18.1 và Hình 18.1, cho biết nhiệt độ sôi của các hydrogen halide từ HCl đến HI biến đổi như thế nào? Giải thích Quảng cáo
Lựa chọn câu để xem lời giải nhanh hơn
CH tr 114 MĐ
Lời giải chi tiết: - Quá trình ăn mòn thủy tinh: CaF2 + 2H2SO4 → CaSO4 + 2HF↑ + Thủy tinh có thành phần chính là SiO2 SiO2 + 4HF → SiF4↑ + 2H2O - Các ion halide có tính khử CH tr 114 CH
Phương pháp giải: - Dựa vào lực tương tác van der Waals Lời giải chi tiết: Nhiệt độ sôi của các hydrogen halide tăng dần từ HCl đến HI. Nguyên nhân là do khối lượng phân tử tăng, làm tăng năng lượng cần thiết cho quá trình sôi; đồng thời, sự tăng kích thước và số electron trong phân tử, dẫn đến tương tác van der Waals giữa các phân tử tăng CH tr 114 CH
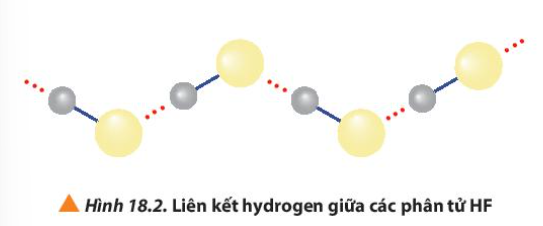
Phương pháp giải: HF có liên kết hydrogen liên phân tử Lời giải chi tiết: Các phân tử hydrogen fluoride hình thành liên kết hydrogen liên phân tử, loại liên kết này bền hơn tương tác van der Waals, nên nhiệt độ sôi của hydrogen fluoride cao bất thường so với các hydrogen halide còn lại CH tr 115 LT
Phương pháp giải: - HX (X là halogen) đều có liên kết hydrogen liên phân tử với H2O - Ở 0oC: HCl, HBr, HI đều là chất khí, chỉ có HF là chất lỏng CH tr 115 CH
Phương pháp giải: - Năng lượng liên kết giảm dần - Độ dài liên kết tăng dần - Tính acid là khả năng tách hydrogen Lời giải chi tiết: - Đi từ HF đến HI: năng lượng liên kết giảm dần => Sự liên kết giữa H và X giảm dần => Độ dài liên kết tăng dần => Khả năng tách hydrogen tăng dần => Tính acid tăng dần CH tr 115 LT
Lời giải chi tiết: (1) NaOH + HCl → NaCl + H2O (2) Zn + 2HCl → ZnCl2 + H2↑ (3) CaO + 2HBr → CaBr2 + H2O (4) K2CO3 + 2HI → 2KI + CO2 + H2O CH tr 116 VD
Phương pháp giải: HF có tính ăn mòn thủy tinh Lời giải chi tiết: HF có tính acid yếu nhưng có tính ăn mòn thủy tinh: SiO2 + 4HF → SiF4↑ + 2H2O => Trong phòng thí nghiệm người ta dùng bình bằng nhựa CH tr 116 CH
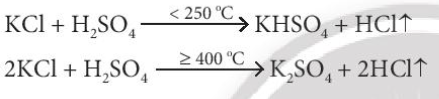
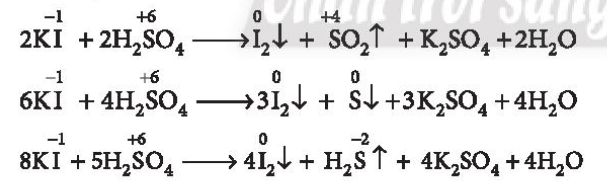
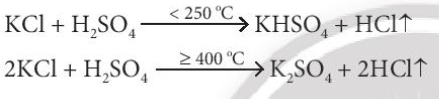
Lời giải chi tiết: - F- không tham gia phản ứng với H2SO4 đặc - Cl- chỉ tham gia phản ứng trao đổi với H2SO4 đặc - Br- tham gia phản ứng với H2SO4 đặc sẽ lên Br0 (Br2) - I- tham gia phản ứng với H2SO4 đặc sẽ lên I0 (I2) CH tr 116 CH
Lời giải chi tiết: 2F- → F20 + 2e 2Cl- → Cl20 + 2e 2Br- → Br20 + 2e 2I- → I20 + 2e CH tr 116 LT
Phương pháp giải: Bước 1: Xác định số oxi hóa của các halogen Bước 2: Xác định halogen nào có sự tăng số oxi hóa => Tính khử Lời giải chi tiết: (1): Không có sự thay đổi số oxi hóa (2): Cl từ -1 lên 0 => Thể hiện tính khử (3): Br từ -1 lên 0 => Thể hiện tính khử (4) Không có sự thay đổi số oxi hóa => Phản ứng (2) và (3) chứng minh tính khử của các ion halide CH tr 117 CH
Phương pháp giải: Sử dụng muối Ag+ Lời giải chi tiết: Hiện tượng và phương trình hóa học: + Dung dịch NaF: không có hiện tượng gì, không xảy ra phản ứng hóa học + Dung dịch NaCl: xuất hiện kết tủa trắng AgCl AgNO3 + NaCl → AgCl↓ + NaNO3 + Dung dịch NaBr: xuất hiện kết tủa vàng nhạt AgBr AgNO3 + NaBr → AgBr↓ + NaNO3 + Dung dịch NaI: xuất hiện kết tủa vàng AgI AgNO3 + NaI → AgI↓ + NaNO3 Cách nhận biết dung dịch muối halide - Cho dung dịch AgNO3 vào 4 ống nghiệm chứa 4 dung dịch muối halide (từ F đến I) + Ống không có hiện tượng gì thì đó là muối F- + Ống có kết tủa trắng thì đó là muối Cl- + Ống có kết tủa vàng nhạt thì đó là muối Br- + Ống có kết tủa vàng thì đó là muối I- CH tr 117 LT
Phương pháp giải: Sử dụng muối AgNO3 Lời giải chi tiết: - 2 dung dịch CaCl2 và NaNO3 cho vào 2 ống nghiệm: + Mỗi ống nghiệm cho khoảng 2 mL AgNO3. Ống nghiệm nào xuất hiện kết tủa trắng thì đó là dung dịch CaCl2, ống nghiệm nào không có hiện tượng gì thì đó là dung dịch NaNO3 CaCl2 + 2AgNO3 → 2AgCl↓ + Ca(NO3)2 CH tr 118 CH
CH tr 118 VD
Phương pháp giải: HCl + NaHCO3 → NaCl + CO2 + H2O Lời giải chi tiết: - Trong dạ dày có chứa dung dịch HCl. Người bị đau dạ dày là người có nồng độ dung dịch HCl cao làm dạ dày bị bào mòn. NaHCO3 dùng để chế thuốc đau dạ dày vì nó làm giảm hàm lượng dung dịch HCl có trong dạ dày nhờ phản ứng: HCl + NaHCO3 → NaCl + CO2 + H2O - Không nên dùng Na2CO3 vì dùng NaHCO3 trung hòa dịch vị 1 cách từ từ Bài tập 1
Lời giải chi tiết: a) Mg + 2HBr → MgBr2 + H2 b) KOH + HCl → KCl + H2O c) CaCO3 + 2HCl → CaCl2 + CO2 + H2O d) AgNO3 + CaI2 → AgI↓ + Ca(NO3)2 Bài tập 2
Phương pháp giải:
Lời giải chi tiết: a) Khi phản ứng với H2SO4 đặc, NaI và NaBr đều bị oxi hóa thành I2 và Br2. Chỉ có NaCl tác dụng với H2SO4(đặc) tạo ra HCl => X là Cl b) Không thể dùng H2SO4 loãng vì HX đều là những acid mạnh Bài tập 3
Phương pháp giải: dnước = 1 g/mL \(0,9\% = \frac{{{m_{ct}}}}{{{m_{{\text{dd}}}}}}.100\% = \frac{{{m_{NaCl}}}}{{{m_{NaCl}} + {m_{{H_2}O}}}}.100\% \) Lời giải chi tiết: Coi khối lượng muối cho vào rất ít, không ảnh hưởng đến thể tích dung dịch => Vnước = 500 mL Mà dnước = 1 g/mL => mH2O = 500 gam Ta có: \(0,9\% = \frac{{{m_{ct}}}}{{{m_{{\text{dd}}}}}}.100\% = \frac{{{m_{NaCl}}}}{{{m_{NaCl}} + {m_{{H_2}O}}}}.100\% = \frac{{{m_{NaCl}}}}{{{m_{NaCl}} + 500}}.100\% \) => mNaCl = 4,54 gam - Cách pha chế: + Cho khoảng 100 mL nước vào bình định mức 500 mL + Cân 4,54 gam NaCl và cho vào bình định mức + Lắc đều cho đến khi muối tan hết + Tiếp tục cho nước đến vạch định mức 500 mL
|















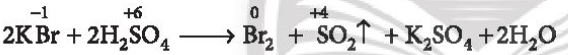






Danh sách bình luận