Lý thuyết bài 18: Hydrogen halide và một số phản ứng của ion Halidexu hướng biến đổi nhiệt độ sôi hydrogen halide, biến đổi tính acid, ứng dụng, nhận biết ion halide Quảng cáo
Lý thuyết: Hydrogen halide và phản ứng của ion halide I. Tính chất vật lí của hydrogen halide - Ở điều kiện thường, HX tồn tại ở thể khí, tan tốt trong nước, tạo thành dung dịch hydrohalic acid tương ứng 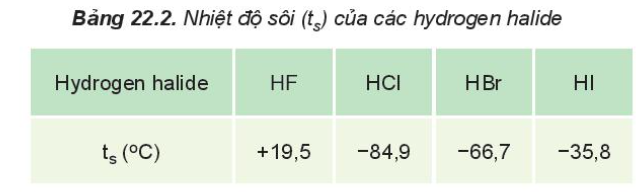
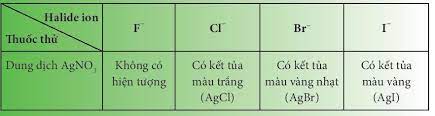
- HF có nhiệt độ sôi cao bất thường là do HF có khả năng tạo liên kết hydrogen - Từ HCl đến HI, nhiệt độ sôi tăng do: + Lực tương tác van der Waals giữa các phân tử tăng + Khối lượng phân tử tăng II. Hydrohalic acid Tính acid của các hydrohalic acid - Hydrogen halide tan trong nước tạo thành hydrohalic acid - HF là acid yếu nhưng có tính ăn mòn thủy tinh SiO2 + 4HF → SiF4↑ + 2H2O - HCl, HBr, HI là những acid mạnh, có đầy đủ tính chất hóa học chung của acid + Quỳ tím chuyển sang đỏ + Tác dụng với kim loại đứng trước H trong dãy hoạt động hóa học + Tác dụng với basic oxide + Base + 1 số muối III. Tính khử của các ion halide - Các ion halide có số oxi hóa thấp nhất là -1 => Ion halide chỉ thể hiện tính khử trong phản ứng oxi hóa - khử Ví dụ: 2KMnO4 + 16HCl → 2KCl + 2MnCl2 + 5Cl2 + 8H2O IV. Nhận biết ion Halide trong dug dịch:
V. Ứng dụng a) HF - Sản xuất teflon (chất chống dính ở nồi, chảo) theo sơ đồ:
- Ăn mòn thủy tinh vô cơ SiO2 + 4HF → SiF4 + 2H2O - Trong công nghiệp, hỗn hợp có thành phần KF.3HF được dùng để điện phân nóng chảy, sản xuất F2 b) HCl - Loại bỏ gỉ sắt trên sắt thép trước khi chuyển sang công đoạn sản xuất tiếp theo - Sản xuất hợp chất vô cơ và hữu cơ: PVC, PAC… - Tái sinh các nhựa trao đổi ion nhừm thay thế các ion Na+ và Ca2+ = ion H+ Sơ đồ tư duy 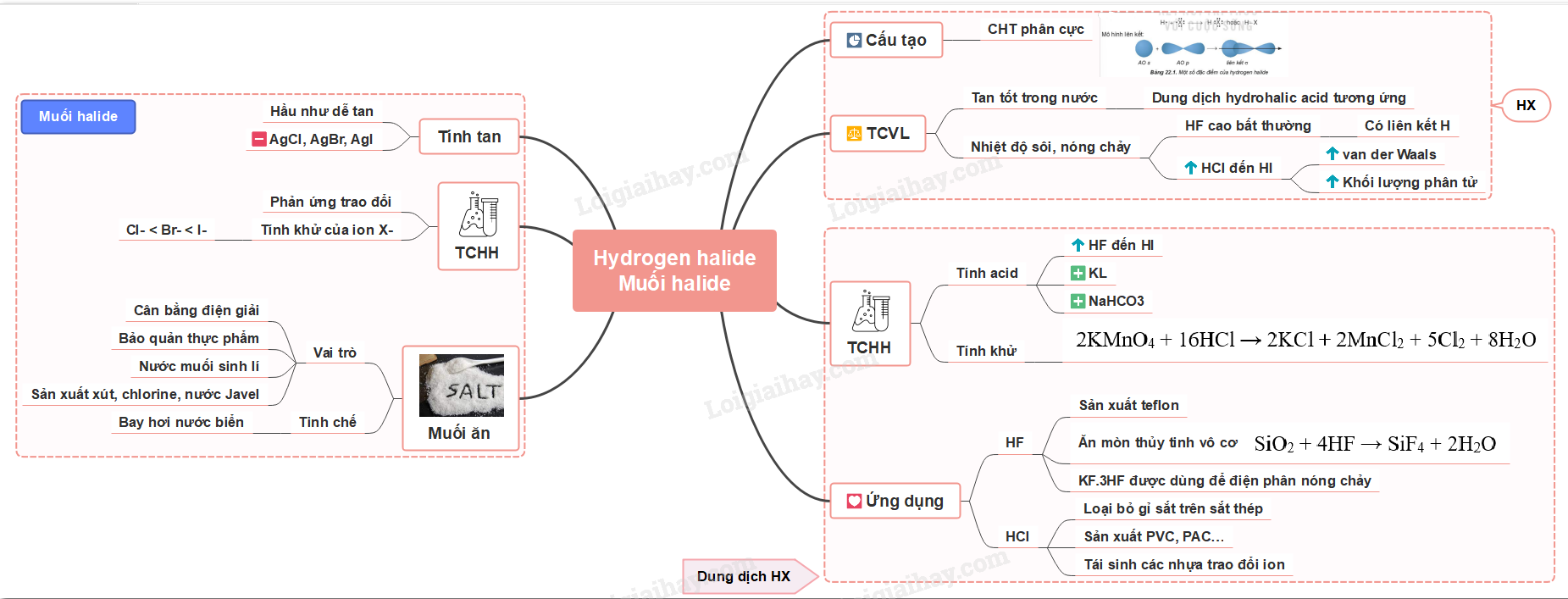
|





















Danh sách bình luận