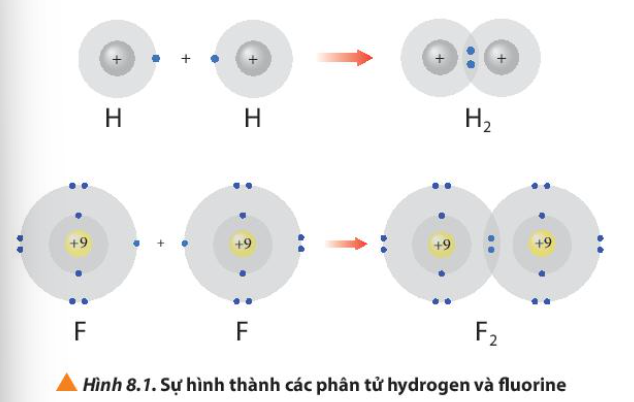
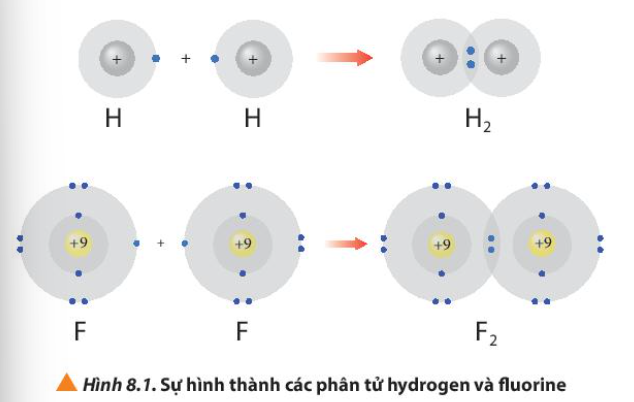
Bài 8. Quy tắc octet trang 52, 53, 54 Hóa 10 Chân trời sáng tạoTải vềKhi liên kết với nhau, nguyên tử của các nguyên tố dường như đã cố gắng “bắt chước” cấu hình electron nguyên tử của các nguyên tố khí hiếm để bền vững hơn Hình 8.1 giải thích sự hình thành phân tử hydrogen (H2) và fluorine (F2) từ các nguyên tử. Quảng cáo
Lựa chọn câu để xem lời giải nhanh hơn
Tải về
CH tr 52 MĐ
Lời giải chi tiết: Quy tắc octet (bát tử): Trong quá trình hình thành liên kết hóa học, nguyên tử của các nguyên tố nhóm A có xu hướng tạo thành lớp vỏ ngoài cùng có 8 electron tương ứng với khí hiếm gần nhất (hoặc 2 electron với khí hiếm helium) CH tr 52 CH
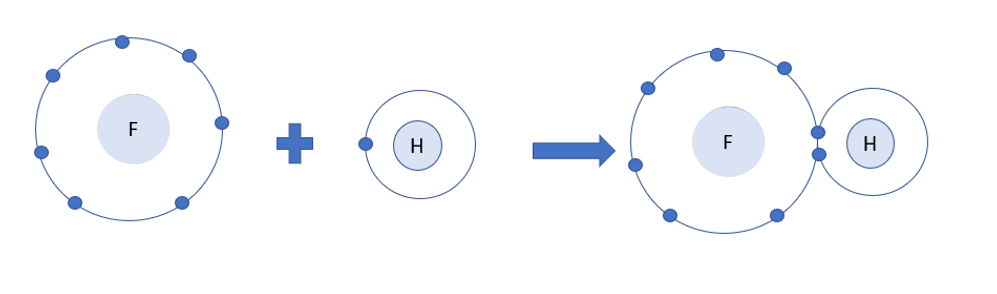
Phương pháp giải: Sau khi tham gia liên kết, nguyên tử hydrogen có 2 electron lớp ngoài cùng và nguyên tử fluorine có 8 electron lớp ngoài cùng Lời giải chi tiết: - Sau khi tham gia liên kết: + Nguyên tử H: Có 1 lớp electron, 2 electron ở lớp ngoài cùng => Giống cấu hình electron của He + Nguyên tử F: Có 2 lớp electron, 8 electron ở lớp ngoài cùng => Giống cấu hình electron của Ne CH tr 52 CH
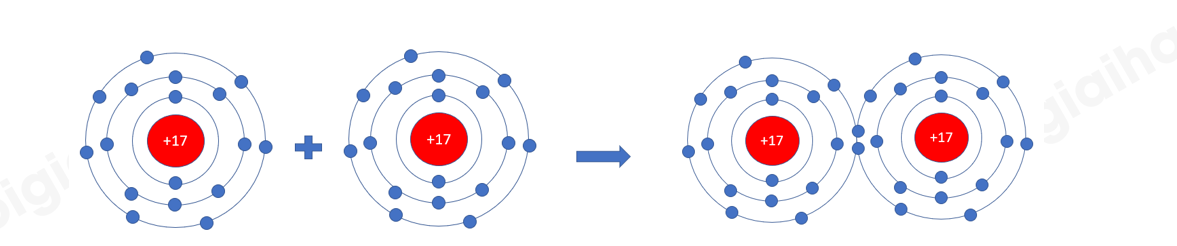
Phương pháp giải: - Nguyên tử O có 6 electron ở lớp ngoài cùng => Cần thêm 2 electron - Nguyên tử Cl có 7 electron ở lớp ngoài cùng => Cần thêm 1 electron Lời giải chi tiết: - Nguyên tử chlorine có 7 electron ở lớp ngoài cùng. Khi 2 nguyên tử Cl liên kết với nhau, mỗi nguyên tử Cl sẽ góp 1 electron để tạo 1 cặp electron dùng chung tạo thành cấu hình electron bền vững của khí hiếm
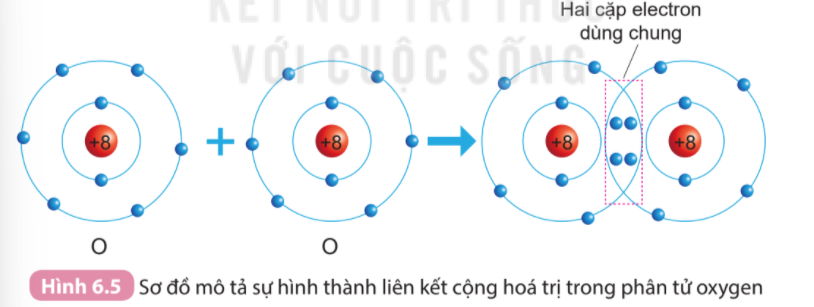
- Nguyên tử oxygen có 6 electron ở lớp ngoài cùng. Khi 2 nguyên tử O liên kết với nhau, mỗi nguyên tử O sẽ góp 2 electron để tạo 2 cặp electron dùng chung tạo thành cấu hình electron bền vững của khí hiếm
CH tr 53 CH
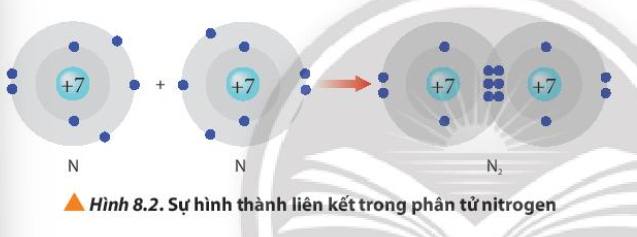
Phương pháp giải: Sau khi tham gia liên kết, nguyên tử nitrogen có 8 electron ở lớp ngoài cùng Lời giải chi tiết: Sau khi tham gia liên kết, nguyên tử nitrogen 8 electron ở lớp ngoài cùng và có 2 lớp electron => Đạt được cấu hình electron bền vững của nguyên tử khí hiếm Neon CH tr 53 LT
Phương pháp giải: - Nguyên tử fluorine và hydrogen đều là phi kim + Fluorine có 7 electron lớp ngoài cùng + Hydrogen có 1 electron lớp ngoài cùng (lớp 1 có tối đa 2 electron) => Cả 2 có xu hướng nhận electron để đạt cấu hình electron của khí hiếm Lời giải chi tiết: - Nguyên tử fluorine và hydrogen đều là phi kim + Fluorine có 7 electron lớp ngoài cùng + Hydrogen có 1 electron lớp ngoài cùng (lớp 1 có tối đa 2 electron) => Cả 2 có xu hướng nhận electron để đạt cấu hình electron của khí hiếm => Khi tham gia liên kết hình thành phân tử HF, mỗi nguyên tử sẽ bỏ ra 1 electron để tạo thành 1 cặp electron dùng chung
CH tr 53 CH
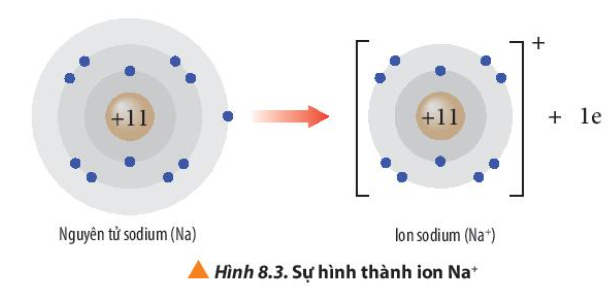
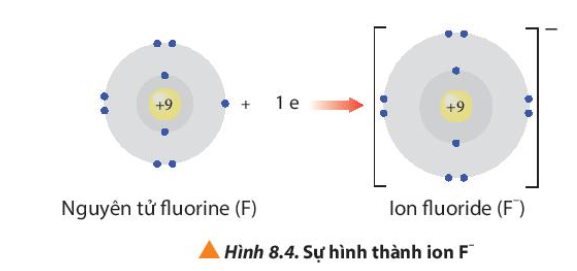
Phương pháp giải: Quan sát Hình 8.3 và Hình 8.4 và rút ra nhận xét Lời giải chi tiết: - Ion sodium có 2 lớp electron và có 8 electron ở lớp ngoài cùng => Giống cấu hình electron của khí hiếm Neon - Ion fluoride có 2 lớp electron và có 8 electron ở lớp ngoài cùng => Giống cấu hình electron của khí hiếm Neon CH tr 54 CH
Phương pháp giải: - Viết cấu hình electron của Lithium => Xu hướng nhường hay nhận electron Lời giải chi tiết: - Lithium có số hiệu nguyên tử: Z = 3 => Cấu hình electron: 1s22s1 => Lithium có xu hướng nhường 1 electron để đạt cấu hình electron bền vững của khí hiếm He 1s22s1 → 1s2 + 1e CH tr 54 LT
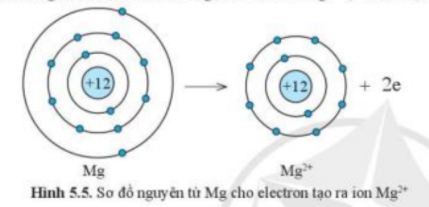
Phương pháp giải: - Nguyên tử Mg có 2 electron ở lớp vỏ ngoài cùng => Xu hướng nhường 2 electron - Nguyên tử O có 6 electron ở lớp vỏ ngoài cùng => Xu hướng nhận 2 electron Lời giải chi tiết: - Nguyên tử Mg có Z = 12 => Cấu hình electron: 1s22s22p63s2 => Nguyên tử Mg sẽ nhường 2 electron tạo thành ion Mg2+ để đạt cấu hình electron bền vững của khí hiếm: 1s22s22p63s2 → 1s22s22p6 + 2e ( Mg → Mg2+ + 2e)
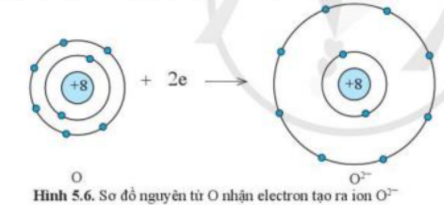
- Nguyên tử O có Z = 8 => Cấu hình electron: 1s22s22p4 => Nguyên tử O sẽ nhận 2 electron tạo thành ion O2- để đạt cấu hình electron bền vững của khí hiếm: 1s22s22p4 + 2e → 1s22s22p6 ( O + 2e → O2-)
CH tr 54 BT1
Phương pháp giải: Cấu hình electron khí hiếm Argon: 1s22s22p63s23p6 Lời giải chi tiết: - Fluorine (Z = 9): 1s22s22p5 => Có xu hướng nhận 1 electron thành F- có cấu hình: 1s22s22p6 - Oxygen (Z = 8): 1s22s22p4 => Có xu hướng nhận 2 electron thành O2- có cấu hình: 1s22s22p6 - Hydrogen (Z = 1): 1s1 => Có xu hướng góp chung 1 electron để tạo thành 1 cặp electron dùng chung đạt cấu hình: 1s2 - Chlorine (Z = 17): 1s22s22p63s23p5 => Có xu hướng nhận 1 electron thành Cl- có cấu hình: 1s22s22p63s23p6 => Nguyên tử của nguyên tố chlorine có xu hướng đạt cấu hình electron bền vững của khí hiếm argon Đáp án D CH tr 54 BT2
Phương pháp giải: - Viết cấu hình electron của nguyên tử potassium => Xu hướng nhường bao nhiêu electron Lời giải chi tiết: - Nguyên tử potassium có Z = 19 => Cấu hình electron: 1s22s22p63s23p64s1 => Có xu hướng nhường 1 electron để đạt cấu hình electron bền vững của khí hiếm Argon: 1s22s22p63s23p6 Đáp án C CH tr 54 BT3
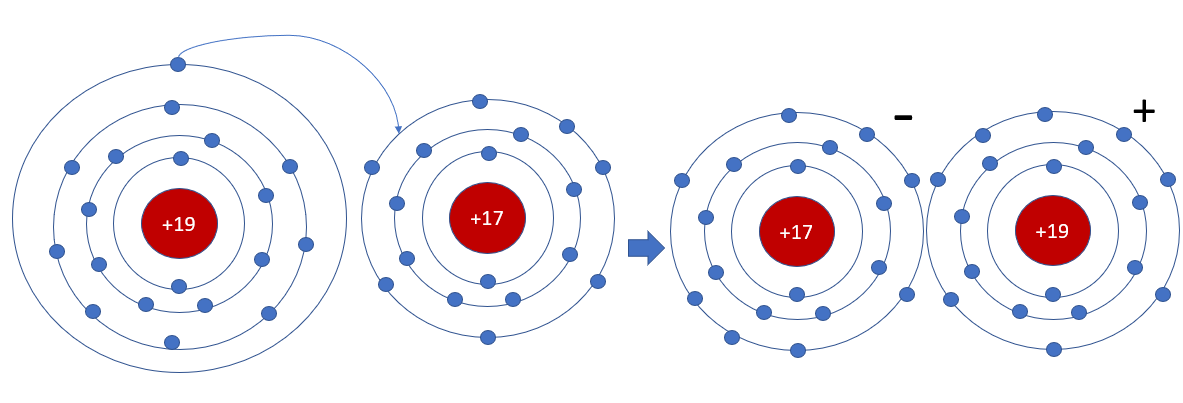
Phương pháp giải: Bước 1: Viết cấu hình electron của nguyên tử K và Cl => Xu hướng nhường hay nhận electron của K và Cl Bước 2: Vẽ sơ đồ mô tả Lời giải chi tiết: - Nguyên tử K (Z = 19): 1s22s22p63s23p64s1 => Có xu hướng nhường 1 electron - Nguyên tử Cl (Z = 17): 1s22s22p63s23p5 => Có xu hướng nhận 1 electron => Nguyên tử Cl sẽ nhận 1 electron của nguyên tử K để hình thành phân tử potassium chlorine (KCl) - Sơ đồ mô tả:
CH tr 54 CH
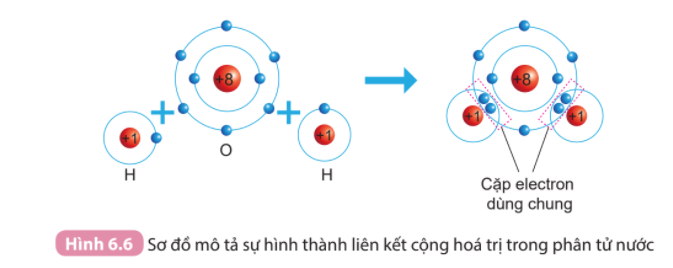
Phương pháp giải: Bước 1: Viết cấu hình electron của O và H => Xu hướng nhường hay nhận electron của O và H Bước 2: Vẽ sơ đồ mô tả Lời giải chi tiết: - Nguyên tử O (Z = 8): 1s22s22p4 => Có xu hướng nhận 2 electron - Nguyên tử H (Z = 1): 1s1 => Có xu hướng nhận 1 electron => Mỗi nguyên tử H sẽ bỏ ra 1 electron và góp chung với 2 electron của nguyên tử O tạo thành 2 cặp electron dùng chung
|





















Danh sách bình luận