Bài 13. Enthalpy tạo thành và biến thiên enthalpy của phản ứng hóa học trang 80, 81, 82, 83, 84, 85, 86, 87 Hóa 10 Chân trời sáng tạoTải vềHầu như mọi phản ứng hóa học cũng như quá trình chuyển thể của chất luôn kèm theo sự thay đổi năng lượng 1. Viết phương trình hóa học của phản ứng xảy ra ở Hình 13.1 và nêu nhận xét về sự thay đổi nhiệt của phản ứng đó Quảng cáo
Lựa chọn câu để xem lời giải nhanh hơn
Tải về
CH tr 80 MĐ
Lời giải chi tiết: - Phản ứng có kèm theo sự thay đổi năng lượng dưới dạng nhiệt năng đóng vai trò quan trọng trong đời sống: + Cung cấp nhiệt cho các nhu cầu đun nấu thức ăn + Giảm nhiệt độ của môi trường xung quanh CH tr 81 CH
Phương pháp giải: Đốt cháy hỗn hợp: Fe2O3 và Al Lời giải chi tiết: Fe2O3 + 2Al → 2Fe + Al2O3 Phản ứng làm tăng nhiệt độ môi trường xung quanh, tỏa nhiệt lớn, lên đến 2500 oC CH tr 81 CH
Phương pháp giải: So sánh nhiệt độ trước và sau khi cho CaO Lời giải chi tiết: - Hiện tượng: Chất rắn màu trắng tan ra, tạo thành dung dịch - Nhiệt độ chất lỏng trong cốc tăng lên, từ 20 oC lên 50 oC - Giải thích: Sự hòa tan CaO trong nước sinh ra nhiệt, làm nhiệt độ chất lỏng trong cốc tăng lên CH tr 81 LT
Phương pháp giải: Quá trình đốt cháy than, ethanol trong không khí tỏa nhiệt ra môi trường Lời giải chi tiết: - Hiện tượng: xuất hiện khí bay ra C + O2 \(\xrightarrow{{{t^o}}}\)CO2↑ C2H5OH + 3 O2 \(\xrightarrow{{{t^o}}}\)2CO2↑ + 3H2O - Nhiệt độ môi trường xung quanh tăng lên CH tr 82 CH
Phương pháp giải: Học sinh thực hiện thí nghiệm và kiểm chứng Lời giải chi tiết: Nhiệt độ của nước trong cốc giảm đi CH tr 82 CH
Lời giải chi tiết: Trong phản ứng nung đá vôi (CaCO3), nếu ngừng cung cấp nhiệt, phản ứng sẽ không tiếp tục xảy ra
CH tr 82 CH
Lời giải chi tiết: - Hiện tượng: Xuất hiện bọt khí nổi lên, đẩy nước ra khỏi bình tam giác - Nếu ngừng đốt nóng, phản ứng dừng lại, khí không được sinh ra CH tr 83 CH
Phương pháp giải: Điều kiện chuẩn Lời giải chi tiết: - Biến thiên enthalpy chuẩn của một phản ứng hóa học được xác định ở điều kiện chuẩn + Áp suất 1 bar (đối với chất khí), nồng độ 1 mol/L (đối với chất tan trong dung dịch) + Nhiệt độ: 25oC (hay 298K) CH tr 83 CH
Phương pháp giải: - Nhiệt phản ứng - Trạng thái của các chất đầu (cđ) và sản phẩm (sp) Lời giải chi tiết: - Phương trình nhiệt hóa học cho biết + Phản ứng tỏa nhiệt hay thu nhiệt + Trạng thái của các chất đầu (cđ) và sản phẩm (sp) CH tr 83 CH
Phương pháp giải: - Phản ứng thu nhiệt (hệ nhận nhiệt của môi trường) thì \({\Delta _r}H_{298}^o\) > 0 - Phản ứng tỏa nhiệt (hệ tỏa nhiệt ra môi trường) thì \({\Delta _r}H_{298}^o\) < 0 Lời giải chi tiết: - Phản ứng (1) có \({\Delta _r}H_{298}^o\) = +131,25 kJ > 0 => Phản ứng thu nhiệt - Phản ứng (2) có \({\Delta _r}H_{298}^o\) = +131,25 kJ < 0 => Phản ứng tỏa nhiệt CH tr 84 CH
Phương pháp giải: - Enthalpy tạo thành của một chất là nhiệt kèm theo phản ứng tạo thành 1 mol chất đó từ các đơn chất bền nhất - Biến thiên enthalpy của phản ứng là lượng nhiệt tỏa ra hay thu vào của một phản ứng hóa học trong quá trình đẳng áp Lời giải chi tiết:
CH tr 84 CH
Phương pháp giải: Enthalpy tạo thành của một chất là nhiệt kèm theo phản ứng tạo thành 1 mol chất đó từ các đơn chất bền nhất Lời giải chi tiết: \({\Delta _f}H_{298}^o\)(SO2,g) = -296,80 kJ/mol là lượng nhiệt tỏa ra khi tạo thành 1 mol chất SO2(g) từ các đơn chất ở trạng thái bền nhất ở điều kiện chuẩn (Sulfur ở dạng rắn, oxygen ở dạng phân tử khí chính là dạng đơn chất bền nhất của sulfur và oxygen) CH tr 84 CH
Phương pháp giải: - \({\Delta _f}H_{298}^o\)của đơn chất bền nhất = 0 - \({\Delta _f}H_{298}^o\)< 0, chất bền hơn về mặt năng lượng so với các đơn chất bền tạo nên nó - \({\Delta _f}H_{298}^o\)> 0, chất kém bền hơn về mặt năng lượng so với các đơn chất bền tạo nên nó Lời giải chi tiết: Ta có: \({\Delta _f}H_{298}^o\)(SO2,g) = -296,80 kJ/mol < 0 => Chất bền hơn về mặt năng lượng so với các đơn chất bền tạo nên nó => SO2(g) bền hơn về mặt năng lượng so với các đơn chất bền S(s) và O2(g) CH tr 84 CH
Phương pháp giải: Quan sát Bảng 13.1 và liệt kê Lời giải chi tiết: Các phản ứng có enthalpy tạo thành dương là: C2H2(g), C2H4(g), C6H6(l), CS2(aq), HI(g), N2O(g), N2O4(g), NO(g), NO2(g) CH tr 84 LT
Phương pháp giải: 1J = 0,293 cal => 1kJ = 0,293 kcal Lời giải chi tiết: - \({\Delta _f}H_{298}^o\) (Fe2O3, s) = -825,50 kJ/mol => Theo đơn vị kcal = -825,50.0,293 = -241,87 kcal/mol - \({\Delta _f}H_{298}^o\) (NO, g) = +90,29 kJ/mol => Theo đơn vị kcal = +90,29.0,293 = +26,45 kcal/mol - \({\Delta _f}H_{298}^o\) (H2O, g) = -241,82 kJ/mol ==> Theo đơn vị kcal = -241,82.0,293 = -70,85 kcal/mol - \({\Delta _f}H_{298}^o\) (C2H5OH, l) = -277,63 kJ/mol ==> Theo đơn vị kcal = -277,63.0,293 = -81,35 kcal/mol CH tr 85 CH
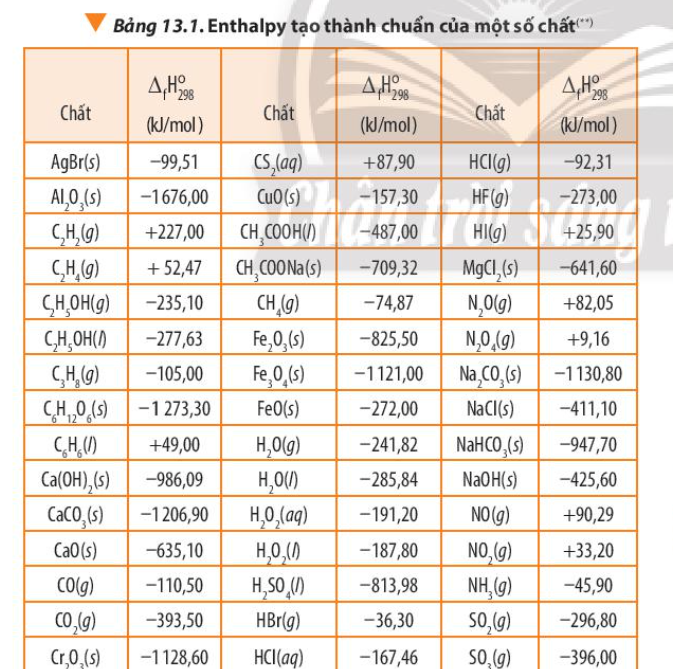
Phương pháp giải: Quan sát Hình 13.5 và nhận xét
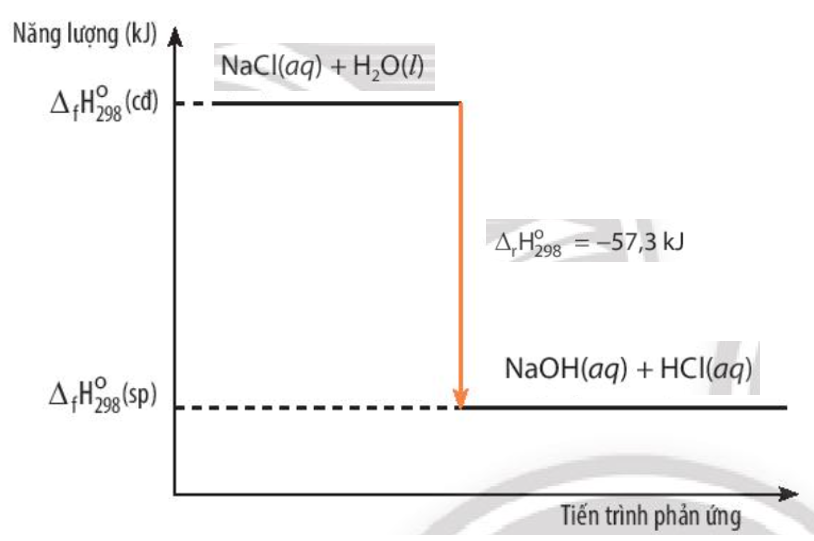
Lời giải chi tiết: Giá trị \({\Delta _f}H_{298}^o\)(sp) nhỏ hơn \({\Delta _f}H_{298}^o\)(cđ) CH tr 85 CH
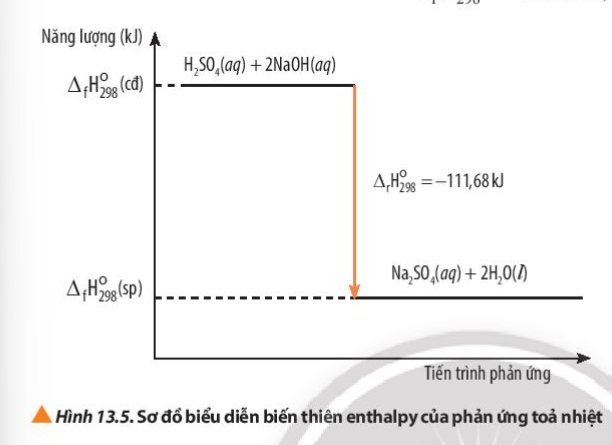
Phương pháp giải: \({\Delta _f}H_{298}^o\)= \({\Delta _f}H_{298}^o\)(sp) - \({\Delta _f}H_{298}^o\)(cđ)
Lời giải chi tiết: Ta có: \({\Delta _f}H_{298}^o\)= \({\Delta _f}H_{298}^o\)(sp) - \({\Delta _f}H_{298}^o\)(cđ) = +178,49 kJ
CH tr 85 CH
Phương pháp giải: \({\Delta _r}H_{298}^o\) càng nhỏ, phản ứng xảy ra càng thuận lợi Lời giải chi tiết: \({\Delta _r}H_{298}^o\) = -546,00 kJ (2) < \({\Delta _r}H_{298}^o\) = -283,00 kJ (1) => Phản ứng (2) xảy ra thuận lợi hơn CH tr 86 VD
Phương pháp giải: - \({\Delta _r}H_{298}^o\) > 0 => Phản ứng thu nhiệt - \({\Delta _r}H_{298}^o\) < 0 => Phản ứng tỏa nhiệt Lời giải chi tiết: - Ta có: \({\Delta _r}H_{298}^o\)= 94,30 kJ > 0 => Phản ứng thu nhiệt - Ứng dụng khác của phản ứng baking soda với giấm: + Baking soda và giấm ngoài việc được sử dụng trong nấu ăn còn được dùng nhiều trong vệ sinh nhà cửa như: Khử mùi hôi, tẩy trắng quần áo, tẩy trắng nồi chảo, vệ sinh máy giặt,… + Kết hợp baking soda với giấm ăn để hiệu quả tẩy rửa cao hơn. Baking soda có khả năng làm sạch, khử mùi và làm mềm các mảng bám, còn giấm ăn cũng tác dụng loại bỏ mùi hôi và các vết bẩn cứng đầu khác. CH tr 86 BT1
Phương pháp giải: \({\Delta _r}H_{298}^o\)> 0 => Phản ứng thu nhiệt
Lời giải chi tiết: Ta có: \({\Delta _r}H_{298}^o\)= +180 kJ > 0 => Phản ứng hấp thụ nhiệt năng từ môi trường Đáp án D CH tr 86 BT2
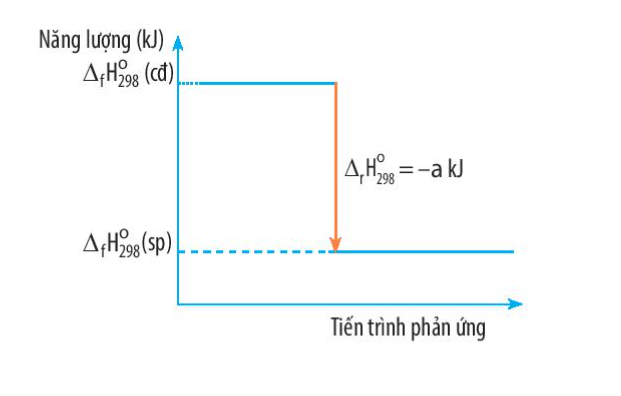
Phương pháp giải: \({\Delta _r}H_{298}^o\)< 0 => Phản ứng tỏa nhiệt
Lời giải chi tiết: Ta có: \({\Delta _r}H_{298}^o\)= -a kJ < 0 => Phản ứng tỏa nhiệt Đáp án A CH tr 87 BT3
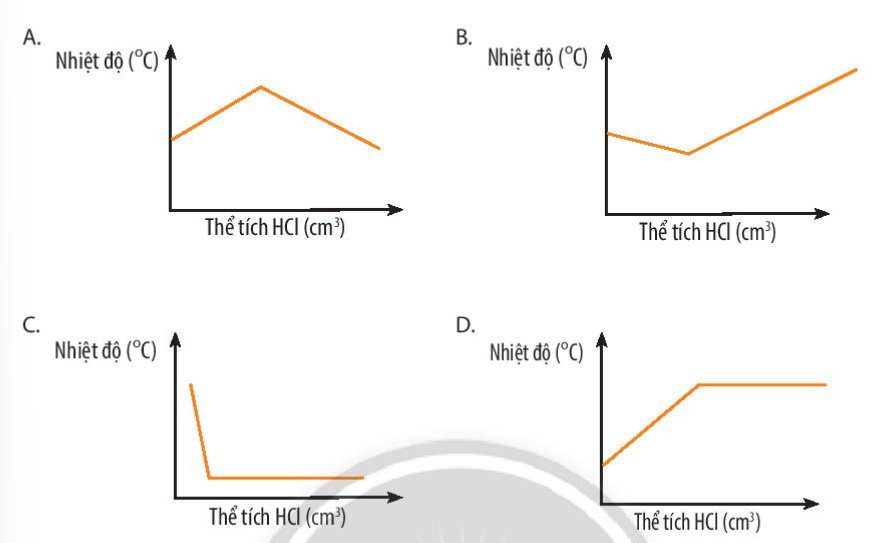
Lời giải chi tiết: Phản ứng giữa dung dịch hydrochloric acid và dung dịch sodium hydroxide là phản ứng tỏa nhiệt ( \({\Delta _r}H_{298}^o\)= -57,9 kJ < 0) Khi phản ứng nhiệt độ tăng dần lên. Kết thúc phản ứng nhiệt độ giảm dần để cân bằng với nhiệt độ của môi trường CH tr 87 BT4
Phương pháp giải: \({\Delta _r}H_{298}^o\)= \({\Delta _f}H_{298}^o\)(sp) - \({\Delta _f}H_{298}^o\)(cđ)
Lời giải chi tiết: Ta có: \({\Delta _r}H_{298}^o\)= \({\Delta _f}H_{298}^o\)(sp) - \({\Delta _f}H_{298}^o\)(cđ) = -57,3 kJ
Lý thuyết >> Xem chi tiết: Lý thuyết bài 13: Enthalpy tạo thành và biến thiên enthalpy của phản ứng hóa học
|

























Danh sách bình luận