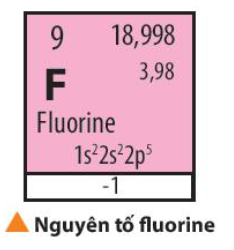
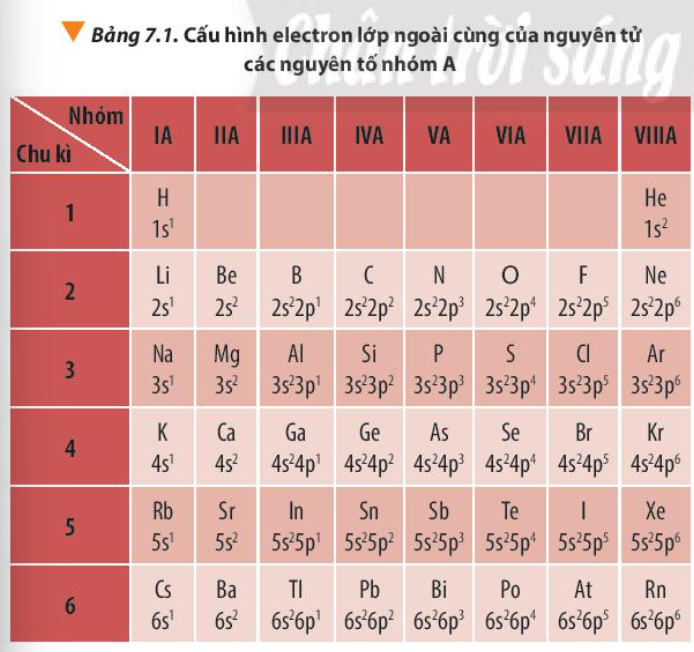
Bài 7. Định luật tuần hoàn – ý nghĩa của bảng tuần hoàn các nguyên tố hóa học trang 49, 50, 51 Hóa 10 Chân trời sáng tạoTải vềFluorine được sử dụng làm chất oxi hóa cho nhiên liệu lỏng dùng trong tên lửa. Quan sát Bảng 7.1, hãy nhận xét về số electron lớp ngoài cùng của nguyên tử các nguyên tố nhóm A trong cùng một chu kì và trong cùng một nhóm Quảng cáo
Lựa chọn câu để xem lời giải nhanh hơn
Tải về
CH tr 49 MĐ
Phương pháp giải:
Lời giải chi tiết: - Fluorine thuộc chu kì 2, nhóm VIIA => Có 7 electron ở lớp ngoài cùng => Có xu hướng nhận thêm 1 electron tạo thành F- có cấu hình electron bền vững => Fluorine có tính phi kim, tính oxi hóa mạnh và có khả năng phản ứng mãnh liệt vì có độ âm điện lớn CH tr 49 CH
Phương pháp giải: Quan sát Bảng 7.1 và rút ra nhận xét số electron lớp ngoài cùng trong cùng 1 chu kì và trong cùng 1 nhóm Lời giải chi tiết: - Số electron lớp ngoài cùng của nguyên tố nhóm A: + Trong 1 chu kì: có cùng số lớp electron nhưng số electron lớp ngoài cùng tăng dần từ 1 đến 8 (trái qua phải) + Trong 1 nhóm: có cùng số electron lớp ngoài cùng nhưng số lớp electron tăng dần (từ trên xuống dưới) CH tr 50 LT
Phương pháp giải: Định luật tuần hoàn: Tính chất của các nguyên tố và đơn chất, cũng như thành phần và tính chất của các hợp chất tạo nên từ các nguyên tố đó biến đổi tuần hoàn theo chiều tăng của điện tích hạt nhân nguyên tử Lời giải chi tiết: Xu hướng biến đổi một số tính chất của các nguyên tố, đơn chất:
- Tính oxi hóa, tính khử + Trong 1 chu kì, từ trái qua phải, tính oxi tăng dần, tính khử giảm dần + Trong 1 nhóm, từ trên xuống dưới, tính oxi hóa giảm dần, tính khử tăng dần - Tính phi kim, kim loại + Trong 1 chu kì, từ trái qua phải, tính phi kim tăng dần, tính kim loại giảm dần + Trong 1 nhóm, từ trên xuống dưới, tính phi kim giảm dần, tính kim loại tăng dần - Bán kính nguyên tử + Trong 1 chu kì, từ trái qua phải, bán kính nguyên tử giảm dần + Trong 1 nhóm, từ trên xuống dưới, bán kính nguyên tử tăng dần Xu hướng biến đổi một số tính chất của hợp chất (oxide, hydroxide) - Tính acid, base + Trong 1 chu kì, từ trái qua phải, tính acid tăng dần, tính base giảm dần + Trong 1 nhóm, từ trên xuống dưới, tính acid giảm dần, tính base tăng dần CH tr 50 CH
Phương pháp giải: Bước 1: Từ số hiệu nguyên tử => Cấu hình electron của Ca, số proton, số electron, số thứ tự nguyên tố Bước 2: Từ cấu hình electron => Số lớp electron, số electron lớp ngoài cùng Bước 3: Tìm được số thứ tự chu kì = Số lớp electron và nhóm = số electron lớp ngoài cùng Bước 4: Từ vị trí của Ca => Các tính chất của nguyên tố Ca Lời giải chi tiết:
CH tr 50 LT
Phương pháp giải: Bước 1: Viết cấu hình electron của nguyên tử Bước 2: Xác định số electron, proton, số lớp electron, số electron lớp ngoài cùng Bước 3: Xác định vị trí: số thứ tự ô, số thứ tự chu kì, nhóm Bước 4: Nêu tính chất của nguyên tử Lời giải chi tiết: a) Nguyên tố potassium thuộc ô 19 => Z = 19 => Cấu hình electron: 1s22s22p63s23p64s1 => Cấu tạo của nguyên tử potassium: + Số proton = số electron = 19 + Số lớp electron: 4 lớp + Số electron lớp ngoài cùng: 1 b) Nguyên tố chlorine có 17 proton => Có 17 electron => Cấu hình electron: 1s22s22p63s23p5 => Vị trí của nguyên tố chlorine trong bảng tuần hoàn: + Có 17 electron => Số thứ tự nguyên tố: 17 + Có 3 lớp electron => Nằm ở chu kì 3 + Có 7 electron ở lớp ngoài cùng => Thuộc nhóm VIIA c) Nguyên tố sulfur thuộc ô 16 trong bảng tuần hoàn => Có 16 electron => Cấu hình electron: 1s22s22p63s23p4 => Nguyên tố sulfur có 3 lớp electron và có 6 electron ở lớp ngoài cùng => Nguyên tố sulfur thuộc chu kì 3, nhóm VIA => Sulfur là phi kim, hóa trị cao nhất với oxygen là VI => Công thức oxide tương ứng: SO3 => Công thức hydroxide tương ứng: H2SO4 => Cả hydroxide và oxide cao nhất đều mang tính acid CH tr 51 VD
Phương pháp giải: Được sử dụng để sản xuất chất tẩy rửa gia dụng, thuốc nhộm… Lời giải chi tiết: KOH được sử dụng để làm chất tẩy rửa gia dụng => Khả năng tham gia phản ứng hóa học mạnh => Tính base mạnh CH tr 51 BT1
Phương pháp giải: Các nguyên tố trong bảng tuần hoàn được sắp xếp theo chiều tăng dần của điện tích hạt nhân Lời giải chi tiết: - Các nguyên tố trong bảng tuần hoàn được sắp xếp theo chiều tăng dần sô đơn vị điện tích hạt nhân - Số đơn vị điện tích hạt nhân = số hiệu nguyên tử => Các nguyên tố trong bảng tuần hoàn được sắp xếp theo chiều tăng dần của số hiệu nguyên tử Đáp án C CH tr 51 BT2
Phương pháp giải: - Viết cấu hình electron của nguyên tố Ca => Cấu tạo, vị trí và tính chất của nguyên tố Ca Lời giải chi tiết: - Nguyên tố Ca có số hiệu nguyên tử là 20 => Số electron = 20 và hạt nhân nguyên tử có 20 proton => Cấu hình electron: 1s22s22p63s23p64s2 => Nguyên tử Ca có 4 lớp electron và có 2 electron ở lớp ngoài cùng - Vì có 2 electron ở lớp ngoài cùng => Nguyên tố Ca là kim loại => Phát biểu D không đúng Đáp án D CH tr 51 BT3
Phương pháp giải: - Cấu hình electron: [Ne]3s23p1 => Vị trí của nguyên tố: chu kì, nhóm => Số thứ tự ô => Số electron, số proton => Xác định được tên nguyên tố - Từ vị trí nguyên tố => Tính chất nguyên tố Lời giải chi tiết: - Cấu hình electron: [Ne]3s23p1: 3 lớp electron và có 3 electron ở lớp ngoài cùng => Nguyên tố thuộc chu kì 3, nhóm IIIA => Số thứ tự ô nguyên tố là: 13, nguyên tố Aluminium (Al) - Cấu tạo nguyên tử: + Ô số 13 => Nguyên tử có 13 electron và 13 proton + Có 3 lớp electron và 3 electron ở lớp vỏ ngoài cùng - Tính chất của Al: Có 3 electron lớp ngoài cùng + Tính kim loại + Hóa trị cao nhất với oxygen: III + Công thức oxide cao nhất: Al2O3 + Công thức hydroxide tương ứng: Al(OH)3 + Hydroxide và oxide cao nhất có tính base CH tr 51 BT4
Phương pháp giải: - Cấu hình electron: [Ar]4s2 => Vị trí của nguyên tố: chu kì, nhóm => Số thứ tự ô => Số electron, số proton => Xác định được tên nguyên tố - Từ vị trí nguyên tố => Tính chất nguyên tố Lời giải chi tiết: - Cấu hình electron: [Ar]4s2: 4 lớp electron và có 2 electron ở lớp ngoài cùng - Ví trí: Thuộc chu kì 4, nhóm IIA => Ô số 20 trong bảng tuần hoàn, nguyên tố Calcium (Ca) - Tính chất của Ca: Có 2 electron lớp ngoài cùng + Tính kim loại + Hóa trị cao nhất với oxygen: II + Công thức oxide cao nhất: CaO + Công thức hydroxide tương ứng: Ca(OH)2 + Hydroxide và oxide cao nhất có tính base
|






















Danh sách bình luận