Lý thuyết bài 9: Liên kết ionLiên kết ion Quảng cáo
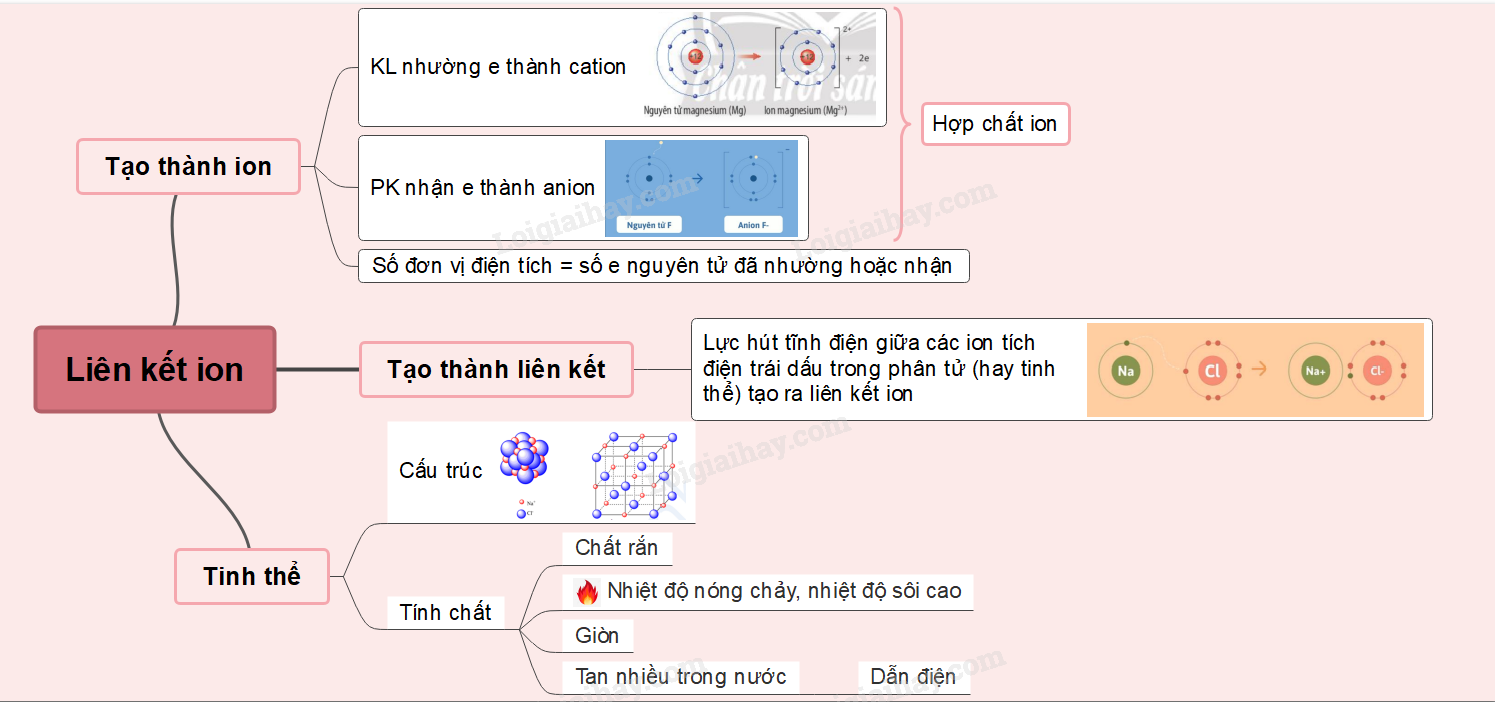
Lý thuyết: Liên kết ion I. Sự tạo thành ion - Kim loại điển hình phản ứng rất mạnh với phi kim điển hình tạo ra hợp chất ion => Kim loại nhường electron tạo thành ion mang điện tích dương (cation). Phi kim nhận electron tạo thành ion mang điện tích âm (anion) Ví dụ:
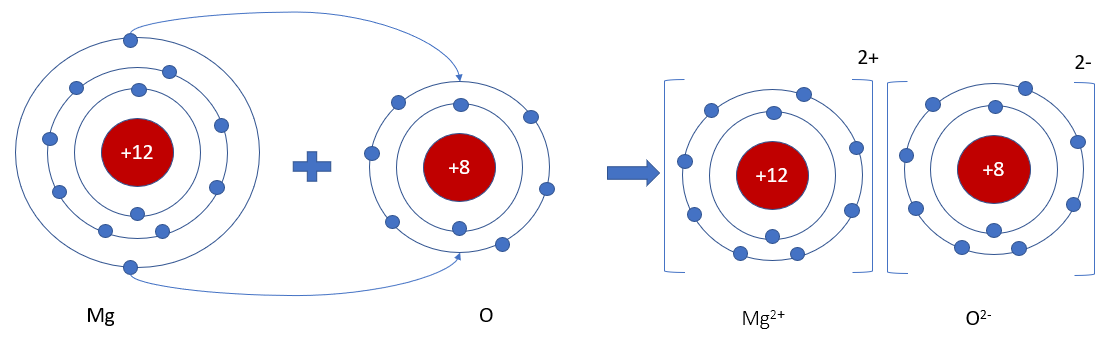
- Số đơn vị điện tích của cation = số electron mà nguyên tử đã nhường Ví dụ: Na → Na+ + 1e Mg → Mg2+ + 2e - Số đơn vị điện tích của anion = số electron mà nguyên tử đã nhận Ví dụ: Cl + 1e → Cl- S + 2s → S2- => Các ion thường có cấu hình electron bền vững của nguyên tử khí hiếm gần nhất với nguyên tố tạo thành ion đó trong bảng tuần hoàn II. Sự tạo thành liên kết ion Ví dụ: Magnesium oxide - Khi kim loại magnesium kết hợp với phi kim oxygen, tạo thành các ion Mg2+ và O2-, các ion này tích điện trái dấu sẽ hút nhau tạo thành liên kết ion
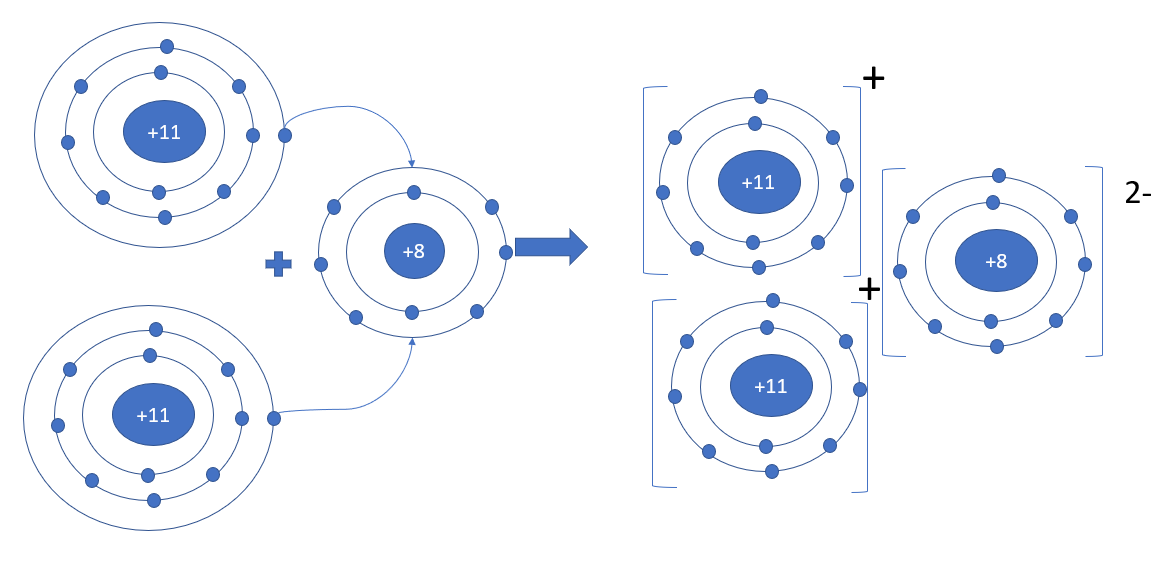
Ví dụ: Sodium oxide - Khi kim loại sodium kết hợp với phi kim oxygen, tạo thành các ion Na+ và O2-. Các ion này tích điện trái dấu sẽ hút nhau tạo thành liên kết ion
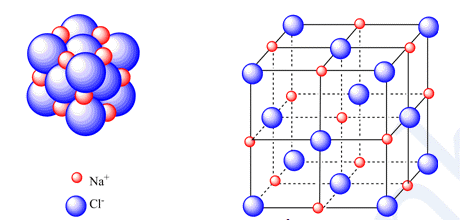
III. Tinh thể ion 1. Cấu trúc của tinh thể ion - Sắp xếp theo trật tự nhất định theo kiểu mạng lưới, trong đó các nút của mạng lưới là những ion dương và ion âm được sắp xếp luân phiên, liên kết chặt chẽ với nhau do sự cân bằng lực hút => Mạng tinh thể ion Ví dụ: Xét tinh thể muối ăn
- Trong tinh thể muối ăn, mỗi ion sodium được bao quanh bởi 6 ion chloride gần nhất và mỗi ion chloride cũng được bao quanh bởi 6 ion sodium gần nhất 2. Độ bền và tính chất của hợp chất ion - Giữa các ion có lực hút tĩnh điện rất mạnh => Hợp chất ion thường là chất rắn, khó nóng chảy, khó bay hơi ở điều kiện thường nhưng khá giòn - Các hợp chất ion thường tan nhiều trong nước. Khi tan trong nước, các ion bị tách khỏi mạng lưới tinh thể, chuyển động khá tự do và là tác nhân dẫn điện.
|






















Danh sách bình luận