Đề thi học kì 1 Hóa 11 Cánh diều - Đề số 2Có bao nhiêu ý kiến sau đây về sulfur dioxide (SO2) là đúng? (1) Có độc tính đối với con người.Đề bài
I. Trắc nghiệm
Chọn đáp án đúng
Câu 1 :
Có bao nhiêu ý kiến sau đây về sulfur dioxide (SO2) là đúng? (1) Có độc tính đối với con người. (2) Phản ứng được với đá vôi. (3) Khí này được tạo thành từ hoạt động của núi lửa trong tự nhiên, từ quá tình đốt cháy nhiên liệu hóa thạch của con người, … (4) Là oxide lưỡng tính.
Câu 2 :
Tiến hành các thí nghiệm cho dung dịch H2SO4 loãng lần lượt tác dụng với: Mg, NaHCO3, BaCl2, CaCO3. Số thí nghiệm xảy ra phản ứng oxi hoá – khử là
Câu 3 :
Một nhà máy luyện kim, ở giai đoạn đầu của quá trình sản xuất Zn từ quặng blend thu được sản phẩm phụ là SO2 theo sơ đồ phản ứng: \({\rm{ZnS}} + {{\rm{O}}_{\rm{2}}} \to {\rm{ZnO}} + {\rm{S}}{{\rm{O}}_{\rm{2}}}\) Đốt cháy 1 tấn quặng blend (chứa 77,6% khối lượng ZnS) bằng không khí, thu được tối đa V m3 khí SO2 (đkc). Giá trị của V là
Câu 4 :
Cho phản ứng sau: \({{\rm{H}}_2}{\rm{(g)}} + \frac{1}{8}{{\rm{S}}_8}{\rm{(g)}} \to {{\rm{H}}_2}{\rm{S(g) }}{\Delta _{\rm{r}}}{\rm{H}}_{{\rm{298}}}^{\rm{0}} = ?\) Tính Biến thiên enthalpy\({\Delta _{\rm{r}}}{\rm{H}}_{{\rm{298}}}^{\rm{0}}\)của phản ứng, cho nhiệt tạo thành chuẩn của S8(g) và H2S(g) lần lượt là 101,3 kJ/mol và -20,6 kJ/mol.
Câu 5 :
Dãy kim loại nào trong các dãy sau đây gồm các kim loại không tác dụng với dung dịch H2SO4 đặc, nguội?
Câu 6 :
Đặc điểm nào sau đây sai khi nói về tính chất vật lý của hợp chất hữu cơ
Câu 7 :
Số chất hữu cơ trong dãy chất sau là: NaHCO3, CH3CN, C2H5Br, CH3CHO, Al4C3, C3H7N, C6H6
Câu 8 :
Cặp chất nào sau đây là dẫn xuất hydrocarbon
Câu 9 :
Hợp chất hữu cơ sau:HCOOCH3 chứa nhóm chứa gì?
Câu 10 :
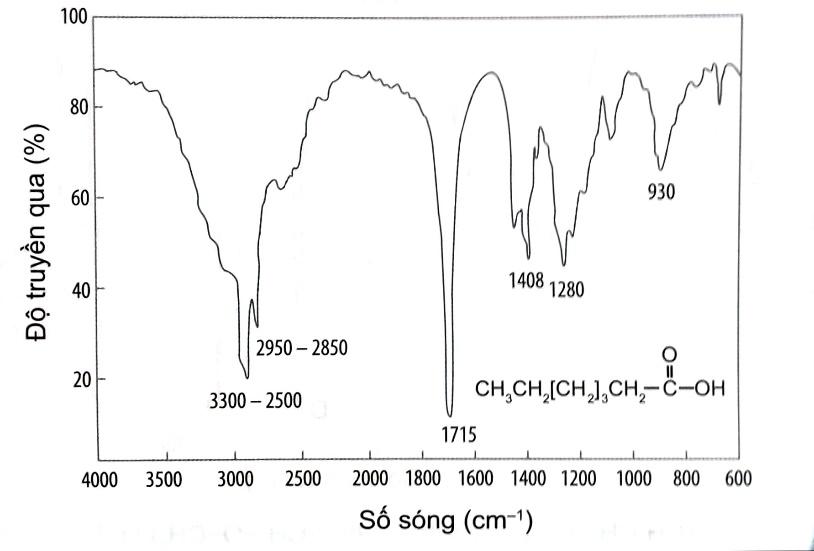
Heptanoic acid được ứng dụng trong mĩ phẩm, nước hoa và các ứng dụng tạo mùi thơm. Dựa vào phổ hồng ngoại, hãy cho biết peak nào giúp dự đoán được trong hợp chất này có nhóm chức carboxyl.
Câu 11 :
Cho các phát biểu sau: (1) Phân tử hợp chất hữu cơ nhất thiết phải chứa carbon; (2) Liên kết chủ yếu trong phân tử hợp chất hữu cơ là liên kết ion; (3) Hợp chất hữu cơ thường khó nóng chảy và khó bay hơi; (4) Hợp chất hữu cơ thường không tan hoặc ít tan trong nước; (5) Phản ứng của các hợp chất hữu cơ thường chậm, không hoàn toàn, không theo một hướng nhất định; (6) Các hợp chất hữu cơ thường khó cháy và khó bị phân huỷ dưới tác dụng của nhiệt. Số phát biểu đúng là
Câu 12 :
Nhận định nào sau đây không đúng?
Câu 13 :
Để tinh chế các chất rắn tan ra khỏi dung dịch thường dùng phương pháp
Câu 14 :
Chuẩn bị: Rượu (được nấu thủ công); bình cầu có nhánh 250 mL, nhiệt kế, ống sinh hàn nước, ống nối, ống đong 50 mL, bình tam giác 100 mL, đá bọt, nguồn nhiệt (bếp điện, đèn cồn).
Câu 15 :
Cặp hợp chất hữu cơ nào sau đây là đồng phân của nhau?
Câu 16 :
Phổ khối lượng (MS) cho biết điều gì ?
Câu 17 :
Phân tích A thì thấy: mC : mH : mO = 4,5 : 0,75 : 4 và 24,79 L hơi A ở đkc nặng 74 gam. CTPT A là
Câu 18 :
Phổ MS của chất Y cho thấy Y có phân tử khối bằng 60. Công thức phân tử nào dưới đây không phù hợp với Y?
Câu 19 :
Hợp chất X có phần trăm khối lượng C, H, O lần lượt bằng 54,54%; 9,10% và 36,36%. Khối lượng mol phân tử của X bằng 88. CTĐGN của X là
II. Tự luận
Lời giải và đáp án
I. Trắc nghiệm
Chọn đáp án đúng
Câu 1 :
Có bao nhiêu ý kiến sau đây về sulfur dioxide (SO2) là đúng? (1) Có độc tính đối với con người. (2) Phản ứng được với đá vôi. (3) Khí này được tạo thành từ hoạt động của núi lửa trong tự nhiên, từ quá tình đốt cháy nhiên liệu hóa thạch của con người, … (4) Là oxide lưỡng tính.
Đáp án : B Phương pháp giải :
Dựa vào tính chất vật lí và hóa học của SO2 Lời giải chi tiết :
(1) đúng (2) đúng (3) đúng (4) sai, vì SO2 là oxide acid Đáp án B
Câu 2 :
Tiến hành các thí nghiệm cho dung dịch H2SO4 loãng lần lượt tác dụng với: Mg, NaHCO3, BaCl2, CaCO3. Số thí nghiệm xảy ra phản ứng oxi hoá – khử là
Đáp án : A Phương pháp giải :
Phản ứng oxi hóa – khử là phản ứng hóa học xảy ra đồng thời quá trình quá trình nhường electron và quá trình nhận electron. Dấu hiệu để nhận biết phản ứng oxi hóa – khử là có sự thay đổi số oxi hóa của các nguyên tử. Lời giải chi tiết :
Thí nghiệm xảy ra phản ứng oxi hoá – khử là: \(\mathop {{\rm{Mg}}}\limits^0 {\rm{ }} + {\rm{ }}{\mathop {\rm{H}}\limits^{ + 1} _{\rm{2}}}{\rm{S}}{{\rm{O}}_{\rm{4}}} \to {\rm{ }}\mathop {{\rm{Mg}}}\limits^{ + 2} {\rm{S}}{{\rm{O}}_{\rm{4}}} + {\rm{ }}{\mathop {\rm{H}}\limits^0 _{\rm{2}}}\) → Chọn A.
Câu 3 :
Một nhà máy luyện kim, ở giai đoạn đầu của quá trình sản xuất Zn từ quặng blend thu được sản phẩm phụ là SO2 theo sơ đồ phản ứng: \({\rm{ZnS}} + {{\rm{O}}_{\rm{2}}} \to {\rm{ZnO}} + {\rm{S}}{{\rm{O}}_{\rm{2}}}\) Đốt cháy 1 tấn quặng blend (chứa 77,6% khối lượng ZnS) bằng không khí, thu được tối đa V m3 khí SO2 (đkc). Giá trị của V là
Đáp án : B Phương pháp giải :
Khi hỏi thể tích khí tối đa thu được, coi hiệu suất phản ứng là 100%. Tính thể tích khí theo công thức: \({\rm{V}} = {\rm{n}} \times 24,79\) Lời giải chi tiết :
Ta có: \({{\rm{m}}_{{\rm{ZnS}}}} = {10^6} \times \frac{{77,6}}{{100}} = 77,6 \times {10^4}{\rm{ (g)}} \Rightarrow {{\rm{n}}_{{\rm{ZnS}}}} = \frac{{77,6 \times {{10}^4}}}{{65 + 32}} = 8000{\rm{ (mol)}}\) Xét phương trình hóa học: \({\rm{ZnS}} + {{\rm{O}}_{\rm{2}}} \to {\rm{ZnO}} + {\rm{S}}{{\rm{O}}_{\rm{2}}}\) \(\begin{array}{l} \Rightarrow {{\rm{n}}_{{\rm{S}}{{\rm{O}}_{\rm{2}}}}}{\rm{ = }}{{\rm{n}}_{{\rm{ZnS}}}} = 8000{\rm{ (mol)}}\\ \Rightarrow {{\rm{V}}_{{\rm{S}}{{\rm{O}}_{\rm{2}}}}} = 8000 \times 24,79 = 198320{\rm{ (L) = 198,32 (}}{{\rm{m}}^3})\end{array}\) → Chọn B.
Câu 4 :
Cho phản ứng sau: \({{\rm{H}}_2}{\rm{(g)}} + \frac{1}{8}{{\rm{S}}_8}{\rm{(g)}} \to {{\rm{H}}_2}{\rm{S(g) }}{\Delta _{\rm{r}}}{\rm{H}}_{{\rm{298}}}^{\rm{0}} = ?\) Tính Biến thiên enthalpy\({\Delta _{\rm{r}}}{\rm{H}}_{{\rm{298}}}^{\rm{0}}\)của phản ứng, cho nhiệt tạo thành chuẩn của S8(g) và H2S(g) lần lượt là 101,3 kJ/mol và -20,6 kJ/mol.
Đáp án : B Phương pháp giải :
Biểu thức tính biến thiên enthalpy ở điều kiện chuẩn theo enthalpy tạo thành: \({\Delta _{\rm{r}}}{\rm{H}}_{298}^0 = \sum {\Delta _{\rm{f}}}{\rm{H}}_{298}^0{\rm{(sp)}} - \sum {\Delta _{\rm{f}}}{\rm{H}}_{298}^0{\rm{(c\~n ) }}\) Lời giải chi tiết :
Biến thiên enthalpy\({\Delta _{\rm{r}}}{\rm{H}}_{{\rm{298}}}^{\rm{0}}\)của phản ứng \({{\rm{H}}_2}{\rm{(g)}} + \frac{1}{8}{{\rm{S}}_8}{\rm{(g)}} \to {{\rm{H}}_2}{\rm{S(g) }}\) \(\begin{array}{l}{\Delta _{\rm{r}}}{\rm{H}}_{{\rm{298}}}^{\rm{0}} = {\Delta _{\rm{f}}}{\rm{H}}_{{\rm{298}}}^{\rm{0}}{\rm{(}}{{\rm{H}}_2}{\rm{S}}) - \left[ {\frac{1}{8}{\Delta _{\rm{f}}}{\rm{H}}_{{\rm{298}}}^{\rm{0}}{\rm{(}}{{\rm{S}}_8}) + {\Delta _{\rm{f}}}{\rm{H}}_{{\rm{298}}}^{\rm{0}}{\rm{(}}{{\rm{H}}_2})} \right]\\{\rm{ = }} - 20,6 - \left[ {\frac{1}{8} \times 101,3 + 0} \right]\\{\rm{ }} \approx {\rm{ }} - 33,3{\rm{ (kJ)}}\end{array}\)
Câu 5 :
Dãy kim loại nào trong các dãy sau đây gồm các kim loại không tác dụng với dung dịch H2SO4 đặc, nguội?
Đáp án : A Phương pháp giải :
- Các kim loại bị thụ động bởi dung dịch H2SO4 đặc, nguội là Fe, Al, Cr. - Các kim loại không bị oxi hóa bởi dung dịch H2SO4 đặc, nguội là Au, Pt. Lời giải chi tiết :
Các kim loại không tác dụng với dung dịch H2SO4 đặc, nguội: Al, Fe, Au, Pt. → Chọn A.
Câu 6 :
Đặc điểm nào sau đây sai khi nói về tính chất vật lý của hợp chất hữu cơ
Đáp án : B Phương pháp giải :
Dựa vào tính chất vật lí của hợp chất hữu cơ Lời giải chi tiết :
Các hợp chất hữu cơ hầu như không tan trong nước Đáp án B
Câu 7 :
Số chất hữu cơ trong dãy chất sau là: NaHCO3, CH3CN, C2H5Br, CH3CHO, Al4C3, C3H7N, C6H6
Đáp án : A Phương pháp giải :
Hợp chất hữu cơ là hợp chất của carbon trừ muối carbonat, carbon dioxde, carbon mono oxide, cyanide,… Lời giải chi tiết :
C2H5Br, CH3CHO, C3H7N, C6H6 là những hợp chất hữu cơ Đáp án A
Câu 8 :
Cặp chất nào sau đây là dẫn xuất hydrocarbon
Đáp án : C Phương pháp giải :
Dẫn xuất hydrocarbon là hợp chất hữu cơ chứa các nguyên tố khác ngoài carbon và hydrogen như Cl, O, S, N… Lời giải chi tiết :
Đáp án C
Câu 9 :
Hợp chất hữu cơ sau:HCOOCH3 chứa nhóm chứa gì?
Đáp án : C Phương pháp giải :
Dựa vào đặc điểm và tên gọi của các nhóm chức Lời giải chi tiết :
HCOOCH3 có chứa nhóm ester Đáp án C
Câu 10 :
Heptanoic acid được ứng dụng trong mĩ phẩm, nước hoa và các ứng dụng tạo mùi thơm. Dựa vào phổ hồng ngoại, hãy cho biết peak nào giúp dự đoán được trong hợp chất này có nhóm chức carboxyl.
Đáp án : A Phương pháp giải :
Để xác định được tín hiệu (peak) của nhóm chức carboxyl trên phổ IR của heptanoic acid, ta xác định số sóng của nhóm chức C = O và O-H rồi tìm số sóng có giá trị nằm trong khoảng đó trên phổ IR của heptanoic acid.
Lời giải chi tiết :
Trên phổ IR của heptanoic acid, peak 1715 cm-1 giúp dự đoán được trong hợp chất này có nhóm chức C=O và peak nằm trong khoảng 3300 – 2500 cm-1 giúp dự đoán được trong hợp chất này có nhóm chức O-H. Dựa vào hai giá trị trên, ta có thể dự đoán hợp chất này có nhóm chức carboxyl trong phân tử.
Câu 11 :
Cho các phát biểu sau: (1) Phân tử hợp chất hữu cơ nhất thiết phải chứa carbon; (2) Liên kết chủ yếu trong phân tử hợp chất hữu cơ là liên kết ion; (3) Hợp chất hữu cơ thường khó nóng chảy và khó bay hơi; (4) Hợp chất hữu cơ thường không tan hoặc ít tan trong nước; (5) Phản ứng của các hợp chất hữu cơ thường chậm, không hoàn toàn, không theo một hướng nhất định; (6) Các hợp chất hữu cơ thường khó cháy và khó bị phân huỷ dưới tác dụng của nhiệt. Số phát biểu đúng là
Đáp án : A Phương pháp giải :
- Hợp chất hữu cơ là hợp chất của carbon, trừ một số hợp chất oxide của carbon, muối carbonate, các carbide,… - Các hợp chất hữu cơ có đặc điểm chung sau đây: + Thành phần phân tử nhất thiết phải chứa nguyên tố carbon, thường có hydrogen, oxygen, nitrogen, halogen, sulfur, phosphorus,... + Liên kết hoá học chủ yếu là liên kết cộng hoá trị. Các nguyên tử carbon không những có khả năng liên kết với nguyên tử của các nguyên tố khác mà còn có thể liên kết với nhau tạo thành mạch carbon. + Nhiệt độ nóng chảy thấp, nhiệt độ sôi thấp (dễ bay hơi) và thường không tan hoặc ít tan trong nước, tan trong các dung môi hữu cơ. + Dễ cháy, kém bền với nhiệt nên dễ bị nhiệt phân huỷ. + Phản ứng của các hợp chất hữu cơ thường xảy ra chậm, theo nhiều hướng và tạo ra hỗn hợp các sản phẩm. Để tăng tốc độ phản ứng thường cần đun nóng và có xúc tác. Lời giải chi tiết :
→ Chọn A.
Câu 12 :
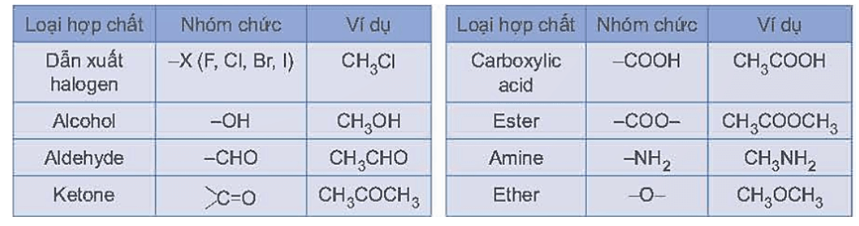
Nhận định nào sau đây không đúng?
Đáp án : B Phương pháp giải :
Hợp chất hữu cơ đa chức có 2 nhóm chức giống nhau trở lên. Hợp chất hữu cơ tạp chức có 2 nhóm chức khác nhau trờ lên. Một số loại nhóm chức cơ bản được thể hiện trong bảng sau:
Lời giải chi tiết :
(1) CH4; (2) CH3OH; (3) CH2=CH2; (4) CH2OH–CHOH–CH2OH; (5) CH ≡CH; (6) CH3CH=O; (7) CH3COOH; (8) HOOC[CH2]4COOH; (9) C6H6 (benzen); (10) H2NCH2COOH; (11) CH2OH[CHOH]4CH=O. - Hợp chất hữu cơ đa chức: (4) CH2OH–CHOH–CH2OH; (8) HOOC[CH2]4COOH. Hợp chất hữu cơ tạp chức: (10) H2NCH2COOH; (11) CH2OH[CHOH]4CH=O. \( \Rightarrow \)Nhận định A đúng. - Alcohol: (2) CH3OH; (4) CH2OH–CHOH–CH2OH. Carboxylic acid: (7) CH3COOH; (8) HOOC[CH2]4COOH. \( \Rightarrow \)Nhận định B không đúng. - Hydrocarbon: + Hydrocarbon no: (1) CH4; + Hydrocarbon không no: (3) CH2=CH2; (5) CH ≡CH. + Hydrocarbon thơm: (9) C6H6 (benzen). \( \Rightarrow \)Nhận định C đúng. - Dẫn xuất hydrocarbon: (2) CH3OH; (4) CH2OH–CHOH–CH2OH; (6) CH3CH=O; (7) CH3COOH; (8) HOOC[CH2]4COOH; (10) H2NCH2COOH; (11) CH2OH[CHOH]4CH=O. Dẫn xuất hydrocarbon đơn chức: (2) CH3OH; (6) CH3CH=O; (7) CH3COOH. \( \Rightarrow \)Nhận định D đúng. → Chọn B.
Câu 13 :
Để tinh chế các chất rắn tan ra khỏi dung dịch thường dùng phương pháp
Đáp án : A Phương pháp giải :
Nguyên tắc của phương pháp kết tinh: Với hỗn hợp các chất rắn, người ta thường dựa vào độ tan khác nhau và sự thay đổi độ tan theo nhiệt độ của chúng để tách và tinh chế. Lời giải chi tiết :
Để tinh chế các chất rắn tan ra khỏi dung dịch thường dùng phương pháp kết tinh. → Chọn C.
Câu 14 :
Chuẩn bị: Rượu (được nấu thủ công); bình cầu có nhánh 250 mL, nhiệt kế, ống sinh hàn nước, ống nối, ống đong 50 mL, bình tam giác 100 mL, đá bọt, nguồn nhiệt (bếp điện, đèn cồn).
Đáp án : A Phương pháp giải :
Dựa vào các phương pháp tinh chế và tách biệt hợp chất hữu cơ Lời giải chi tiết :
(1) đúng vì nhiệt độ sôi của H2O lớn hơn ethanol (2) đúng (3) đúng (4) đúng (5) sai, bình hứng thu được rượu tinh khiết (6) đúng
Câu 15 :
Cặp hợp chất hữu cơ nào sau đây là đồng phân của nhau?
Đáp án : B Phương pháp giải :
Đồng phân là những hợp chất có cùng công thức phân tử khác nhau về công thức cấu tạo Lời giải chi tiết :
CH3–O–CH3 và C2H5OH là đồng phân có cùng công thức phân tử C2H6O
Câu 16 :
Phổ khối lượng (MS) cho biết điều gì ?
Đáp án : D Lời giải chi tiết :
Phổ khối lượng MS cho biết phân tử khối của một chất
Câu 17 :
Phân tích A thì thấy: mC : mH : mO = 4,5 : 0,75 : 4 và 24,79 L hơi A ở đkc nặng 74 gam. CTPT A là
Đáp án : D Phương pháp giải :
Dựa vào tỉ lệ khối lượng của nguyên tố từ đó tính tỉ lệ về số mol. Lời giải chi tiết :
\(\begin{array}{l}{m_C}:{m_H}:{m_O} = 4,5;0,75:4\\ \to {n_C}:{n_H}:{n_O} = \frac{{4,5}}{{12}}:\frac{{0,75}}{1}:\frac{4}{{16}} = 0,375:0,75:0,25\\ \to {n_C}:{n_H}:{n_O} = 1,5:3:1 = 3:6:2\end{array}\) Công thức đơn giản nhất của hợp chất A là: C3H6O2. Vì M A = 74 => Công thức phân tử A: C3H6O2 Đáp án D
Câu 18 :
Phổ MS của chất Y cho thấy Y có phân tử khối bằng 60. Công thức phân tử nào dưới đây không phù hợp với Y?
Đáp án : C Phương pháp giải :
Dựa vào phân tử khối của Y = 60 Lời giải chi tiết :
Đáp án C.
Câu 19 :
Hợp chất X có phần trăm khối lượng C, H, O lần lượt bằng 54,54%; 9,10% và 36,36%. Khối lượng mol phân tử của X bằng 88. CTĐGN của X là
Đáp án : A Lời giải chi tiết :
\(\begin{array}{l}\% mC:\% mH:\% mO = 54,54\% :9,10\% :36,36\% \\C:H:O = \frac{{54,54}}{{12}}:\frac{{9,1}}{1}:\frac{{36,36}}{{16}} = 4,545:9,1:2,27\\ = 2:4:1\end{array}\) Công thức đơn giản nhất của X là: (C2H4O)n Đáp án A
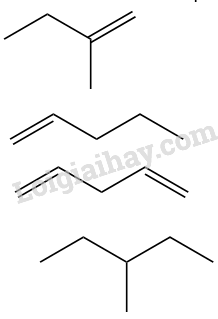
Đáp án : C Lời giải chi tiết :
Công thức 1 và 4 có mạch phân nhánh Đáp án C
II. Tự luận
Lời giải chi tiết :
- Phần 1: nNH3 = 0,03 mol; nFe(OH)3 = 0,01 mol; nBaSO4 = 0,02 mol. (1) NH4+ + OH- → NH3↑ + H2O 0,03 ← 0,03 (2) Fe3+ + 3OH- → Fe(OH)3↓ 0,01 ← 0,01 - Phần 2: (3) Ba2+ + SO42- → BaSO4↓ 0,02 ← 0,02 BTĐT: 3.0,01 + 0,03 = 2.0,02 + nCl- ⇒ nCl- = 0,02 mol. => Khối lượng muối khan: mmuối = 2(56.0,01 + 96.0,02 + 18.0,03 + 35,5.0,02) = 7,46 gam. Lời giải chi tiết :
Số mol HCl ban đầu = 10.10-3.0,2 = 2.10-3 (mol) \[\begin{array}{l}NaOH\,\,\,\,\,\,\,\,\,\, + \,\,\,\,\,\,HCl\,\,\,\,\,\,\,\,\, \to \,\,\,\,\,\,\,NaCl\,\,\,\,\,\,\, + \,\,\,\,\,\,\,\,\,{H_2}O\\1,{02.10^{ - 3}}\,\,\, \to \,\,1,{02.10^{ - 3}}\,\,(mol)\end{array}\] Số mol HCl phản ứng với NH3 = 2.10-3 – 1,02.10-3 = 0,98.10-3 (mol) \[\left. \begin{array}{l}N{H_3}\,\,\,\,\,\,\,\,\,\, + \,\,\,\,\,\,HCl\,\,\,\,\,\,\,\,\, \to \,\,\,\,\,\,\,N{H_4}Cl\,\\0,{98.10^{ - 3}}\, \leftarrow \,\,0,{98.10^{ - 3}}\,\,(mol)\end{array} \right\} \Rightarrow {C_{M(N{H_3})}} = \frac{{0,{{98.10}^{ - 3}}}}{{{{5.10}^{ - 3}}}} = 0,196(M)\]
|

























Danh sách bình luận